基于快速叶绿素荧光技术的油菜冠层生化参数垂直异质性分析
张佳菲 万亮 何勇 岑海燕

摘要: 准确获取作物冠层生化信息对监测作物生长和指导精准施肥具有重要意义。现有的作物生化参数的垂直分布研究以高光谱遥感反演为主,缺乏与光合生理的联系。本研究主要探究了不同氮素处理水平下油菜苗期冠层内的叶绿素、类胡萝卜素、干物质和水分等生化参数的垂直分布变化特性,同时利用快速叶绿素荧光技术测定了叶片的光合性能,并通过线性回归分析和主成分分析进一步剖析了荧光响应与生化参数的内在联系。试验结果表明:(1)苗期中期油菜冠层的叶绿素含量、类胡萝卜素含量、干物质和水分含量均呈抛物线型的非均匀垂直分布,而叶绿素与类胡萝卜素的比值具有与其他生化参数不同的垂直分布模式,其随着叶位升高和施氮量的增加逐渐下降,与推动力DFTotal、电子链末端量子产额φRo等荧光参数的垂直分布模式相同;(2)荧光参数,特别是DFTotal,对油菜叶片叶绿素与类胡萝卜的比值、叶绿素和干物质含量具有较强的评估能力;(3)缺氮会降低苗期油菜叶片的光系统I和II(PSI和PSII)性能,通过最大光化学效率φPo等荧光参数可对氮素胁迫进行诊断;而不同叶位叶片在PSI性能即电子末端传递效率上具有显著差异,通过DFTotal可有效表征冠层生化参数的垂直异质性。上述结果表明,应用快速叶绿素荧光技术对作物进行生化信息的垂直异质性监测具有可行性,可为指导精准施肥和提高优质优产提供新思路和技术支撑。
关键词: 快速叶绿素荧光;JIP-测定;垂直异质性;叶绿素;类胡萝卜素;氮素
中图分类号: S363 文献标志码: A 文章编号: 202103-SA005
引用格式:张佳菲, 万亮, 何勇, 岑海燕. 基于快速叶绿素荧光技术的油菜冠层生化参数垂直异质性分析[J]. 智慧农业(中英文), 2021, 3 (1): 40-50.
Citation:ZHANG Jiafei, WAN Liang, HE Yong, CEN Haiyan. Vertical heterogeneity analysis of biochemical parameters in oilseed rape canopy based on fast chlorophyll fluorescence technology[J]. Smart Agriculture, 2021, 3 (1): 40-50. (
1 引 言
油菜是世界上仅次于大豆的第二大油料作物,在全球石油资源替代、动物饲料和生物燃料供应中发挥着重要作用[1]。油菜生化表型信息(例如色素、干物质、水分等)的快速获取对于优良品质选育、提高作物品质和产量具有重要意义。而叶片生化特性在冠层内往往呈现显著的非均匀垂直分布,例如,光合作用较为活跃的上层叶片中的氮浓度往往较高[2,3]。作物冠层内的这种空间异质性可以被视为一种在有限的营养资源和变化环境条件中不断进行叶片之间的调整分配,以最大限度地提高冠层光合速率的适应性策略[2,4]。因此,有必要对作物冠层内生化组分信息的垂直异质性进行定量研究与分析,为实施油菜生长信息动态监测和精准科学施肥提供有效的理论方法和技术支撑。
目前,对于作物生化组分垂直分布的研究以高光谱遥感评估作物的氮素垂直分布为主,通过统计模型建立冠层光谱与各个垂直层氮素的联系[5-8]。然而,基于反射率的监测方法往往包含了来自植物和土壤的混合信号,降低了反演的准确性和稳健性,且与作物光合作用等生理机制的联系并不是很清楚[9,10]。此外,对于光合色素等与植物光合生理联系十分紧密的生化组分的垂直分布研究相对较少,无法满足田间作物优良品质选育和关键生育期施氮管理等依赖高通量表型信息获取的要求。
在植物光合作用中,叶绿素分子吸收的能量一般有三种转化形式:光化学、热耗散和叶绿素荧光[11]。也就是说,未被光化学反应消耗或转化为热量的剩余光能则以荧光的形式从植物中辐射出来。而植物衰老或逆境胁迫、高温低温、盐胁迫以及干旱等都会引起这三种能量发生变化[12,13]。因此,通过叶绿素荧光的变化可以探测到植物叶片生理状态的变化,如光能的吸收与转换、反应中心的状态、过剩光能及其耗散、光系统II(Photosystem II,PSII)供体侧和受体的活性、光合作用光抑制与光破坏等[14,15]。
与传统的气体交换测量方法相比,叶绿素荧光技术已经成为一种了解光合功能、生理特性的时空动态变化更有效、便捷且高通量的方法。其优势主要在于荧光信号只来自于植物本身,因此可以有效避免来自于土壤等其他信号的干扰,从而直接反映植物最真实的生理状态。除了植物逆境生理响应的检测外,已有许多研究将叶绿素荧光应用于分析作物叶绿素含量、氮营养指数(Nitrogen Nutrient Index,NNI)等生理生态指标来指导作物生长过程中的施肥。荧光参数会受氮素等营养元素供应的显著影响,随着施氮量增加,水稻中非光化学淬灭(Non-Photochemical Quenching,NPQ)也会增加[16],而在棉花中过量施氮则使作物最大光化学效率(Fv /Fm)和电子传递速率(Electron Transport Rate,ETR)等显著下降[17]。此外,一些研究也利用荧光参数在不同叶层观测到PSII活性和能量利用效率的显著差异[18,19],说明了叶绿素荧光响应在对作物光合生理表征,特别是垂直异质性表征的敏感性和巨大潜能。而目前对于作物冠层内荧光参数的垂直异质性的研究还较少。因此,利用叶绿素荧光技术探索作物冠层内荧光参数的垂直异质性以及与生化信息的关系,并作为一种评价作物生化参数的替代方法具有非常大的前景。
本研究主要用分光光度计测定并分析了油菜苗期冠層叶绿素、类胡萝卜素、干物质和水分等生化参数的垂直分布变化特性,同时利用快速叶绿素荧光技术探究了冠层内光合生理特性的垂直异质性,剖析了荧光响应与生化参数的内在联系与生理机制,最终确定了最适宜表征油菜生化信息的荧光参数。
2 材料与方法
2.1 试验设计
本研究的试验对象为甘蓝型油菜品种浙双758(Brassica napus L.),于浙江大学紫金港校区农业试验站试验田供试土壤设置3个氮素水平,分别为不施氮(N0,0 kg N/ha)、正常施氮(N1,215 kg N/ha)和过量施氮(N2,430 kg N/ha),即N0:N1:N2= 0:1:2。氮肥以3:1:2的比例分别施于油菜移栽前、苗期初期和蕾苔期,磷肥和钾肥则均作基肥施用。试验田采用随机区组排列,每个氮素水平3个重复,共9个小区。小区面积为6.6 m2(5.5 m×1.2 m),每个小区南北和东西方向各设置宽0.4 m的保护道。油菜于2019年11月初移栽,试验于2020年1月6日(苗期中期)进行。
2.2 数据获取
2.2.1 快速叶绿素荧光数据采集
在每个氮素水平的3个小区内,随机选取3个长势相近且良好的油菜样本,沿主茎自下而上的底1叶、底2叶、底3叶、底4叶、底5叶、底6叶和底7叶分别标记为L1、L2、L3、L4、L5、L6和L7,并根据所在垂直空间的相对位置划分为基叶(L1、L2)、中叶(L3~L5)和顶叶(L6、L7)。试验时选取每个叶片叶脉右侧中上部区域的点作为采样点。在田间采用叶片夹(直径4 mm)对叶片相应的采样点进行20 min的暗适应处理后,利用植物效率分析仪Handy-PEA(Handy Plant Efficiency Analyzer,Hansatech Instruments Ltd.,UK)进行快速叶绿素荧光诱导动力学曲线的测量。
2.2.2 生化参数测定
完成田间数据测量后,采集油菜各个叶位的叶片样本,在实验室对每个叶位的采样点用直径0.85 cm的打孔器打孔称量鲜重,并用1.8 mL 95%的乙醇在黑暗环境中浸泡24 h,用分光光度计(Epoch,BioTek Instruments,Winooski,USA)测定色素含量(叶绿素a、叶绿素b和类胡萝卜素含量)。随后将完成色素测定的样本置于60 ℃的烘箱中烘干至恒重并称量其干重,并用鲜重减去干重计算得到水分含量。
2.3 研究方法
2.3.1 OJIP曲线及JIP-测定参数
绿色植物或含有叶绿素的部分组织进行一段时间的暗适应处理,被突然暴露在可见光下便会发出一种强度不断变化的暗红色荧光信号,也称为Kautsky效应[20]。这期间,荧光信号先上升,后下降。将其刚暴露在光下时的最低荧光定义为O点,最高峰定义为P点,中间分别有J点(2 ms)和I点(30 ms)两次阶跃,快速叶绿素荧光诱导动力学(OJIP)曲线指的就是荧光从O点到P点的变化过程[21,22]。
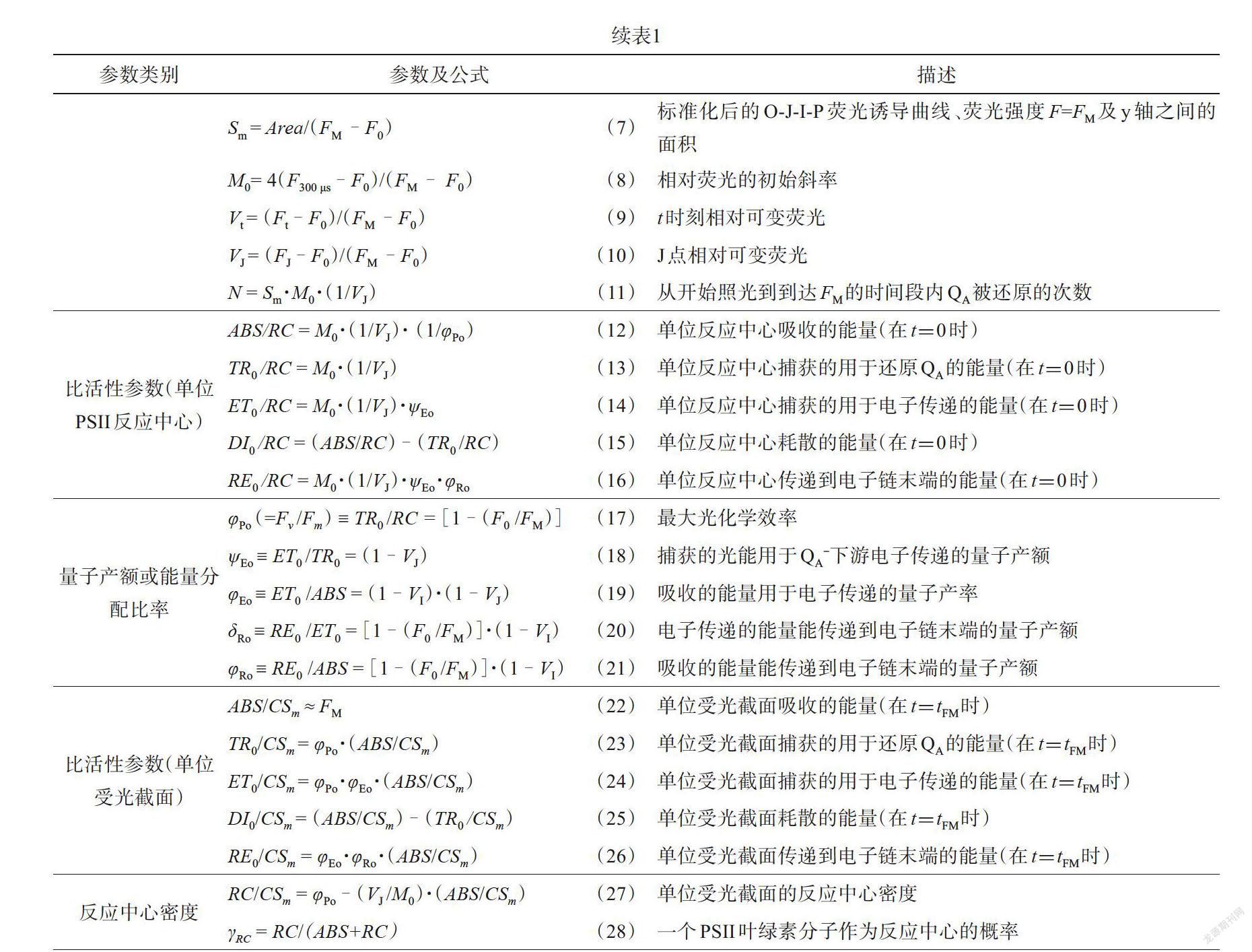
OJIP曲线形态的变化反映了植物叶片PSII的光合原初反应电子传递链以及光合机构的结构和状态的变化,通过JIP-测定的方法可以对该变化进行定量分析和生理解释。其理论基础是生物膜能量流动模型,天线色素将小部分吸收(Absorption,ABS)能转化为热和荧光,其余部分则被反应中心(Reaction Center,RC)所捕获(Trapping,TR),并将处于氧化态的初级电子受体QA激发还原为QA-,继续往下进行电子传递(Electron Transfer,ET),从而形成电子传递链[23]。以此过程为基础推算出一系列叶绿素荧光参数的数据处理方法即为JIP-测定方法,具体的计算公式和参数含义如表1所示[21]。
2.3.2 主成分分析
主成分分析(Principal Component Analysis,PCA)以多变量数据为处理对象,旨在利用“降维”的思想,把多指标转化为少数几个综合指标[24]。基于OJIP曲线的JIP-测定参数数量较多,且有些参数之间存在高度的相关性,从而增加了问题分析的复杂性。因此利用PCA将数据从高维空间转向低维空间,便于进一步对不同氮素处理和不同叶位叶片荧光参数进行统计分析。
2.3.3 数据处理与分析
对不同氮素处理水平下不同叶位的叶片生化参数,采用最小显著差异法(Least Significant Difference,LSD)检验显著性差异(P < 0.05)。JIP-测定参数的PCA、生化参数和荧光参数之间的相关性分析以及显著性分析均采用SPSS Statistics 19软件(IBM Corporation,USA)。
3 结果与分析
3.1 油菜冠层生化参数的垂直异质性
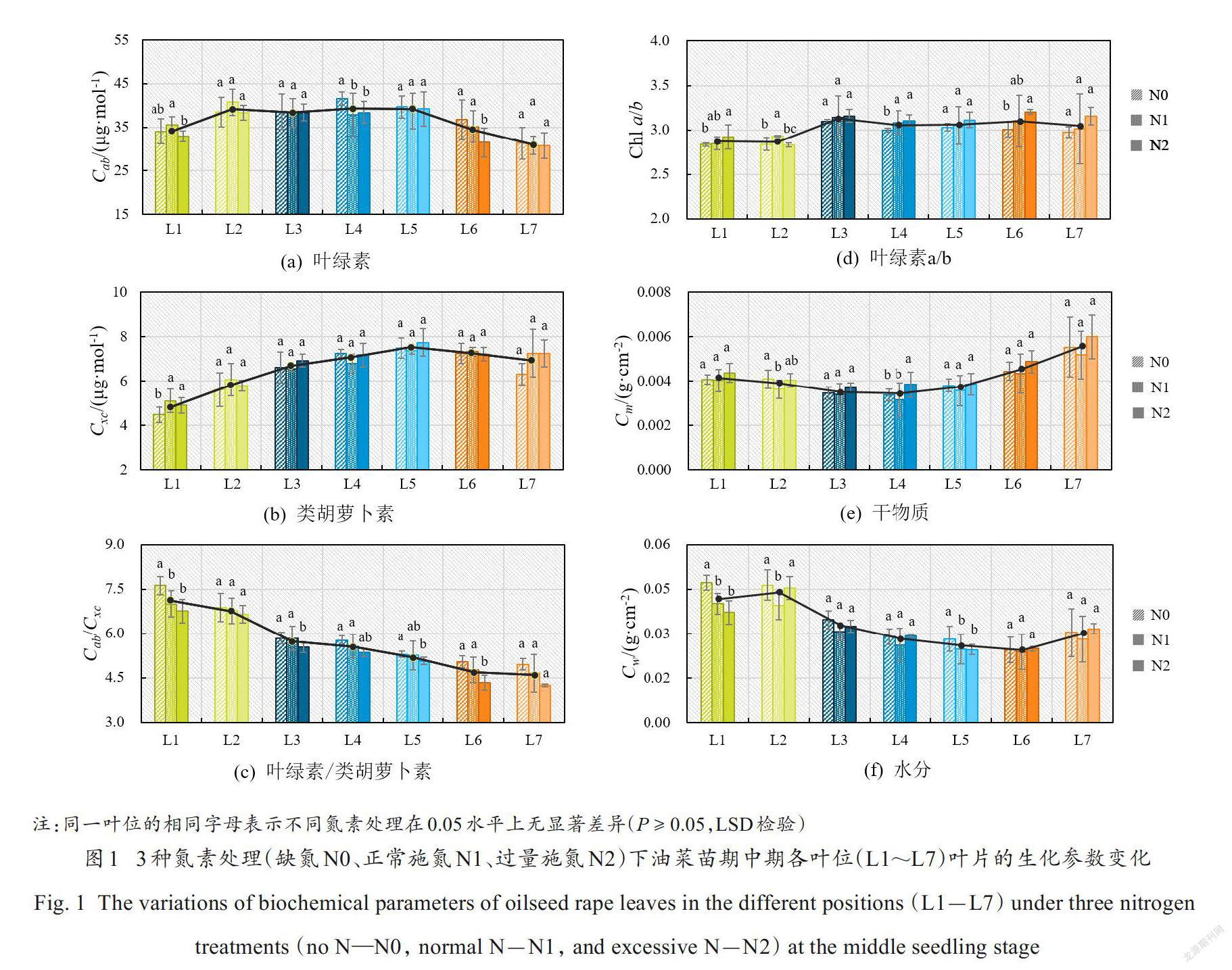
油菜苗期中期各个叶位下叶片的叶绿素含量(Cab)、类胡萝卜素含量(Cxc)、叶绿素与类胡萝卜素含量的比值(Cab /Cxc)、叶绿素a和叶绿素b含量的比值(Chl a/b)、干物质含量(Cm)以及水分含量(Cw)的变化結果如图1所示。可以看到,上述生化参数值在不同叶位的叶片上均发生了显著的变化,即垂直异质性,且不同氮素处理水平下它们垂直空间上的变化基本一致。具体地,油菜叶片叶绿素(图1(a))和类胡萝卜素(图1(b))含量从底部到顶部呈现开口向下抛物线型的变化,干物质(图1(e))和水分(图1(f))含量则呈现开口向上抛物线型的变化,说明在冠层垂直空间水平上中叶(L3~L5)的叶绿素、类胡萝卜素含量最高,干物质和水分含量则最低,而基叶(L1、L2)相较于顶叶(L6、L7)具有更高的叶绿素、水分含量和较低的类胡萝卜素、干物质含量。由于基叶一定程度上会受到遮蔽,其接受的光强相对顶叶较少,因此其所需要用来进行光保护的类胡萝卜素相对就少,且其干物质需要向上部新叶转运而较低。特别的是,正常氮组(N1)的基叶叶绿素和类胡萝卜素含量均高于缺氮组(N0)和过氮组(N2),而其中叶的叶绿素、类胡萝卜素、干物质、水分含量则均为最低。此外,顶叶的叶绿素含量随着施氮量增加有下降的变化趋势。这一结果表明氮素胁迫虽然对油菜冠层内生化参数的垂直分布模式没有显著的影响,但在缺氮的情况下,油菜吸收的氮素会优先分配给顶叶以满足其生长需求[25],而氮素充足的情况下则会不断供应更多的顶部新叶生长,从而出现了缺氮组顶叶叶绿素含量较高的情况。
叶绿素与类胡萝卜素含量的比值(图1(c))从底部到顶部呈现较为显著的下降趋势,进一步反映了顶叶的叶绿素含量较少而类胡萝卜素含量较高的特点,基叶则反之。叶绿素含量与类胡萝卜素含量的比值有效反映了光保护叶黄素循环响应[26,27],说明在吸收光能较多的顶叶中具有更活跃的叶黄素循环进行光保护。此外,随着施氮量的增加,比值也逐渐减小,这一结果也表明了叶绿素与类胡萝卜素含量的比值与叶位(叶龄)、施氮水平均具有潜在的良好线性关系。叶绿素a/b反映了天线尺寸的大小,植物通过调整叶绿素a/b来适应不同光强或氮素供应的环境。在基叶中叶绿素a和叶绿素b含量的比值(图1(d))显著低于中叶和顶叶,且在各个叶位中基本都是随着施氮量的增加而增加,这反映了基叶中的光合系统具有更大的天线尺寸(捕光色素叶绿素b所占的比例大)以适应较低的外界光强[28]。
3.2 基于JIP-测定参数的油菜冠层光合生理垂直異质性
以L1底叶的各个JIP-测定参数值为基准,赋值为1,并将其他叶位的参数值与其分别做商,可有效观察到油菜各个叶位叶片的JIP-测定参数差异,不同氮素处理水平下的结果如图2所示。3个氮素水平中均出现较为显著变化的参数是DFTotal、φRo、RE0 /RC、Sm和N,它们在顶叶中出现了极小值,说明在顶叶中的电子链末端性能最弱。缺氮组(N0)和正常氮组(N1)中顶叶单位反应中心或单位受光截面耗散的热量(DI0 /RC和DI0 /CSm)均为最大,因为冠层中各个叶位叶片所吸收的光能随着叶位的升高是逐渐增加的,顶叶吸收较多的光能而使得其热耗散也较高。但这个值在过量施氮组(N2)中却并不是最大的,这可能与过量施氮组顶叶和中叶绿素a和叶绿素b含量的比值较高有关,天线尺寸相对较小(捕光色素叶绿素b较少)使其捕获的光能并没有比其他叶位的叶片多。
3.3 油菜叶片生化参数与JIP-测定参数的相关性分析
为进一步研究油菜叶片生化参数与JIP-测定参数之间的潜在联系,对两者进行皮尔逊相关性分析,所得结果如图3所示。叶绿素和类胡萝卜素比值的对数值与JIP-测定参数的相关性较比值本身有所提高。Cab、Cab /Cxc、log(Cab /Cxc)、Cm与多个JIP-参数之间存在较高的相关性,而Cxc、Chl a/b和Cw等与JIP-测定参数之间的相关性较低。其中,δRo、φRo和DFTotal与叶绿素含量呈显著的高度正相关关系(r > 0.5,P < 0.01),DFTotal、φRo、PIABS、Sm和RE0 /RC与叶绿素和类胡萝卜素的比值和其比值的对数均呈显著的高度正相关关系,ABS/RC与干物质含量呈高度正相关关系,而δRo和DFTotal则与其呈显著的高度负相关关系(r < -0.5,P < 0.01)。这说明一定程度上提高叶绿素含量和其与类胡萝卜素的比值将显著提高原初光化学反应中电子传递到PSI传递链末端的量子产额和推动力,而干物质含量过高和水分含量过少则会阻碍电子在传递链中的传递过程,因为作为最初电子供体的水分含量减少将使光合作用中水电解的过程受到影响。
从与叶绿素与类胡萝卜比值的对数(图4(a)~图4(c))、叶绿素含量(图4(d)~图4(f))和干物质(图4(g)~图4(i))相关性较高的3个JIP-测定参数进行线性回归的结果可以看到,3个生化参数均与DFTotal具有较显著的线性关系(P < 0.0001),决定系数R2分别为0.45、0.35和0.27。结合不同叶位的散点分布情况可以看出,相比于叶绿素含量和干物质含量,叶绿素含量与类胡萝卜素含量比值的对数值能有效区分出基叶和顶叶,进一步说明了DFTotal参数具有反映光保护叶黄素循环等光合生理垂直异质性的潜能。
3.4 基于PCA的JIP-测定参数聚类分析
通过油菜苗期中期叶片JIP-测定参数的主成分分析,进一步探究在不同叶位和不同氮素处理下叶片光合机构结构和功能的变化规律,结果如图5所示。可以看到,JIP-测定参数的分布基本形成了三个较好分离的簇。其中两个(Cluster 1和Cluster 3)位于第一个主成分(PC1)上,一个(Cluster 2)位于第二个主成分(PC2)上。结合每一簇中JIP-测定参数的生理意义,可以发现它们分别对应了不同的光合生理过程:光能吸收和捕获阶段(Cluster 1)、电子传递和热耗散阶段(Cluster 2)和电子链末端传递阶段(Cluster 3)。进一步可以推得,PC1可对应PSI的活性,较高的值表示较高的PSI性能(高电子链末端传输效率),代表参数有φRo、δRo、RE0 /RC等;PC2则对应PSⅠI活性,较高的值表示较高的PSⅠI性能(高光吸收、光化学和电子传输效率),代表参数包括ABS/CSm、φPo、ET0 /CSm等。
从不同氮素处理实验组的聚类结果可以发现,随着施氮水平的提高,聚类的位置也在发生改变:缺氮组(N0)主要位于第三、四象限,正常施氮组(N1)主要分布在第二、三和四象限的Cluster1和Cluster3之间,而过量施氮组(N2)则主要分布于第一象限的Cluster2。结合JIP-测定参数分析可知,相较于正常施氮,过量施氮组油菜叶片具有更高的PSII和PSI性能,而缺氮组油菜叶片的PSII和PSI性能均较弱,特别是在光捕获和能量传递阶段;同一施氮水平下,随着叶位的变化,聚类的位置也发生了变化:颜色较深的数据点所代表的底部叶片(L1)主要分布在第一、四象限,而颜色较浅的数据点所代表的顶部新叶(L7)则位于第二、三象限,表明油菜顶部新叶较底部成熟的叶片在PSI性能上有显著的差异,即电子链末端传输效率比较低。
结合图3、图4中的结果,可以看到与叶片生化参数具有较高相关性的JIP-测定参数均分布在反映电子传递链末端性能的Cluster 3内,其中DFTotal所在向量的方向正好也指向叶位升高的方向,这也与图1(c)中的结果一致。DFTotal是电子能传递到电子链末端的推动力,通过计算公式(30)可以看出该参数由PIABS、δRo两个参数计算所得,这同时也解释了PCA结果中这3个参数之间的夹角较小以及均与叶片生化参数有较高的相关性的原因。进一步推测利用DFTotal这个综合性能参数,可以有效地用于油菜冠层生化参数垂直异质性的表征。
4 結 论
本研究主要利用快速叶绿素荧光技术实现了对油菜冠层生化参数垂直异质性的检测与评估,得到以下研究结果。
(1)苗期中期油菜冠层的叶绿素含量、类胡萝卜素含量、干物质和水分含量均呈抛物线型的垂直分布,而叶绿素/类胡萝卜素具有与其他生化参数不同的垂直分布模式,其随着叶位升高和施氮量的增加逐渐下降,且与荧光参数DFTotal、φRo和RE0 /RC的垂直分布模式相同。
(2)荧光参数对油菜叶片生化参数中的叶绿素/类胡萝卜、叶绿素和干物质含量具有相对较强的评估能力。其中,电子能传递到电子链末端的推动力性能参数DFTotal与叶绿素与类胡萝卜素的比值、叶绿素含量均具有较高的正相关性(r > 0.5,P < 0.01),与干物质含量则呈显著的负相关(r < -0.5,P < 0.01)。
(3)缺氮一定程度上会降低苗期油菜叶片的PSII和PSI性能,通过φPo和RE0 /RC等荧光参数可以有效评估氮素胁迫。而不同叶位则在PSI性能即电子末端传递效率上具有显著的差异,荧光参数DFTotal可以有效表征冠层生化参数的垂直异质性。
上述结果表明,叶绿素荧光技术可作为一种评估作物生化参数垂直异质性有效的替代方法,为实现基于高通量表型技术的作物生长信息监测提供了思路和技术支撑。拟进一步对不同生长期的油菜冠层内生化参数进行表征,实现油菜全生育期的生化参数垂直分布监测。
参考文献:
[1] ABDALLAH M, DUBOUSSET L, MEURIOT F, et al. Effect of mineral sulphur availability on nitrogen and sulphur uptake and remobilization during the vegetative growth of Brassica napus L[J]. Journal of Experimental Botany, 2010, 61(10): 2635-2646.
[2] PAO Y, CHEN T, MOUALEU-NGANGUE D, et al. Environmental triggers for photosynthetic protein turnover determine the optimal nitrogen distribution and partitioning in the canopy[J]. Journal of Experimental Botany, 2019, 70(9): 2419-2434.
[3] HIKOSAKA K. Optimality of nitrogen distribution among leaves in plant canopies[J]. Journal of Plant Research, 2016, 129(3): 299-311.
[4] ADACHI S, YOSHIKAWA K, YAMANOUCHI U, et al. Fine mapping of carbon assimilation rate 8, a quantitative trait locus for flag leaf nitrogen content, stomatal conductance and photosynthesis in rice[J]. Frontiers in Plant Science, 2017, 8: ID 60.
[5] 王纪华, 王之杰, 黄文江, 等. 冬小麦冠层氮素的垂直分布及光谱响应[J]. 遥感学报, 2004, 8(4): 309-316.WANG J, WANG Z, HUANG W, et al. The vertical distribution characteristic and spectral response of canopy nitrogen in different layer of winter wheat[J]. Journal of Remote Sensing, 2004, 8(4): 309-316.
[6] 叶晓青, 邹勇, 余志虹, 等. 烤烟冠层光谱参数与氮素垂直分布相关性研究[J]. 农业机械学报, 2013, 44(5): 219-225.YE X, ZOU Y, YU Z, et al. Correlation between nitrogen vertical distribution and spectral characteristics of flue-cured tobacco[J]. Transactions of the CSAM, 2013, 44(5): 219-225.
[7] FENG W, GUO B, WANG Z, et al. Measuring leaf nitrogen concentration in winter wheat using double-peak spectral reflection remote sensing data[J]. Field Crops Research, 2014, 159: 43-52.
[8] LI F, MISTELE B, HU Y, et al. Remotely estimating aerial N status of phenologically differing winter wheat cultivars grown in contrasting climatic and geographic zones in China and Germany[J]. Field Crops Research, 2012, 138: 21-32.
[9] STAGAKIS S, MARKOS N, SYKIOTI O, et al. Tracking seasonal changes of leaf and canopy light use efficiency in a Phlomis fruticosa Mediterranean ecosystem using field measurements and multi-angular satellite hyperspectral imagery[J]. ISPRS Journal of Photogrammetry and Remote Sensing, 2014, 97: 138-151.
[10] ZHANG Q, CHEN J M, JU W, et al. Improving the ability of the photochemical reflectance index to track canopy light use efficiency through differentiating sunlit and shaded leaves[J]. Remote Sensing of Environment, 2017, 194:1-15.
[11] STIRBET A, LAZ?R D, GUO Y, et al. Photosynthesis: Basics, history and modelling[J]. Annals of Botany, 2020, 126(4): 511-537.
[12] GUO Y, TAN J. Recent advances in the application of chlorophyll a fluorescence from photosystem II[J]. Photochemistry and Photobiology, 2015, 91(1): 1-14.
[13] GUANTER L, ZHANG Y, JUNG M, et al. Global and time-resolved monitoring of crop photosynthesis with chlorophyll fluorescence[J]. Proceedings of the National Academy of Sciences, 2014, 111(14): 1327-1333.
[14] PAPAGEORGIOU G. Chlorophyll a fluorescence: A signature of photosynthesis[M]. Dordrecht: Springer, 2004.
[15] MAGYAR M, SIPKA G, KOV?CS L, et al. Rate-limiting steps in the dark-to-light transition of Photosystem II-revealed by chlorophyll-a fluorescence induction[J]. Scientific Reports, 2018, 8(1): 1-9.
[16] SHRESTHA S, BRUECK H and ASCH F. Chlorophyll index, photochemical reflectance index and chlorophyll fluorescence measurements of rice leaves supplied with different N levels[J]. Journal of Photochemistry and Photobiology B: Biology, 2012, 113: 7-13.
[17] LIU R, WANG Y, CHEN B, et al. Effects of nitrogen levels on photosynthesis and chlorophyll fluorescence characteristics under drought stress in cotton flowering and boll-forming stage[J]. Acta Agronomica Sinica, 2008, 34(4): 675-683.
[18] FENG W, HE L, ZHANG H-Y, et al. Assessment of plant nitrogen status using chlorophyll fluorescence parameters of the upper leaves in winter wheat[J]. European Journal of Agronomy, 2015, 64: 78-87.
[19] LARBI A, V?ZQUEZ S, EL-JENDOUBI H, et al. Canopy light heterogeneity drives leaf anatomical, eco-physiological, and photosynthetic changes in olive trees grown in a high-density plantation[J]. Photosynthesis Research, 2015, 123(2): 141-155.
[20] KAUTSKY H, HIRSCH A. Neue versuche zur kohlens?ureassimilation[J]. Naturwissenschaften, 1931, 19(48): 964-964.
[21] STRASSER R J, TSIMILLI-MICHAEL M, SRIVASTAVA A. Analysis of the chlorophyll a fluorescence transient[M]. Dordrecht: Springer, 2004.
[22] STIRBET A. On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and photosystem II: Basics and applications of the OJIP fluorescence transient[J]. Journal of Photochemistry and Photobiology B: Biology, 2011, 104(1-2): 236-257.
[23] TSIMILLI-MICHAEL M, EGGENBERG P, BIRO B, et al. Synergistic and antagonistic effects of arbuscular mycorrhizal fungi and Azospirillum and Rhizobium nitrogen-fixers on the photosynthetic activity of alfalfa, probed by the polyphasic chlorophyll a fluorescence transient OJIP[J]. Applied Soil Ecology, 2000, 15(2): 169-182.
[24] ABDI H, WILLIAMS L J. Principal component analysis[J]. Wiley Interdisciplinary Reviews: Computational Statistics, 2010, 2(4): 433-459.
[25] HUANG W, YANG Q, PU R, et al. Estimation of nitrogen vertical distribution by bi-directional canopy reflectance in winter wheat[J]. Sensors, 2014, 14(11): 20347-20359.
[26] MERZLYAK M N, GITELSON A A, CHIVKUNOVA O B, et al. Non-destructive optical detection of pigment changes during leaf senescence and fruit ripening[J]. Physiologia Plantarum, 1999, 106(1): 135-141.
[27] ZHOU X, HUANG W, ZHANG J, et al. A novel combined spectral index for estimating the ratio of carotenoid to chlorophyll content to monitor crop physiological and phenological status[J]. International Journal of Applied Earth Observation and Geoinformation, 2019, 76: 128-142.
[28] DIN? E, CEPPI M G, T?TH S Z, et al. The chl a fluorescence intensity is remarkably insensitive to changes in the chlorophyll content of the leaf as long as the chl a/b ratio remains unaffected[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2012, 1817(5): 770-779.
Vertical Heterogeneity Analysis of Biochemical Parameters in Oilseed Rape Canopy Based on Fast Chlorophyll Fluorescence Technology
ZHANG Jiafei1,2, WAN Liang1,2, HE Yong1,2,3, CEN Haiyan1,2,3*
(1.College of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China;
2.Key Laboratory of Spectroscopy Sensing, Ministry of Agriculture and Rural Affairs, Hangzhou 310058, China;
3.State Key Laboratory of Modern Spectroscopic Instruments, Zhejiang University, Hangzhou 310027, China)
Abstract: Accurate acquisition of crop canopy biochemical information is of great significance for monitoring crop growth and guiding precise fertilization. Previous vertical distribution researches of crop biochemical information were mainly based on hyperspectral inversion, which was lack of the association of plant photosynthesis physiology. This study mainly investigated the vertical distribution characteristics of biochemical parameters such as chlorophyll, carotenoid, dry matter, and water content in the oilseed rape canopy under different nitrogen treatments at the mid-seedling stage. The photosynthetic performance of leaves was measured by using fast chlorophyll fluorescence technology, and linear regression and principal component analysis were further implemented to explore the internal relationship between fluorescence response and biochemical parameters. The results showed that: (1) The chlorophyll content, carotenoid content, dry matter and water content of the rape canopy at the mid-seedling stage all showed a parabolic vertical distribution, while the ratio of chlorophyll to carotenoids content gradually decreases with the leaf position and nitrogen treatments, which was the same as the vertical distribution pattern of fluorescence parameters such as driving force comprehensive performance (DFTotal) and end electron chain quantum yield (φRo) and other fluorescence parameters could be used to diagnose nitrogen stress; (2) JIP-test parameters, especially DFTotal, had a good performance to evaluate the chlorophyll/carotenoids, chlorophyll and dry matter content of oilseed rape leaves; (3) Nitrogen deficiency would weaken the PSII and PSI performance of oilseed rape leaves at the mid-seedling stage, and the maximum photochemical efficiency (φPo) could be used to diagnose nitrogen stress. There was a significant difference in the PSI performance, namely electron transfer efficiency at the end acceptors of leaves in the different leaf position, hence the comprehensive performance parameter DFTotal could be an effective characterization of the vertical heterogeneity of canopy biochemical parameters. These findings indicated the feasibility of applying the rapid chlorophyll fluorescence technology to crop biochemical information heterogeneity monitoring and provided new ideas and technical support for guiding precise fertilization and achieving high-quality and high-yield.
Key words: fast chlorophyll fluorescence transient; JIP-test; vertical heterogeneity; chlorophyll; carotenoid; nitrogen

