母乳低聚糖的研究进展
杨宝雨,赵军英,乔为仓,张明辉,刘彦品,侯俊财,陈历俊*
(1 东北农业大学食品学院 乳品科学教育部重点实验室 哈尔滨 150030 2 北京三元食品股份有限公司 国家母婴乳品健康工程技术中心 北京 100163)
母乳是新生儿生命第1 阶段的唯一营养源,被视为婴幼儿营养 “金标准”。其中母乳低聚糖(Human milk oligosaccharide,HMOs)是母乳的主要成分,因不易被人体胃、肠道消化,而在营养方面被忽视多年。然而,有研究表明,其复杂的结构,使HMOs 具有重要的生理功能[1-3]。它可以通过补充益生元,黏附[4]、模拟肠道上皮细胞结合配体[5-6],调节免疫应答等多种形式干扰有害物质与宿主的相互作用,从而影响新生儿健康状况[7]。
由于HMOs 无法大规模模拟,因此在婴幼儿配方奶粉中添加的低聚糖主要是低聚半乳糖(Galactooligosacchari-des,GOS)和低聚果糖(Fructooligosaccharide,FOS)。Tungland 等[8]对GOS进行了全面的综述,β-半乳糖苷酶产生的GOS仅由半乳糖和葡萄糖单元构成,不含HMOs 和牛乳低聚糖(Bovine milk oligosaccharide,BMOs)中典型的岩藻糖和唾液酸结构。2016年后,部分高纯单体HMOs 分子,如2'-岩藻糖基乳糖(2'-Fucosyllactose,2'-FL)和乳糖-N-新四糖(LNnT)已实现商业化模拟。虽然人体初步试验证明,2'-FL与婴儿配方奶粉中的其它低聚糖结合食用具有安全性和潜在的健康益处[9-11],但仅模拟了HMOs 中一种或几种分子结构。迄今为止,还未从任何动物乳汁中提取复合低聚糖作为商业来源。Tao 等[12]发现BMOs 在结构上与HMOs 相似,可作为一种与HMOs 生物学功能相近的代替营养源。通过膜分离技术分离富集BMOs,不仅能保持它的天然结构,而且具有易操作、无相变和节能等优点。在工业生产上使用膜分离技术提取BMOs 是可行的[13]。
本文从HMOs 的含量、分型、结构特征、检测方法、生理功能、消化吸收、模拟以及潜在代替品8 个方面综述研究进展,旨在为HMOs 的研究、模拟、替代和商业化应用提供理论参考。
1 母乳低聚糖的含量及分型
HMOs 数量和组成在不同个体和哺乳期之间各不相同[14]。初乳一般是分娩后3~7 d 内乳腺分泌的黏稠状淡黄色液体,HMOs 质量浓度高达20~25 g/L[15]。15 d 后过渡为成熟乳,此时HMOs 质量浓度下降至5~20 g/L[16],但仍比BMOs 高100~1 000倍。在牛乳基或羊乳基婴幼儿配方奶粉中BMOs和羊乳低聚糖(Caprine milk oligosaccharide,CMOs)均小于1 g/L[17]。由表1可知,母乳中岩藻糖基化HMOs 较高,其它哺乳动物则相反。CMOs含量虽然高于BMOs,但奶山羊泌乳量较低。此外,HMOs 质量浓度的巨大波动还反映了不同母亲之间以及不同实验室使用的非标准分析方法的差异。
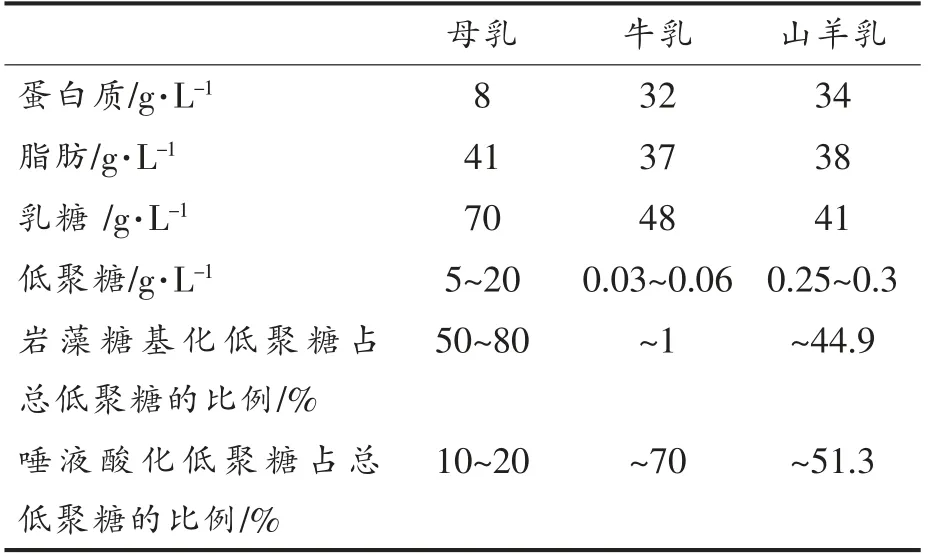
表1 成熟母乳、牛乳和山羊乳中的宏量元素和低聚糖比较[12,15,18-22]Table 1 Macronutrients and oligosaccharides in mature human,bovine and caprine milk[12,15,18-22]
HMOs 的组成还反映Lewis 表型和ABH 分泌状态。这主要取决于Se 基因编码的α-1-2-岩藻糖基转移酶(Fucosyltransferase 2,FUT 2)和Le基因编码的α-1,3/4-岩藻糖基转移酶(Fucosyltransferase 3,FUT3)[23]。具有活性Se 位点的个体被归类为分泌型,其母乳中含有丰富的2′-FL、乳酰-N-岩藻五糖I(Lacto-N-fucopentaose I,LNFP I)和其它α-1-2-岩藻糖基HMOs。与之相比,非分泌型则缺乏FUT 2,即不含α-1-2-岩藻糖基HMOs。具有活性Le 位点的个体被归为Le 阳性。其表达FUT 3,即α-1-4-岩藻糖基HMOs 转移至N-乙酰葡糖胺(N-acetylglucosamine,GlcNAc)的亚末端[24-25](图1)。相反,Le 阴性母亲的母乳缺乏这些特异性α-1-4-岩藻糖基化HMOs,如乳糖-N-岩藻五糖II (Lacto-N-fucopentaose II,LNFP II)。根据表型和分泌状态,母乳可分为4 种类型:Lewis 阳性分泌型(Se+Le+)、Lewis 阳性非分泌型(Se-Le+)、Lewis 阴性分泌型(Se+Le-)和Lewis 阴性非分泌型(Se-Le-)。这4 组的母乳个体样品分类只不过是HMO 复杂性的过度简化,其它与Se和Le 无关的FUTs(FUT4、5、6、7 或9)也可能参与其中[4]。除了这些基因变异,其它因素也可能影响HMOs 的数量和组成,如营养和环境等方面。

图1 Se、Le 基因与HMOs 类型[25]Fig.1 Se,Le genes and HMOs types[25]
2 HMOs 结构及组成
2.1 HMOs 单体、核心系列和糖苷键
HMOs 结构具有多样性。在个体和哺乳期间,浓度和成分具有很大差异[26]。它们以游离、糖蛋白或糖脂等形式出现[27]。如表2所示,HMOs 结构主要由5 中单体组成,而BMOs 多了一个N-羟乙酰神经氨酸(N-Hydroxyacetylneuraminic acid,NeuGc)单体,其中5%的酸性低聚糖含有NeuGc[28]。HMOs 中NeuGc 的缺乏,可能是由于300 万年前,原始人的CMP-N-乙酰神经氨酸羟化酶的突变造成的[29]。每个HMOs 均以乳糖残基为核心,通过β-1,3 糖苷键或β-1,6 糖苷键连接乳糖-N-二糖或N-乙酰乳糖胺单元延伸成直链(类型Ⅰ)或支链结构(类型Ⅱ)。乳糖、短链线性或支链结构,在岩藻糖基转移酶和唾液酸转移酶的作用下,通过α-1,2,α-1,3 或α-1,4 糖苷键延伸成岩藻糖基化寡糖或α-2,3,α-2,6 糖苷键延伸成唾液酸化寡糖[30](图2)。而BMOs 主要以乳糖、乳糖胺为核心。目前,只有7 个含有乳糖胺核心的BMOs 被报道[31]。同时,BMOs 还存在一个半乳糖与乳糖以β-1,3 或β-1,6 糖苷键相连的三糖核心,但丰度较低(图2)[32-33]。此外,植物源中的组成单体种类较多(表2),分别由一系列半乳糖和果糖单体聚合成线性结构(图3)[28]。除葡萄糖和半乳糖单体之外,不存在与乳源低聚糖相同的组成单体。因此,植物源低聚糖可能只具备复杂HMOs 和BMOs 的部分功能。
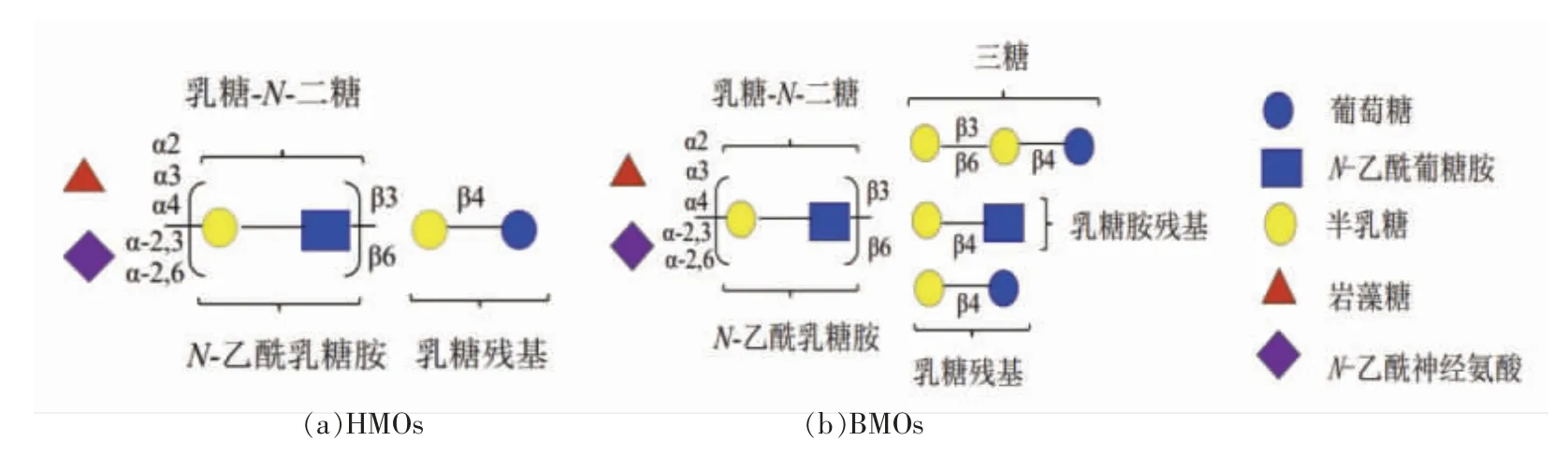
图2 低聚糖延长方式Fig.2 Oligosaccharide elongation mode

表2 母乳低聚糖、牛乳低聚糖及植物源低聚糖组成单体比较Table 2 The composition monomer of HMOs,BMOs and plant-derived oligosaccharides
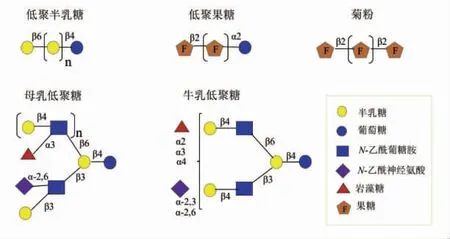
图3 母乳低聚糖、牛乳低聚糖、低聚半乳糖、低聚果糖和菊粉的结构比较[28]Fig.3 Structure comparison of HMOs,BMOs,GOS,FOS and inulin[28]
除乳糖外,母乳中还存在大约1 000 种HMOs分子[34],大多数以少量出现。根据HMOs 的结构特性,将其大约分为17 种中性低聚糖核心结构[35-38](表3)。此外,如表4所示,12 种糖苷键也丰富了HMOs 的结构。主要包括3 种半乳糖苷键、2 种N-乙酰氨基葡萄糖苷键、4 种岩藻糖苷键和3 种唾液酸糖苷键。总之,HMOs 的多样性受不同糖单元(表2)、聚糖长度、大小、核心序列(表3)和12 种糖苷键的影响(表4)[4]。

表3 乳糖和可作为其它HMOs 核心结构的中性非岩藻糖基HMOsTable 3 Lactose and neutral non-fucosyl HMOs that can serve as the core structure of other HMOs
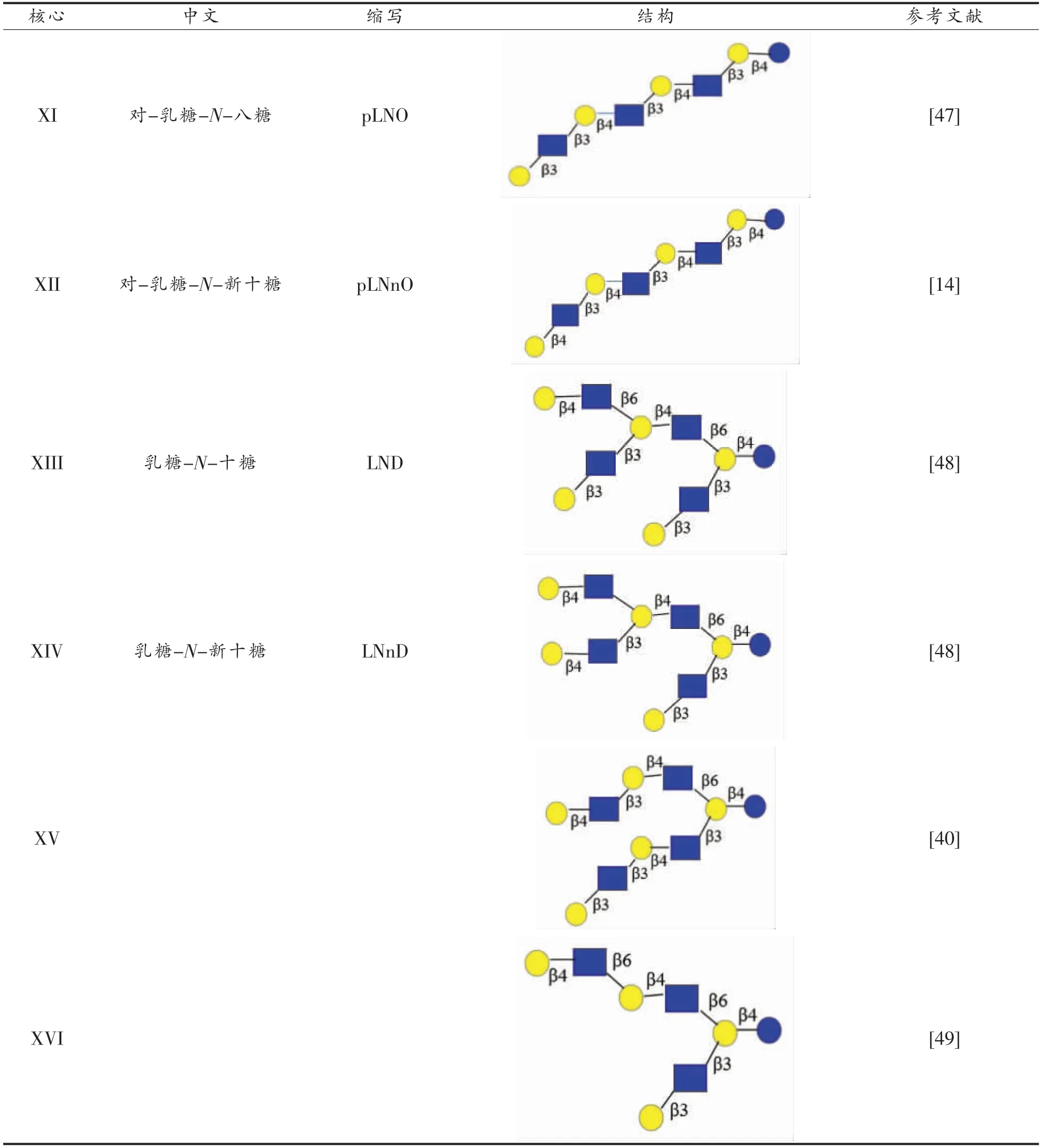
(续表3)

表4 构成不同HMOs 的12 个糖苷键[23,40]Table 4 Twelve glycosidic linkages that constitute diverse HMOs[23,40]

(续表4)
2.2 HMOs 的结构表征
HMOs 组分极其复杂,迄今为止,已发现200种HMOs[32,50],已经分离和鉴定了至少157 种不同的HMOs 结构[23,42]。而BMOs 和CMOs 仅鉴定出50种[51]。成分识别和结构鉴定需通过一种或多种组合技术实现,主要包括氚标记、荧光衍生化、甲基化、糖苷酶消化、1H 和13C 核磁共振波谱表征(Nuclear magnetic resonance spectroscopy,NMR)、高效液相色谱(High-performance liquid chromatography,HPLC)、高效阴离子交换色谱-脉冲安培检测(High-pH anion-exchange chromatography with pulsed amperometric detection,HPAEC-PAD),毛细管电泳(Capillary electrophoresis,CE)和质谱(Mass spectrometric,MS)技术等[52]。如表5所示,母乳中岩藻糖基化低聚糖含量占比较高,约占母乳中总低聚糖的70%,其中2′-FL 高达4.65 g/L[10]。与HMOs 相比,BMOs 中唾液酸化低聚糖含量较高。至少存在15 种BMOs 和CMOs 与HMOs 具有相同的结构(表5),即具有相同的功能[53]。因此,从其它哺乳动物乳汁中提取低聚糖,将其作为活性物质添加到婴幼儿配方奶粉中具有重要价值。此外,BMOs 的聚合度通常比HMOs 小,主要由三糖和四糖组成,最高为7 聚体,而HMOs 中最高可达15 聚体。
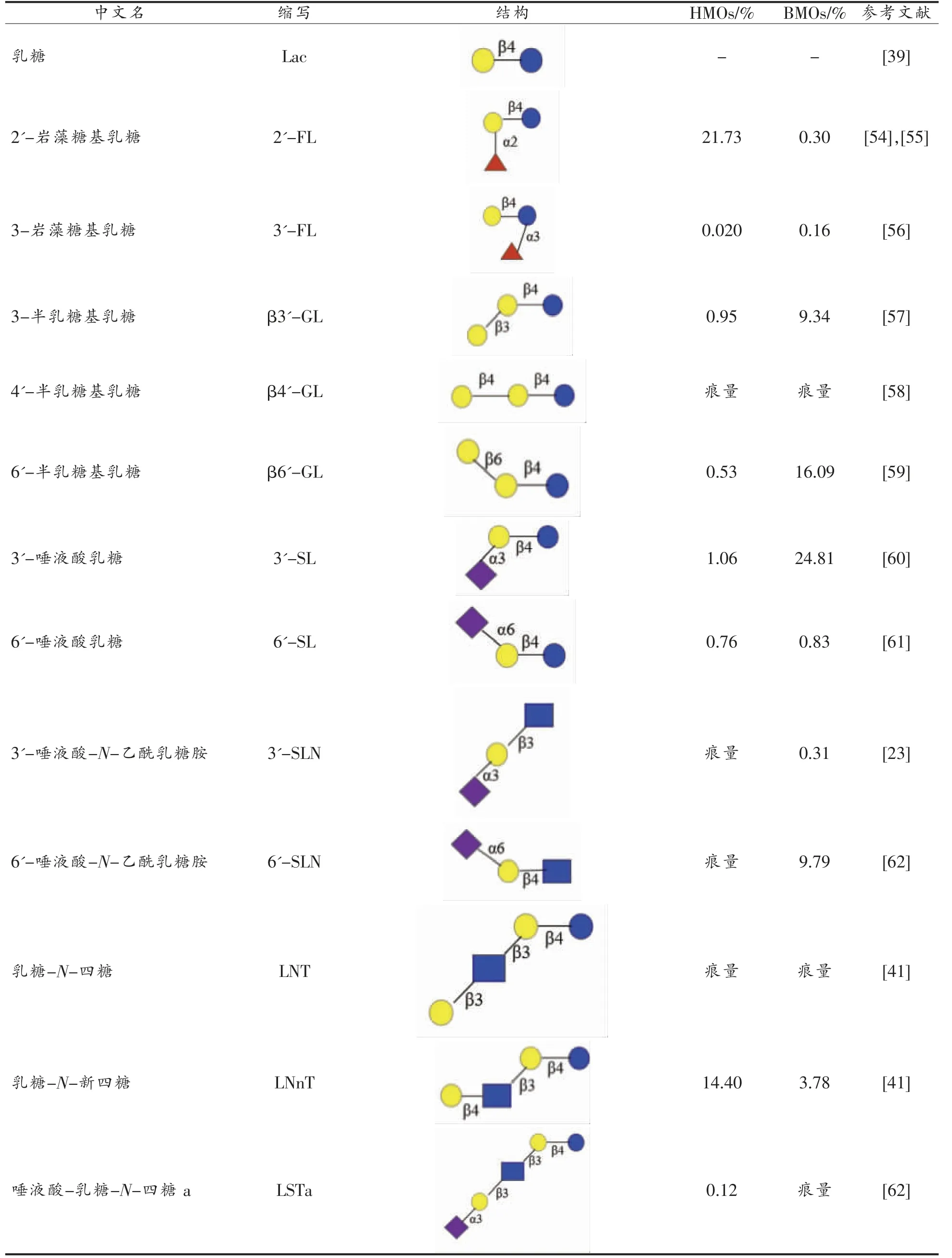
表5 HMOs 和BMOs 共有的结构Table 5 Common structure between BMOs and HMOs
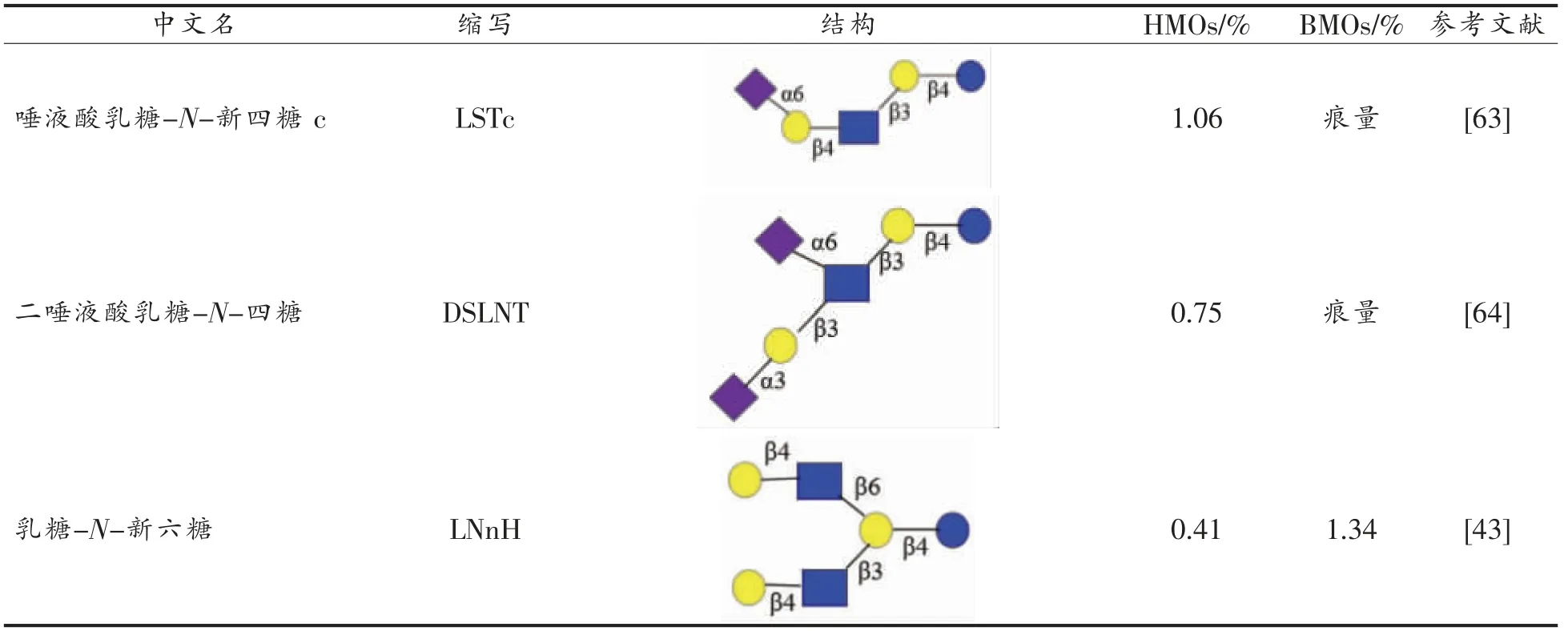
(续表5)
3 母乳低聚糖的检测方法
HMOs 具有重要的生物学功能,由于它的复杂性,其表征技术远远落后于核酸和蛋白质技术。即使了解了HMOs 的序列,仍不能对其进行完整的表征。例如:连接2 个环己糖的糖苷键,可以通过5 种羟基中的任一种实现(图4)[65]。此外,还存在糖基化现象。因此还必须确定链的长度、立体化学结构和分支度。分支易发生在低聚糖中,很少在多肽或蛋白质中出现。例如:氨基酸在蛋白质的主链中只有一种连接方式(酰胺键)。传统上主要是通过甲基化、特异性内切糖苷酶、外切糖苷酶、凝胶过滤、纸层析、薄层层析、CE、HPLC、HPAECPAD、NMR 等多种技术相结合的方式对乳低聚糖的结构进行表征。然而,这些方法通常需要超过1 mg 的低聚糖样品[66],对低浓度HMOs 和BMOs 研究是一个限制。近年来,基质辅助激光解吸(Matrix-assisted laser desorption/ionization,MALDI)、电喷雾(Electrospray ionization,ESI)解吸离子化以及碰撞诱导离子化(Collision induced dissociation,CID)等电离技术使高分辨率质谱(飞行时间质谱、四极杆-飞行时间质谱等)在低聚糖研究方面取得了重大突破。此外,Wu 等[20]还引入纳升液相色谱-芯片-飞行时间质谱来分析HMOs,结果表明其对异构体具有良好的分离效果。目前,主要的检测方法,如表6所示。

图4 环己糖结构Fig.4 Structure of hexos

献文考参[67][68][23][69][20],[36],[50][32],,[70][48][71],[72][7][73][74],[76][75],[77][16],[80][78]法方测检糖聚低乳母用常6表Methods of detection of human milk oligosaccharides Table 6 价评法方剂试生衍备设测检的化基糖藻岩或化酸液唾被15 个定测时同可项一了立建胺酰甲苯基2-氨谱色相液率辨分0.999于高数系关,相性线的好良和度敏灵高有HMOs,具哺了察,观异差量含的HMOs种12中品样乳母同不定测过通-谱质联串相化变的HMOs期乳化变的天90第到天3第后产从在HMOs种20和糖乳了定测-培安冲脉-谱色换交子离阴效在儿生新和量总糖聚低乳母了析,分糖聚低要主种18了量定-培安冲脉-谱色换交子离阴效系联的间之成组群物生微便粪的内月个1第后生出型泌分和型Lewis 血括包,还库据HMOs 数性中45 个了立建-子离雾喷-电谱色相液效高升HMOs 别识速快于用,可息信等谱质间时行-飞图谱质的品样乳母同不位5对,并构结HMOs种余200了现发-谱质-片芯-谱色相异差在存分成HMOs间之体个同不现,发较比了行进构结HMOs的基糖藻岩同不个74了析解下式模子离负-时行飞-离电吸解光激助辅质谱质上床临在2'-FL的中HMOs明表,并HMOs的要主种8了测检化酰甲苯谱色相液效高相关有泻腹儿婴防预与2'-FL、LDFT 和出,得化变量HMOs 含10 种的中乳初了定测-5-基-3-甲基1-苯谱色相液效高相感抗和元生益对期早乳哺在儿婴了映反能可化变的度LNT 浓吡基、2-氨酮啉唑吡求需的物药染啶性中要主种9的中乳母100 d和,30 d,10 4后产了定测啶吡基氨2-谱色相液效高相的HMOs性中总占糖聚低些,这中乳熟成和乳初,在HMOs 73%HMOs性中种11了定,测法方生衍的酸甲苯基氨邻进改过通酸甲苯基氨2-谱色相液效高相,发异差糖聚低乳母的区地个2了较比。并HMOs性酸种6和遗是能可测,推异差著显现出HMOs性,中似相HMOs性酸现因原的传唾察观于用,适HMOs酸液唾要主种12了量定时同内35 min法谱色管细毛动电束系关的险风病疾定特儿婴低降对化变达表HMOs 的酸液的中胃肠在HMOs测,监HMOs种10的内月个6后产了定测,6-,3-1基芘基氨8-泳电管细化变酸磺三高液高高纳阱液基间反反反反胶毛柱谱色ACQUITY UPLC BEH Amide Amino Column CarboPac PA-100 CarboPac PA-1 Porous Graphitic Carbon-Chip Hypercarb Porous Graphitized Carbon column Hypercarb Porous Graphitized Carbon Column Rainin C-8 Inertsil ODS-3V and ODS-100Z Inertsil ODS-3V TSKgeODS-100Z--
4 HMOs 的功能
从母乳中提取的HMOs 混合物常用来进行功能研究,然而没有足够数量的纯HMOs,因此单个HMOs 的功能作用尚不清楚。母乳喂养的益处早在19世纪末就已被观察到[25],最初HMOs 被认为具有“双歧因子”作用。但自20世纪90年代初以来,越来越多的证据表明,HMOs 不仅仅是促进婴儿肠道内微生物菌群生长的基质,还具有以下功能:
4.1 益生元
HMOs 不易被上消化道消化吸收,能完整到达结肠,可为结肠细胞提供营养和能量。在厌氧条件下,选择性的被双歧杆菌和拟杆菌等益生菌利用(图5),产生后生元和短链脂肪酸(Short-chain fatty acids,SCFAs),如乙酸、丙酸和丁酸等物质。此外,较低pH 值的肠道微环境也不利于有害菌群的生长(梭状芽胞杆菌、肠球菌、真细菌和肠杆菌等),从而发挥益生元作用[81-83]。
当在无菌小鼠体内接种泰奥他米克龙类杆菌(Bacteroides thetaiotaomicron)后,LNnT 与饮用水一起灌胃,婴儿双歧杆菌相对丰度增加到40%以上[84],而泰奥他米克龙类杆菌无显著变化;然而当LNnT 不在饮食中时,婴儿双歧杆菌的相对丰度仅为2%左右,说明LNnT 为婴儿双歧杆菌生长提供了优势。
BMOs 作为益生元的研究较少,Jakobsen等[85]比较了BMOs 和GOS 对8 种主要婴儿肠道细菌的单一和共培养的影响,结果显示BMOs 具有促进长双歧杆菌长亚种(B.longum ssp.longum)和吉氏副拟杆菌(Parabacteroides distasonis)生长,抑制产气荚膜杆菌(Clostridium perfringen)和大肠杆菌(Escherichia coli.)的作用。Ward 等[86]将BMOs 和HMOs 分别作为婴儿长双歧杆菌发酵底物,结果发现添加BMOs 的婴儿双歧杆菌生长状况优于HMOs 的效果,可能是婴儿双歧杆菌易消耗聚合度小于7 的化合物,而BMOs 聚合度小于HMOs。因此,BMOs 也是婴儿双歧杆菌的良好食物来源[87]。
4.2 抗细菌、病毒和寄生虫作用
肠黏膜具有较大的表面积,也是糖基化程度最高的组织之一[88]。覆盖着复杂的聚糖,包括低聚糖、糖蛋白、糖脂和黏蛋白等[89]。其中HMOs 的主要功能被认为是调节细胞外环境,包括细胞间通讯、分子识别和屏障功能等。细菌和病毒感染的第1 步是识别和结合肠黏膜上特定细胞的表面聚糖[90]。唾液酸化和岩藻糖基化低聚糖含有与这些聚糖类似的结构单元。因此HMOs 可以作为受体类似物,抑制病原体的黏附,从而防止感染(图5)[91]。诺如病毒或轮状病毒是婴幼儿严重腹泻的最常见原因之一[92],每年造成近50 万人死亡[93]。研究发现,α-1,2-岩藻糖基化HMOs 对减少空肠弯曲菌相关性腹泻起有益作用,已在墨西哥市100 对母婴的前瞻性研究中得到证实[7]。Morrow 等[7]在93对母婴研究中,收集了2年内婴儿喂养和腹泻数据,发现母乳中的2′-FL 和乳糖-N-二岩藻糖与婴儿弯曲杆菌和杯状病毒腹泻的发生率呈负相关。因此,HMOs 分子可以与病毒结合并降低感染风险[94]。
此外,抗黏附、抗菌作用不仅适用于细菌和病毒,也可能适用于原生动物寄生虫,如溶组织内阿米巴。全世界大约5 000 万人感染了溶组织内阿米巴,导致阿米巴痢疾或阿米巴肝脓肿,每年造成近10 万人死亡,成为寄生虫病第三大死因,仅次于疟疾和血吸虫病[95]。Jantscher-krenn 等[96]表明溶组织内阿米巴的主要毒力因子之一是HMOs 中的半乳糖和N-乙酰半乳糖胺特异性凝集素,有助于肠上皮细胞的杀伤和吞噬作用。Urakami 等[97]以HMOs 为阳性对照,比较了BMOs 和CMOs 对肠道沙门菌ⅡD604(S.enterica IID604)与Coao-2 细胞的黏附抑制作用。Maldonado-Gomez 等[98]在体外试验中,证明了BMOs 可以阻止致病性大肠杆菌、阪崎肠杆菌(Cronobacter sakazakii)和鼠伤寒沙门氏菌(Salmonella typhymurium)与Hep-2 细胞的黏附作用。Leong 等[99]发现CMOs 能够阻止大肠杆菌NCTC10418 和鼠伤寒沙门氏菌与Caco-2 细胞的黏附,为HMOs、BMOs 和CMOs 作为潜在抗感染剂提供了有力的证据。
4.3 肠上皮细胞应答调节因子
HMOs 中的唾液酸可以附着在肠上皮细胞上,直接影响诱导差异基因表达和调节细胞反应(图5)。因此,当HMOs 存在时,肠致病性大肠杆菌与肠上皮细胞的结合明显减少[100]。Kuntz 等[101]通过改变与生长相关的细胞周期基因,证实了HMOs 可以抑制肠上皮细胞生长并诱导其分化和凋亡。仍需进一步研究以确定HMOs 用来触发差异基因表达的受体和信号通路途径。Kuntz 等[102]研究发现表皮生长因子受体(Epidermal growth factor receptor,EGFR)和Ras / Raf / ERK 信号通路可能参与其中,但HMOs 是直接与EGFR 相互作用,还是间接调节EGFR 的信号仍尚待确定。3′SL 是BMOs 的主要成分,现有证据表明它可以调节肠上皮细胞表面的多糖,从而减少或增加细菌的附着位点[100]。Alicia 等[103]通过CMOs 与Caco-2/HT29-MTX 肠上皮细胞共培养,发现其增加了肠上皮细胞的跨上皮电阻、黏蛋白基因表达和黏蛋白蛋白丰度。总之,HMOs、BMOs 和CMOs 成分均可以直接调节肠上皮细胞。
4.4 免疫调节剂
根据观察到的血液、尿和粪便情况,发现少量的HMOs 可能从胃肠道吸收并进入全身循环[104]。当脐血T 细胞与唾液酸化HMOs 接触时,会增加产生干扰素-γ 的CD3+、CD4+和CD3+、CD8+淋巴细胞以及产生白细胞介素-13 (Interleukin-13,IL-13)的CD3+、CD8+淋巴细胞[105]。这项研究推测,唾液酸化的HMOs 影响淋巴细胞成熟,促进T 细胞向更平衡的Th1/Th2 细胞因子生产转变。Velupillai 等[106]在小鼠感染模型中发现,富含HMOs 的乳糖-新四糖结构能诱导产生白细胞介素10(Interleukin 10,IL 10),Tao 等[12]在成熟牛乳中也检测到相同的结构。BMOs 在免疫调节方面的研究较少,Martín 等[107]以7 种产肠毒素大肠杆菌菌株为研究对象,研究了BMOs 对血液毒性的抑制作用,发现BMOs 可以作为抗感染剂用于人类和奶牛。此外,HMOs 的组成在个体之间不同,意味着不同母亲的母乳对婴儿免疫系统的影响不同,从而导致婴儿患过敏、哮喘或其它与免疫系统有关疾病的风险不同。此外,Eiwegger 等[108]研究发现唾液酸化的HMOs 会减少花生过敏患者淋巴细胞亚群中IL-4 的产生,有助于预防过敏。以上研究表明,HMOs 和BMOs 均可以通过调节免疫反应保护新生儿。
4.5 神经发育
含有NeuAc 结构的低聚糖可以促进婴幼儿大脑发育[109]。人体虽然可以从肝脏中合成NeuAc,但婴幼儿时期,尿苷二磷酸-N-乙酰葡糖胺-2-表异位酶的活性较低,可能存在发育能力超过合成能力的现象。出生前几个月到出生后几年之间,大脑中的唾液酸浓度增加了一倍以上。大脑的发育和认知在一定程度上依赖含有神经节苷脂的唾液酸和含有糖蛋白的多聚唾液酸[110](图5)。Wang等[111]通过动物实验研究发现,当饲料中添加唾液酸化的酪蛋白糖巨肽时,仔猪的学习和记忆能力增强。Sakai 等[112]通过给成年大鼠饲喂唾液酸乳糖后,发现脑神经节苷脂和游泳能力的都得到了提高。此外,Vázquez 等[113]通过研究表明,啮齿动物摄入2'-FL 可改善学习和记忆能力。Wang 等[114]通过对新生儿的尸检分析表明,母乳喂养的婴儿大脑中神经节苷脂唾液酸和含有糖蛋白的多聚唾液酸浓度明显高于配方奶粉喂养的婴儿。因此,唾液酸低聚糖添加到婴幼儿配方或其它功能性食品中,可以作为大脑激活因子。
4.6 对乳母的保护作用
母乳并非无菌,其含有复杂的菌群,且个体之间差异较大[115]。母乳中的细菌可以接种到婴儿肠道,也可以被视为调节母乳成分的潜在共生菌或导致乳腺炎等疾病的病原体。到目前为止,母乳低聚糖的潜在益处大都与母乳喂养的婴儿有关。然而,母乳低聚糖也可能影响乳母,其潜在机制可能类似(图5),即HMOs 可作为益生元或抗菌剂影响乳腺中的葡萄球菌、链球菌、微球菌、乳酸杆菌和肠球菌等细菌或直接调节乳腺上皮细胞应答和局部免疫反应[25]。葡萄球菌是造成乳腺炎的一个主要原因[116]。Lane 等[117]基于生物传感器的快检方法,发现部分葡萄球菌菌株可以与HMOs 中的2′-FL 结合,然而是否可以降低乳腺炎风险尚不清楚。此外,Hallgren 等[118]采用气相色谱-质谱联用技术在妊娠期孕妇的尿液中检测到了HMOs。因此,HMOs 不仅对婴儿有重要的生理功能,而且对乳母也有潜在的益生元和抗菌作用。
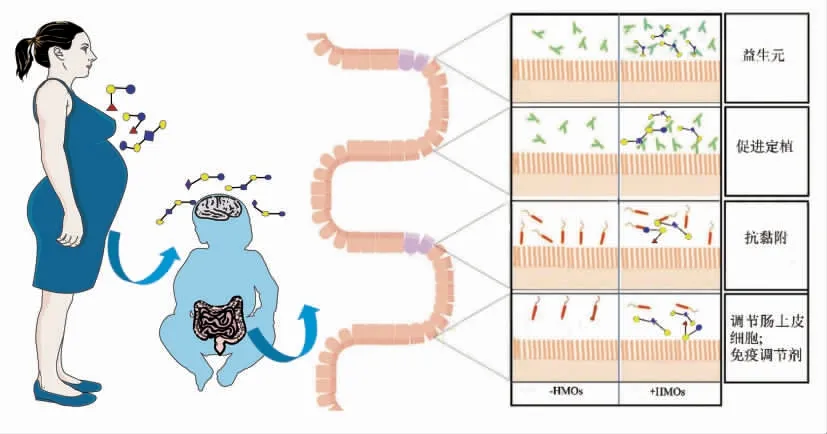
图5 HMOs 的功能[91]Fig.5 Functions of HMOs[91]
5 消化和吸收特性
婴儿缺乏水解或消化HMOs 所必需的酶,使得HMOs 能够抵抗胃酸、胰酶和刷状缘酶的降解,从而进入结肠[119-120]。因此,从严格意义上说,HMOs不是婴幼儿的营养素,而是膳食纤维的一种。大约1%的HMOs 被吸收并在全身循环,它们很可能到达肠道以外的许多器官,包括肝脏和大脑,以及呼吸道和泌尿道,而后随尿液以完整或部分降解的形式排出[121-122]。而大多数的HMOs 被肠道微生物代谢或随粪便排出[78-79]。因此,母乳低聚糖的生物学功能可能不局限于肠道,也可能会在新生儿多个不同水平上影响婴儿。
6 HMOs 的模拟与应用
HMOs 在婴儿身体健康方面发挥着关键作用[123]。受限于原料来源和伦理问题,导致HMOs 大多不存在于婴儿配方奶粉中。此外,牛乳中天然BMOs 含量较低,其开发仍处于初级阶段。因此,通常把GOS 和FOS 添加到婴幼儿配方奶粉中,以期达到与母乳喂养相似的肠道菌群。GOS 是由乳糖经β-半乳糖苷酶催化形成的不同链长非均相混合物,一般由3~8 个半乳糖分子和1 个葡萄糖残基组成,具有类似于HMOs 益生元的功效[124]。FOS是由果糖以β-2,1 或β-2,6 糖苷键连接而成的线性或分支型果糖聚合物,通常在末端连接一个葡萄糖残基,易在菊苣/芋中提取[125]。Knol 等[126]通过临床试验发现,喂食含有GOS 和FOS (质量比9:1)的配方奶粉会得到与母乳喂养婴儿相似的肠道菌群。Roberfroid[127]和Boehm[90]对FOS 和GOS 的临床和益生元效果进行了综述。尽管已证明在许多靶点有效,如减少婴儿特应性皮炎的发生率[128],但在结构上与HMOs 和BMOs 有很大不同 (图3)。FOS 和GOS 是线性链,而HMOs 和BMOs 是支链结构。前者不存在岩藻糖、唾液酸和N-乙酰葡糖胺等单体,也没有表现出固有的结构复杂性。为弥补婴幼儿配方奶粉与母乳之间的差距,已开发出许多模拟HMOs 方法。例如:化学催化、酶催化、微生物发酵、膜分离以及转基因等。如表7所示,全球主要的HMOs 生产厂家约10 家。

表7 全球主要市售HMOs 及其生产厂家Table 7 Global commercially available HMOs and their manufacturers
化学模拟需要对每一个HMOs 分子进行重复保护和脱保护步骤。Dékany 等[129]使用化学方法开发了一种晶体中间体技术,来辅助保护HMOs 的纯化步骤,并利用该方法快速模拟了2′-FL。尽管化学模拟方法得到了发展,但对于工业规模的HMOs 模拟仍有一些缺陷,如只能模拟短链HMOs、立体选择性和总产率低以及存在有毒试剂残留风险等。因此,酶法和微生物法得到快速发展。例如,Choi 等[130]使用幽门螺杆菌的岩藻糖基转移酶,以核苷酸糖和GDP-β-L-岩藻糖为供体模拟了2′-FL 或3′-FL 结构。Endo 等[131]使用细菌唾液酸转移酶在大肠杆菌中表达模拟唾液酸化HMOs。Thomas 等[132]利用从母乳中纯化的FUT3,模拟了唾液酸化路易斯a、路易斯a 抗原和X 抗原,但仅限于小规模的制备。由于耦合微生物方法的高复杂性和低生产率,现又开发了使用重组大肠杆菌系统的单细胞方法。Ishikawa 等[133]在重组大肠杆菌细胞中,通过表达集胞蓝细菌slr1975 基因编码的GlcNAc 2-差异构酶和NeuAc 合酶基因编码的NeuAc 合成酶模拟出NeuAc。
依据低聚糖的分子质量大小,可采用膜分离法进行提取。Sarney 等[134]利用β-半乳糖苷酶和纳滤开发了一种从脱脂母乳中回收HMOs 的方法。运用此法可从1 L 脱脂母乳中获得约6.7 g HMOs,并且酶解技术显著提高了膜分离的效率和选择性。Altmann 等[135]以酶解脱脂牛乳为原料,采用不同的纳滤膜,实现了实验室、中试和工业规模的BMOs 富集。Cohen 等[136]采用超滤和纳滤集成技术富集了天然GMOs,其回收率达90%。此外,将人FUT2 基因导入小鼠,可表达2′-FL。Kelder 等[137]将同源系半乳糖基转移酶基因导入小鼠也取得了类似的结果,这表明乳腺会在糖基转移酶存在下产生相应的低聚糖[138]。同时,将2 种不同岩藻糖基转移酶基因导入小鼠,还能够模拟岩藻糖基化糖缀合物。因此,对小鼠进行转基因操作,可以预期地表达基因产物、糖基转移酶、低聚糖和重组糖蛋白等物质。
2'-FL 和LNnT 是HMOs 中最丰富的2 种寡糖,大约占总HMOs 的35%。于2015年获得欧盟和美国食品药品监督管理局的监管许可,其最大添加量及使用范围如表8所示。Marriage 等[10]和Reverri 等[139]通过喂养临床试验发现,含2'-FL 的婴儿配方奶粉可以有效维持婴儿的生长和耐受性,且2'-FL 的相对吸收和排泄与母乳喂养方式无显著差异。我国对2'-FL 能否作为一种新的食品添加剂,仍处于社会公开征求意见阶段(表8)。此外,仅添加1 种或2 种HMOs 到婴幼儿配方奶粉中无法再现母乳HMOs 的复杂作用。因此,开发一种HMOs 替代品需要亟待解决。

表8 我国及其他发达国家关于HMOs 最大添加量及使用范围aTable 8 The maximum amount and scope of HMOs in China and and other developed countriesa
7 BMOs 可作为模拟HMOs 的潜在来源
牛乳清是制作奶酪时产生的副产物,通常当作废液排掉[140]或通过喷雾干燥制备乳清粉以低价出售[141]。与其它畜乳汁相比,具有量大和成本低等特点。因此,利用乳清进行大规模提取BMOs 作为HMOs 替代品具有重大意义。通过中式膜设备从乳清中分离BMOs 的工艺已经研发出来[136,142]。BMOs 的功能研究也逐渐从体外转向体内和临床试验[143](图6)。Daniel 等[144]研究发现,乳清中的许多BMOs 组成与HMOs 相同。在测定的15 种酸性BMOs 中,3 种也存在于HMOs 中,8 种中性BMOs中,4 种也存在于HMOs 中。此外,HMOs 中的成分不一定每个都有效,组合起来效果似乎更好。Locascio 等[81]利用傅里叶变换离子回旋共振质谱法对双歧杆菌消耗HMOs 进行了糖组学分析,研究表明婴儿肠道分离的婴儿长双歧杆菌ATCC 15697 (Bifidobacterium longum biovar infantis ATCC 15697)消耗了总HMOs 的63.9%,主要包括5 个最丰富的短链HMOs 和3 个长链HMOs。
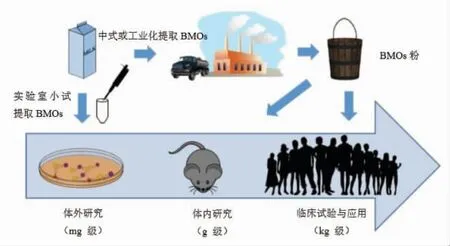
图6 BMOs 研究进程Fig.6 Research progress of BMOs
团队前期研究发现,乳清渗透液中游离BMOs总浓度比原料乳高10 倍[67,145],此结果与目前文献中所述的牛乳只含有微量低聚糖相比,该浓度要高得多。脱除乳糖后,BMOs 浓度可再提高4 倍。因此,膜分离技术为工业化生产HMOs 替代品提供了新的解决方案。
8 结论
HMOs 含量在母乳中仅次于乳糖及脂质。越来越多的证据表明,母乳的保护作用可能部分归因于HMOs,如益生元、病原体抑制、抗炎、免疫调节和大脑发育等。HMOs 在分子结构方面也不同于经典的GOS 和FOS。为弥补婴幼儿配方奶粉与母乳之间的差距,部分发达国家已将2'-FL 和LNnT 作为婴幼儿配方奶粉的补充剂。目前,尽管还没有商业化乳源性HMOs 代替物,但许多研究已表明,BMOs 具有HMOs 类似的结构和生物功能,并且在工业规模上使用膜分离技术提取可行的。因此,商业开发化BMOs 模拟GOS、FOS 和HMOs,并应用于婴幼儿配方和特殊医学等功能性食品上,既有食品健康的需求,也符合牛乳高附加值加工趋势。然而全方位的HMOs 模拟仍不能被商业化,因此母乳仍然是婴儿喂养的“黄金标准”。

