低氧胁迫对军曹鱼幼鱼免疫相关基因转录水平表达的影响
王维政,杨林桐,杨二军,谢瑞涛,3,陈刚,2,黄建盛,2*
( 1.广东海洋大学 水产学院,广东 湛江 524088;2.南方海洋科学与工程广东省实验室(湛江),广东 湛江 524025;3.广东恒兴饲料实业股份有限公司,广东 湛江 524022)
1 引言
免疫是动物以维持自身稳态为目的而进行的一种特异性的生理反应,根据免疫响应的类型,鱼类的免疫分为先天免疫和适应性免疫。先天免疫构成了鱼类抵御外界病原体感染的第一道防线,在早期的识别以及后期触发病原体入侵而导致的促炎反应中起着重要作用,通过模式识别受体(Pattern Recognition Receptors,PRRs)对病原体入侵的识别而启动。适应性免疫则负责对特定病原体产生特异性的免疫应答,两者在防御、自稳和监督方面发挥关键作用[1-2]。免疫系统主要包括免疫组织及器官、免疫细胞和免疫因子3种组成成分[3]。免疫组织和器官是动物机体免疫细胞发生、成熟、活化及最终产生免疫应答的场所,鱼类的免疫器官分为中枢免疫器官和外周免疫器官[4],其中鳃、肝脏、肠道和脾脏是鱼类重要的免疫器官[5-8],在免疫应答中扮演着重要的角色。免疫细胞包括淋巴细胞、巨噬细胞、自然杀伤细胞和粒细胞等,主要分布在免疫器官、淋巴液和血液中。免疫因子则包含细胞因子、补体和抗菌肽等[9-11],共同发挥免疫应答功能。
低氧是一种由人类活动或者环境变化引起的自然现象,作为鱼类的应激条件之一,会对鱼类的生长和健康造成影响。持续暴露在低氧环境中,鱼类的行为、代谢发生异常,还可能对免疫功能造成损伤,甚至导致鱼类的死亡[12]。据报道,相对于常氧,低氧对尼罗罗非鱼(Oreochromis niloticus)的免疫系统具有明显的抑制作用[13]。长期的低氧胁迫导致大西洋鲑(Salmo salar)免疫相关基因转录水平表达量的降低或延迟,从而改变其免疫反应[14]。在对金头鲷(Sparus aurata)的研究中也发现,低氧胁迫会抑制其头肾白细胞的呼吸爆发活力,从而降低其免疫力[15]。由此可见,低氧与鱼类的免疫能力息息相关,研究低氧对鱼类免疫功能的影响具有重要意义。
军曹鱼(Rachycentron canadum),隶属于鲈形目的单科单属单种鱼类(军曹鱼科,军曹鱼属),又被称作海鲡和海龙鱼,属于大型洄游性鱼类,在世界各地均有分布。军曹鱼因其饲料转化率高、肉质鲜美和市场价值巨大,在亚洲(尤其是中国)、北美洲、加勒比地区和南美洲大西洋沿岸等地区均有养殖[16],在全世界范围内的年产量约为59 538 t[17]。目前,关于低氧对军曹鱼免疫方面的报道还相对匮乏,本实验室前期开展了低氧对军曹鱼幼鱼肝脏免疫相关酶活的研究,为了进一步探究低氧对军曹鱼免疫功能的影响,本文以军曹鱼幼鱼为研究对象,探讨低氧对其免疫相关基因肿瘤坏死因子α(TNFα)、肿瘤坏死因子α诱导蛋白 3(TNFAIP3)、白细胞介素 1β(IL-1β)、白细胞介素1受体 2(IL-1R2)、白细胞介素 17C(IL-17C)和热休克蛋白70(HSP70)在不同组织(鳃、肝脏、肠道和脾脏)中的转录水平表达情况,为阐明军曹鱼低氧适应机制提供基础资料。
2 材料与方法
2.1 实验材料
本研究所用军曹鱼为当年人工繁育的幼鱼,2019年6月运到广东恒兴饲料股份有限公司863基地后,于室内24 h流水养殖系统暂养1周,初始体质量为(50.44±2.78)g,体长为(16.87±2.19)cm。暂养水温为(29±1)℃,溶解氧浓度在 6 mg/L以上,盐度为28~30,pH为7.8~8.0,自然光周期,每天早上 8:00和下午4:00各饱食投喂配合饲料(广东越群海洋生物研究开发有限公司)1次,1 h后清除残饵和粪便,实验开始前1天停止投喂。
2.2 低氧胁迫实验
根据实验要求将军曹鱼幼鱼分为常氧对照组和低氧胁迫组,每个处理组有3个重复,每个重复有35尾鱼。实验周期为28 d,常氧对照组所有条件与暂养期间一致,低氧胁迫组除溶解氧浓度控制在(3.15±0.21)mg/L的水平外,其他条件与暂养相同。低氧胁迫组的溶氧条件实现方法:首先关掉流水以及停止充气,在每个养殖水槽上方覆盖聚乙烯薄膜,最大限度地隔绝空气与水体的接触,利用军曹鱼的呼吸作用使水体的溶解氧浓度降至3 mg/L左右,其次不断调节充气量的大小以及流水速度来控制氧气的输入,以此稳定实验所需的溶氧条件,期间使用化学滴定法(GB 7489—87)检测水体的溶氧量。最终在实验期间,低氧胁迫组的溶解氧浓度稳定在(3.15±0.21)mg/L,常氧对照组溶解氧浓度为(6.18±0.24)mg/L。实验结束时低氧胁迫组军曹鱼体质量为(58.44±3.03)g,体长为(18.23±1.48)cm,常氧对照组军曹鱼体质量为(119.17±5.80)g,体长为(20.94±1.32)cm。
实验分别在低氧胁迫的第1天、第7天、第14天和第28天进行取样,且同时取对照组样品。取样时每个水槽取5尾军曹鱼,使用MS-222进行麻醉,解剖取鳃、肝脏、肠道和脾脏,装进2 mL冻存管后置于液氮速冻,运回实验室后放进-80℃冰箱保存待测。
2.3 总RNA的提取以及反转录
军曹鱼幼鱼各组织样品在液氮中研磨后,使用总RNA提取试剂盒TransZol Up Plus RNA Kit(北京全式金生物有限公司)提取组织的总RNA。通过1.5%琼脂糖凝胶电泳和超微量核酸蛋白测定仪检测其完整性和浓度后,以提取的总RNA为模板,根据反转录试剂盒EasyScript First-Strand cDNA Synthesis SuperMix(北京全式金生物有限公司)说明书进行反转录,合成模板cDNA。
2.4 引物设计
根据本实验室已有的军曹鱼肝脏转录组数据,筛选出注释为 TNFα、TNFAIP3、IL-1β、IL-1R2、IL-17C、HSP70和内参基因β-actin的unigene。经NCBI数据库Blast比对验证后,利用Primer Primer 6.0设计特异性引物 TNFα-F/R、TNFAIP3-F/R、IL-1β-F/R、IL-1R2-F/R、IL-17C-F/R、HSP70-F/R和β-actin-F/R(表1),用于实时荧光定量PCR(qRT-PCR)检测,每组样品重复3次,采用2-△△CT的方法计算各基因的相对表达量。

表1 本研究所用引物序列Table 1 Primer sequences used in this study
2.5 数据分析
使用GraphPad Prism 8软件对数据进行作图,采用配对t检验的方法进行数据差异显著性分析,p<0.05表示差异显著,p<0.01表示差异极显著。
3 结果
3.1 低氧胁迫对军曹鱼幼鱼鳃组织免疫相关基因转录水平表达的影响
低氧胁迫对军曹鱼幼鱼鳃组织免疫相关基因转录水平表达的影响见图1。由图1可知,在鳃组织中,低氧胁迫后,TNFα、IL-1R2和HSP70变化趋势相同,在胁迫1 d时,TNFα、IL-1R2基因表达量极显著下降(p<0.01),HSP70 显著下降(p<0.05),在胁迫 7 d 时上升至与对照组无显著性差异的水平后,在胁迫14 d时均极显著下降(p<0.01),在胁迫 28 d 时,TNFα、HSP70基因表达量极显著下降(p<0.01),IL-1R2显著下降(p<0.05);TNFAIP3 在胁迫 1 d 时极显著上升(p<0.01)后呈下降趋势,其中在胁迫7 d和14 d时分别与对照水平具有显著(p<0.05)和极显著差异(p<0.01),在胁迫28 d时上升至与对照组无显著差异的水平;IL-1β在胁迫1 d时极显著下降后极显著升高(p<0.01),在胁迫7 d、14 d和28 d时极显著高于对照组(p<0.01);IL-17C 在胁迫7 d 和14 d 时极显著下降(p<0.01),胁迫1 d和28 d与对照水平无显著差异。
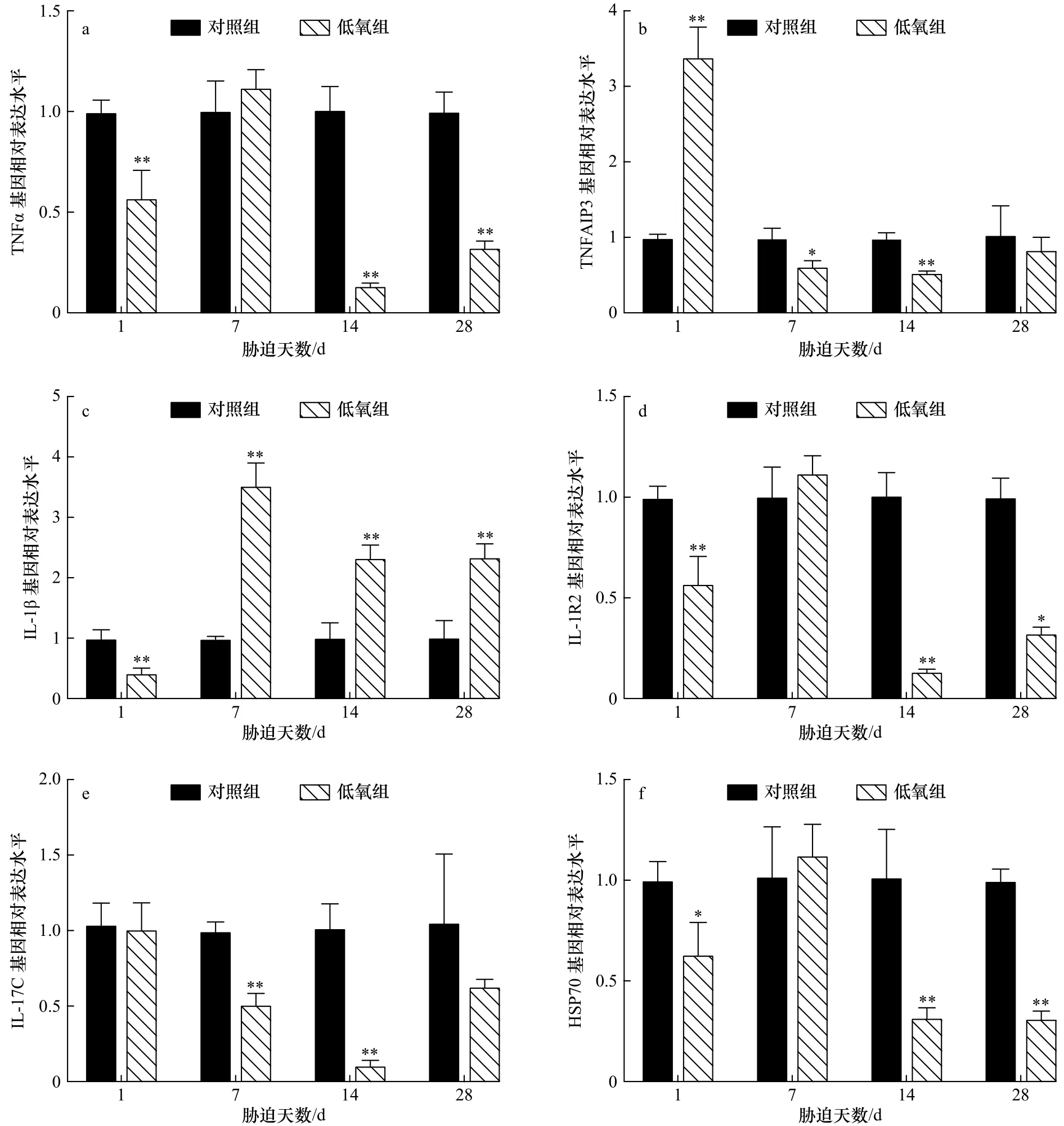
图1 低氧胁迫后军曹鱼幼鱼鳃组织 TNFα(a)、TNFAIP3(b)、IL-1β(c)、IL-1R2(d)、IL-17C(e)和 HSP70(f)基因的相对表达量Fig.1 Relative expression of TNFα (a), TNFAIP3 (b), IL-1β (c), IL-1R2 (d), IL-17C (e) and HSP70 (f) genes in gill of juvenile cobia after hypoxia
3.2 低氧胁迫对军曹鱼幼鱼肝脏免疫相关基因转录水平表达的影响
低氧胁迫对军曹鱼幼鱼肝脏免疫相关基因转录水平表达的影响见图2。由图2可知,在肝脏中,低氧胁迫后,TNFα和IL-1R2表达趋势一致,在胁迫1 d时显著下降(p<0.05)后上升,胁迫7 d时与对照组无显著差异,在胁迫14 d和28 d时分别极显著(p<0.01)和显著低于对照水平(p<0.05);TNFAIP3在胁迫 1 d时极显著升高(p<0.01)后显著下降,并且在胁迫14 d和28 d 时与对照组具有极显著差异(p<0.01);IL-1β 在所有时间点均极显著高于对照水平(p<0.01);IL-17C在胁迫 7 d、14 d和 28 d时极显著下降(p<0.01);HSP70基因表现为不断升高的变化趋势,在胁迫7 d和14 d时显著升高(p<0.05),在28 d 时则极显著上升(p<0.01)。
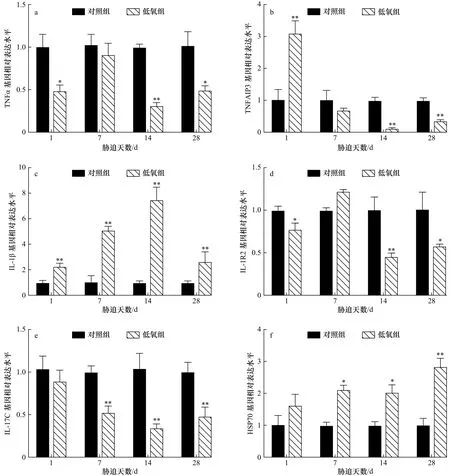
图2 低氧胁迫后军曹鱼幼鱼肝组织 TNFα(a)、TNFAIP3(b)、IL-1β(c)、IL-1R2(d)、IL-17C(e)和 HSP70(f)基因的相对表达量Fig.2 Relative expression of TNFα (a), TNFAIP3 (b), IL-1β (c), IL-1R2 (d), IL-17C (e) and HSP70 (f) genes in liver of juvenile cobia after hypoxia
3.3 低氧胁迫对军曹鱼幼鱼肠道免疫相关基因转录水平表达的影响
低氧胁迫对军曹鱼幼鱼肠道免疫相关基因转录水平表达的影响见图3。由图3可知,在肠道中,低氧胁迫后,TNFα、IL-1β、IL-1R2、IL-17C和 HSP70基因表达量在胁迫的所有时间点均极显著高于对照组(p<0.01),TNFAIP3基因表达量在胁迫 1 d时极显著升高(p<0.01)后显著下降,并且在胁迫7 d和14 d分别与对照组具有显著差异(p<0.05)和极显著差异(p<0.01)。
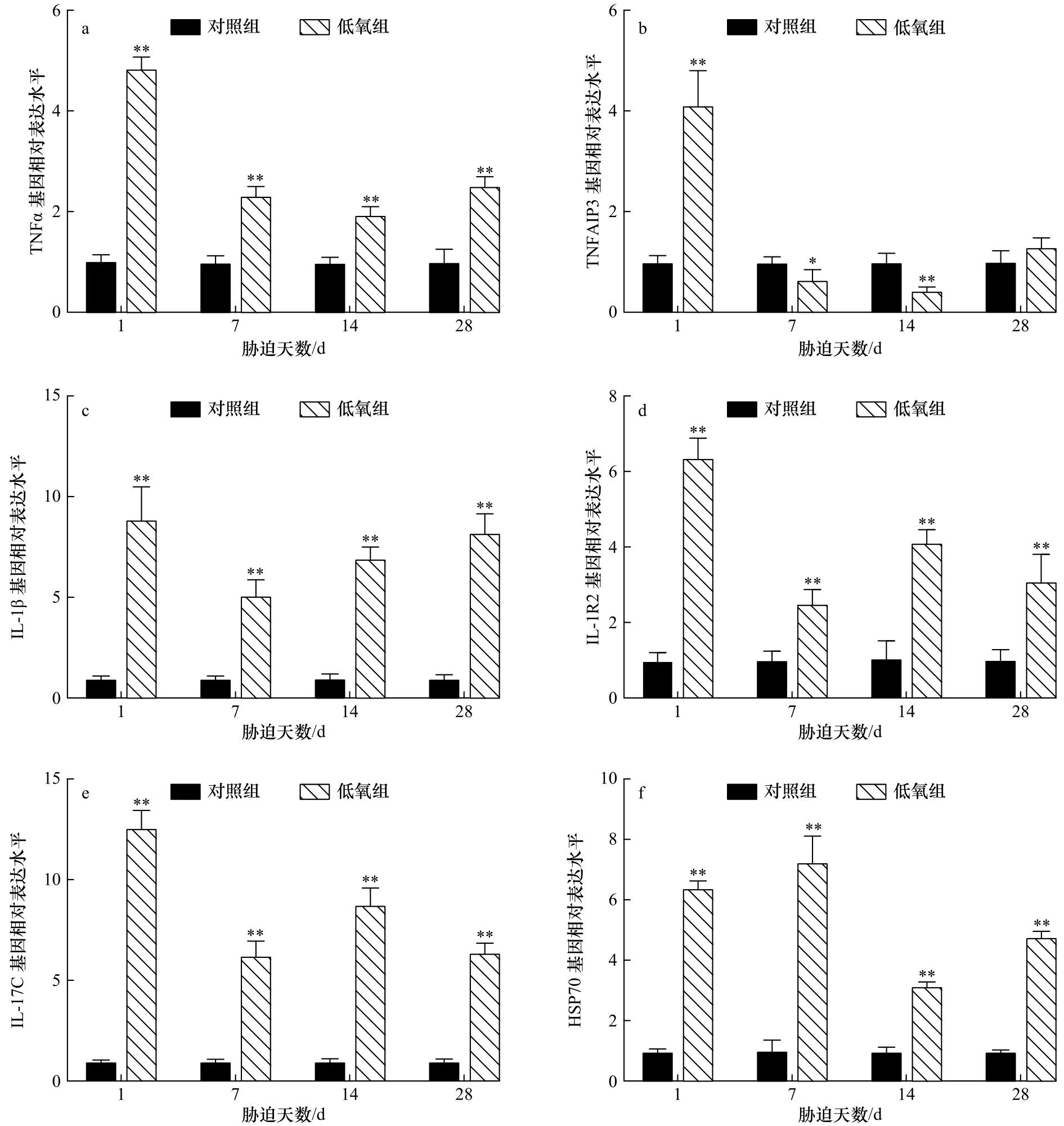
图3 低氧胁迫后军曹鱼幼鱼肠组织 TNFα(a)、TNFAIP3(b)、IL-1β(c)、IL-1R2(d)、IL-17C(e)和 HSP70(f)基因的相对表达量Fig.3 Relative expression of TNFα (a), TNFAIP3 (b), IL-1β (c), IL-1R2 (d), IL-17C (e) and HSP70 (f) genes in intestine of juvenile cobia after hypoxia
3.4 低氧胁迫对军曹鱼幼鱼脾脏免疫相关基因转录水平表达的影响
低氧胁迫对军曹鱼幼鱼脾脏免疫相关基因转录水平表达的影响见图4。由图4可知,在脾脏中,低氧胁迫后TNFα、IL-1β、IL-1R2和IL-17C具有相同的变化趋势,在胁迫的所有时间点均有明显的下降,其中,TNFα和IL-17C在胁迫1 d、7 d和14 d时极显著下降(p<0.01),在胁迫 28 d时则显著下降(p<0.05);IL-1β在胁迫 1 d和 28 d时极显著下降(p<0.01),在胁迫7 d 和 14 d 时则显著下降(p<0.05);IL-1R2 在胁迫 1 d、7 d和 28 d时极显著下降(p<0.01),在胁迫 14 d时则显著下降(p<0.05)。
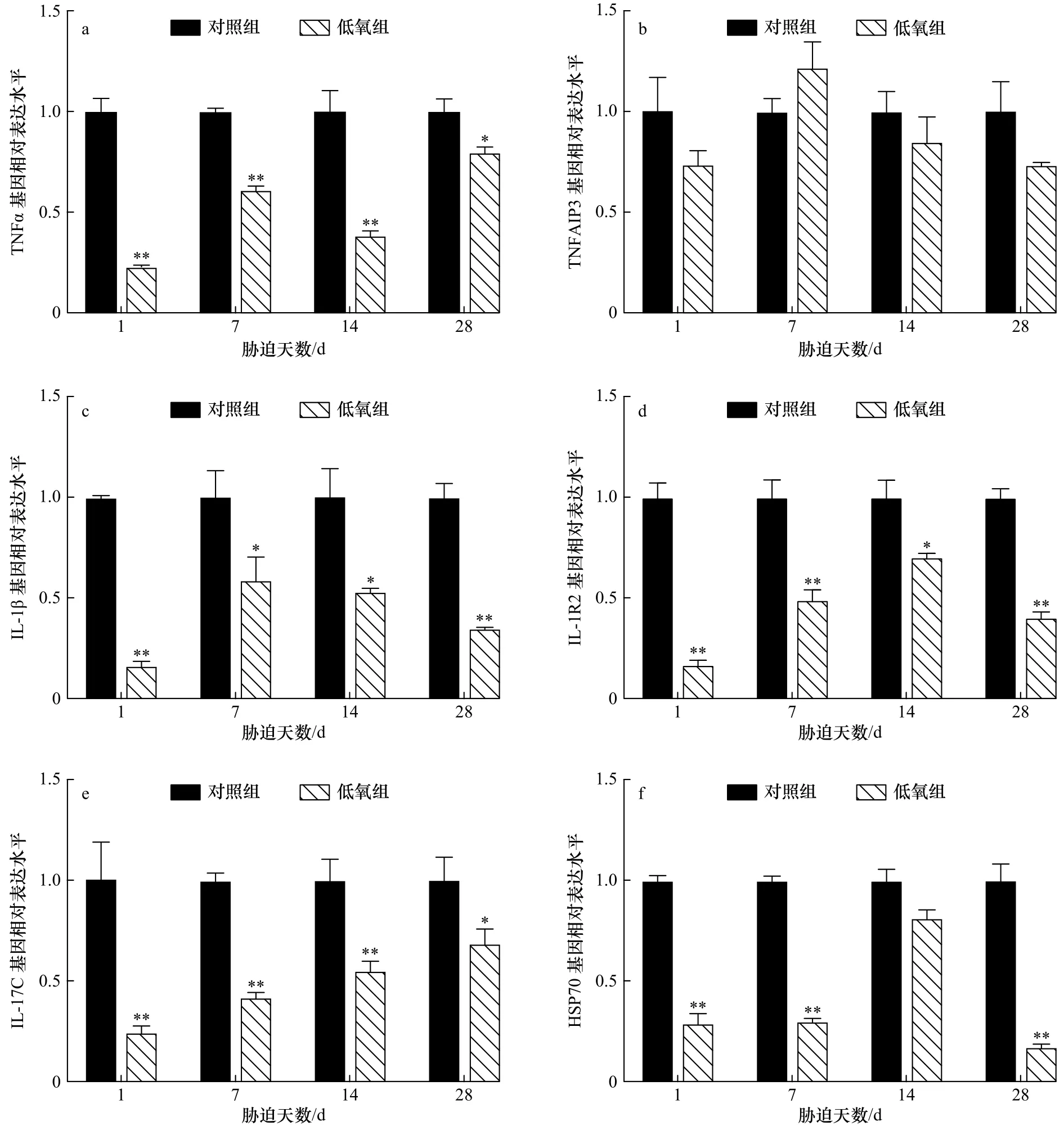
图4 低氧胁迫后军曹鱼幼鱼脾组织 TNFα(a)、TNFAIP3(b)、IL-1β(c)、IL-1R2(d)、IL-17C(e)和 HSP70(f)基因的相对表达量Fig.4 Relative expression of TNFα (a), TNFAIP3 (b), IL-1β (c), IL-1R2 (d), IL-17C (e) and HSP70 (f) genes in spleen of juvenile cobia after hypoxia
4 讨论
在养殖条件下,鱼类经常会受到低氧等的环境胁迫压力,暴露在环境胁迫中的鱼类不仅新陈代谢、渗透调节等会受到影响,其免疫屏障功能也会受损,如果长期受到环境胁迫的压力,还可能导致其生长缓慢、行为异常,并且增加其疾病易感性,对鱼类的养殖造成严重的损失[18]。在鱼类的免疫系统中,细胞因子由免疫细胞分泌,是一种调节免疫应答、修复损伤组织和抵抗病原体感染的关键介质[19]。TNFα是一种由巨噬细胞、单核细胞和分化的T细胞产生的促炎细胞因子,通过增加IL-1β和IL-6的产生、黏附因子的表达、成纤维细胞的增殖以及启动细胞毒性、凋亡和急性反应等实现促炎作用。IL-1β也是一种研究广泛的促炎细胞因子,通过各种类型的细胞启动2型环氧化物酶、磷脂酶A和诱导型一氧化氮合酶而产生,具有免疫上调和促炎活性[20]。TNFAIP3作为一种负调控因子,在免疫信号通路的负反馈调节中具有重要作用,可以作为NF-kB信号通路的负反馈调节因子,对NF-kB具有抑制功能,用以应对包括TNFα、IL-1β和LPS引起的多种炎症刺激,对于维持免疫稳态至关重要[21]。IL-1R2是IL-1受体家族的细胞因子受体,可调节细胞代谢和多种细胞因子诱导的免疫炎症反应,同时,IL-1R2是一个分子诱饵,可引诱IL-1β的结合而不启动后续的反应,从而抑制炎症,研究表明,其在溃疡性结肠炎缓解过程中起着稳态调节作用[22]。IL-17C作为先天免疫的中介因子,通过激活NF-kB通路和MAPK通路,在黏膜炎症和宿主抗病中发挥重要作用[23]。热休克蛋白(HSPs)在正常和应激条件下都发挥着重要的生物学作用,正常情况下,作为分子伴侣蛋白参与蛋白质的折叠和运输、细胞周期调控和细胞凋亡等,而在生物机体受到低氧等环境胁迫和微生物感染时,为了维持机体平衡,HSPs的表达显著增加[18]。HSP70作为一种应激反应蛋白可激活先天免疫,参与保护细胞质成分、对抗包括细菌感染在内的各种应激条件,并在保护生物体免受应激诱导的细胞损伤中具有关键作用[24-25]。
为了揭示低氧胁迫对军曹鱼幼鱼免疫功能的影响,本研究分析比较6种免疫相关基因在鳃、肝脏、肠道和脾脏中的转录水平表达情况,结果显示,该6个基因在不同组织中具有不同的变化趋势,原因可能是组织器官的功能特异性导致6个免疫相关基因响应情况的差异。鱼类的鳃直接与水体接触,是鱼类进行气体和水体交换的场所,具有滤食、排泄、调节渗透压和酸碱平衡的作用,同时,鱼鳃作为黏膜淋巴组织之一,也是鱼体的免疫器官[26]。肝脏作为脊椎动物最大的腺体器官,在消化、能量代谢和激素合成等方面具有重要意义,此外,肝脏还含有大量的免疫细胞,能够分泌产生细胞因子和补体等以应对病原体的入侵[27-28]。本文结果显示,军曹鱼幼鱼的鳃和肝脏中免疫基因的转录水平表达情况类似,TNFα、TNFAIP3、IL-1R2和IL-17C的表达在低氧胁迫后均出现了显著和极显著下降的变化情况,提示军曹鱼幼鱼的鳃和肝脏在胁迫过程中可能具有类似的免疫应答机制,根据基因的功能表明,低氧可能降低了鳃和肝脏的免疫能力。在前期实验结果中,低氧胁迫后,军曹鱼幼鱼血清谷丙转氨酶和谷草转氨酶活性显著升高,表明幼鱼肝脏受到一定程度的损伤[29],在卵形鲳鲹的研究结果中,14 d的低氧严重影响其鳃器官形态结构,肝组织发生明显的病理变化,受损严重[30-31],由此推测,低氧也可能对军曹鱼幼鱼的鳃和肝脏造成损伤,从而导致其免疫功能受到影响。IL-1β在鳃和肝脏中与其他炎症基因变化趋势相反,提示其参与鳃和肝脏免疫调控的机制可能存在差异,IL-1R2的诱饵功能以及TNFAIP3的负反馈调节作用的下降也可能是其表达升高的原因。HSP70基因的转录水平表达情况在鳃和肝脏中呈现相反的趋势,其表达量在鳃组织中出现显著和极显著下降的情况,而在肝脏中则持续升高,暗示与鳃组织相比,HSP70可能在肝脏抵御低氧胁迫过程中发挥关键的作用。此外,在研究结果中还观察到,总体来看,在低氧胁迫14 d和28 d后,免疫基因的表达量明显低于胁迫1 d和7 d,对此,研究表明,鱼类长期处于胁迫条件下,其免疫反应会受到抑制[32],该结果进一步说明28 d的低氧胁迫可能造成军曹鱼幼鱼的鳃和肝脏免疫功能的下降。
肠道除了具有消化和吸收功能以外,还具有免疫屏障功能,在肠黏膜中分布有大量的淋巴细胞以抵御病原体的入侵,是鱼体防御的第一道屏障[33]。研究发现,长时间的低氧应激会破坏肠道的紧密连接结构,导致肠道的固有屏障受损,从而增加肠道的通透性,进而增加病原体入侵的机会,引发肠道的免疫炎症[34-35]。通常,慢性肠道炎症还会伴随着促炎细胞因子的增加以及中性粒细胞和单核细胞的积累[36]。在本文的研究结果中,低氧胁迫后肠道TNFα、IL-1β和IL-17C等炎症相关基因以及HSP70基因的转录水平表达量极显著升高,负反馈调节因子TNFAIP3极显著升高后再显著下降。再结合实验室前期研究结果,低氧导致军曹鱼幼鱼肠黏膜皱襞高度、绒毛宽度、肌层厚度显著下降,微绒毛排列杂乱、萎缩、脱落(数据还未发表)以及肠道菌群中条件致病菌的增多[37],暗示低氧可能对肠道产生应激反应,导致军曹鱼幼鱼肠道结构受损,肠道通透性增加造成病原菌的入侵,进而引发了肠道炎症,导致军曹鱼肠道炎症相关基因和HSP70表达的增加。Niklasson等[38]研究也发现,长期的低氧引发了大西洋鲑的肠道炎症,肠道白细胞浸润增加,然而,其肠道促炎细胞因子IL-1β和IFN γ却没有升高的现象,与本文结果有所差异,推测其原因,可能是胁迫的时间、程度以及鱼的种类不同所致。
脾脏是硬骨鱼免疫系统中最后发育形成的免疫器官[8],含有淋巴细胞和巨噬细胞,发挥免疫功能,负责保护机体免受病原体的入侵和检测异常细胞,也是红细胞、中性粒细胞产生、成熟以及储存的地点,具有造血功能[39-40]。Mu等[41]对大黄鱼(Larimichthys crocea)低氧胁迫后的脾脏转录组进行分析,挖掘出大量免疫相关的差异表达基因,包括模式识别受体(PRRs),如 Toll样受体(TLR-1、TLR2-1、TLR2-2)、凝集素(FUCL1、FUCL4、FUCL5)和巨噬细胞甘露糖受体(MRC1)等均受到低氧的抑制,表达量显著下降,表明低氧可能抑制了PRRs介导的几种免疫应答的信号通路。本文的研究结果也出现类似的现象,低氧胁迫导致军曹鱼幼鱼脾脏6种免疫基因均表现出不同程度的下降趋势,提示低氧可能抑制了军曹鱼幼鱼脾脏的免疫功能,进而可能增加其感染病原菌的风险。
综上,28 d低氧胁迫后,军曹鱼幼鱼鳃、肝脏、肠道和脾脏中的免疫相关基因的转录表达水平发生显著性的变化,长期的低氧可能抑制了幼鱼的免疫功能,引发肠道炎症,并增加幼鱼感染病原菌的风险。

