多巴胺对急性间歇性低氧诱导的大鼠颈动脉体低氧敏感性的影响*
贾祥磊, 刘玉珍, 李超红, 范娅楠
((1. 新乡医学院第一附属医院, 2. 河南省神经修复重点实验室, 新乡 453100)
颈动脉体是重要的外周血动脉氧分压感受器,主要由I型细胞和II型细胞组成。I型细胞聚集成簇,是氧敏感细胞,含有多种神经递质,与窦神经传入纤维末梢形成突触连接。颈动脉体对外周血氧的变化有较高敏感性,在低氧条件下,窦神经活动增强,去除低氧后,窦神经活动恢复正常[1]。阻塞性睡眠呼吸暂停(obstructive sleep apnea, OSA)患者长期睡眠中处于低氧状态,窦神经的活动增加。研究表明,慢性间歇性低氧引起的交感神经活性增加和OSA 患者出现的血压升高有关[2]。研究表明,在阻塞性睡眠呼吸暂停综合症的发病早期,患者在睡眠中处于一个急性间歇性低氧阶段。在研究中发现,模拟高碳酸血症患者的模型实验中,给予颈动脉体急性间接性低氧,颈动脉体的放电活动增加,产生长时程易化的现象,说明在急性间歇性低氧刺激颈动脉体可以产生可塑性[3]。在低氧条件下,可激活酪氨酸羟化酶,作为酪氨酸羟化酶下游产物的多巴胺以递质形式从细胞中分泌,从I型细胞分泌到突触间隙,作用于窦神经。本实验模拟OSA 患者早期症状,给予颈动脉体急性间歇性低氧后,再次给予颈动脉体低氧时,记录窦神经放电活动是否发生改变,多巴胺在可塑性中起到何作用。旨在为多巴胺在早期OSA中如何调控颈动脉体-窦神经的活动生理研究提供参考。
1 材料与方法
1.1 实验动物
雄性SD大鼠,由河南省实验动物中心提供,体重220~280 g,每笼5只饲养。摄食饮水自由。垫料每周清扫更换一次。
1.2 缓冲液
NaCl 118 mmol/L,KCl 4.7 mmol/L,KH2PO41.2 mmol/L,MgSO41.6 mmol/L,NaHCO325 mmol/L,Glucose 5.6 mmol/L,CaCl22.5 mmol/L(生工生物工程股份有限公司),多巴胺(上海禾丰制药有限公司),异氟烷(瑞沃德生命科技有限公司)
1.3 电信号记录系统
八通道电生理信号采集系统Powerlab(Adinstruments公司)
1.4 分离颈动脉体-窦神经
用异氟烷麻醉动物后断头,快速分离出颈动脉分叉。移至冰的缓冲液中,在体视镜下,将颈动脉体-窦神经分离出来。根据实验内容分为急性间歇低氧(acute intermittent hypoxia, AIH)之前给低氧为Pre,AIH之后第一次给低氧为Post,AIH后第三次低氧为3 th ,AIH之前低氧和多巴胺为Pre 5%O2+Dopamine,AIH之后给予低氧和多巴胺为Post 5%O2+Dopamine。组内各指标进行比较。
1.5 窦神经电信号记录
将分离的窦神经和颈动脉体移入37℃灌流槽(6 ml/min),缓冲液充入气体饱和(95% O2+5% CO2),然后把分离的窦神经吸入到记录的玻璃电极中(电极尖端直径约100 μm)。在低氧记录中饱和的气体为5%O2+5%CO2+90%N2平衡。根据参考文献[4],最终记录中使用多巴胺的浓度为100 μmol/L。
1.6 急性间歇性低氧
5% O2+5% CO2+90% N2的缓冲液30 s,95 %O2+5% CO2的缓冲液90 s,2 min一个循环,共10个循环。
1.7 统计学处理
2 结果
2.1 急性间歇性低氧对颈动脉体低氧敏感性的影响
如图1A所示,记录窦神经基础放电10 min,给予低氧刺激,窦神经的活动增加。10 min过后,给予急性间歇性低氧循环,10个循环,共20 min。给予急性间歇性低氧结束10 min后,再给予多次低氧刺激,刺激间隔10 min,AIH后第一次低氧记为Post,第二次低氧为 2 nd。图1B所示,给予急性间歇性低氧后(Post),窦神经较Pre对低氧的放电活动增加。给予急性间歇性低氧前的低氧刺激(Pre)为基准,标化为100%,给予急性间歇性低氧应激后,窦神经对低氧的反应增加2.5倍(267±61vs100±21,图1C)。
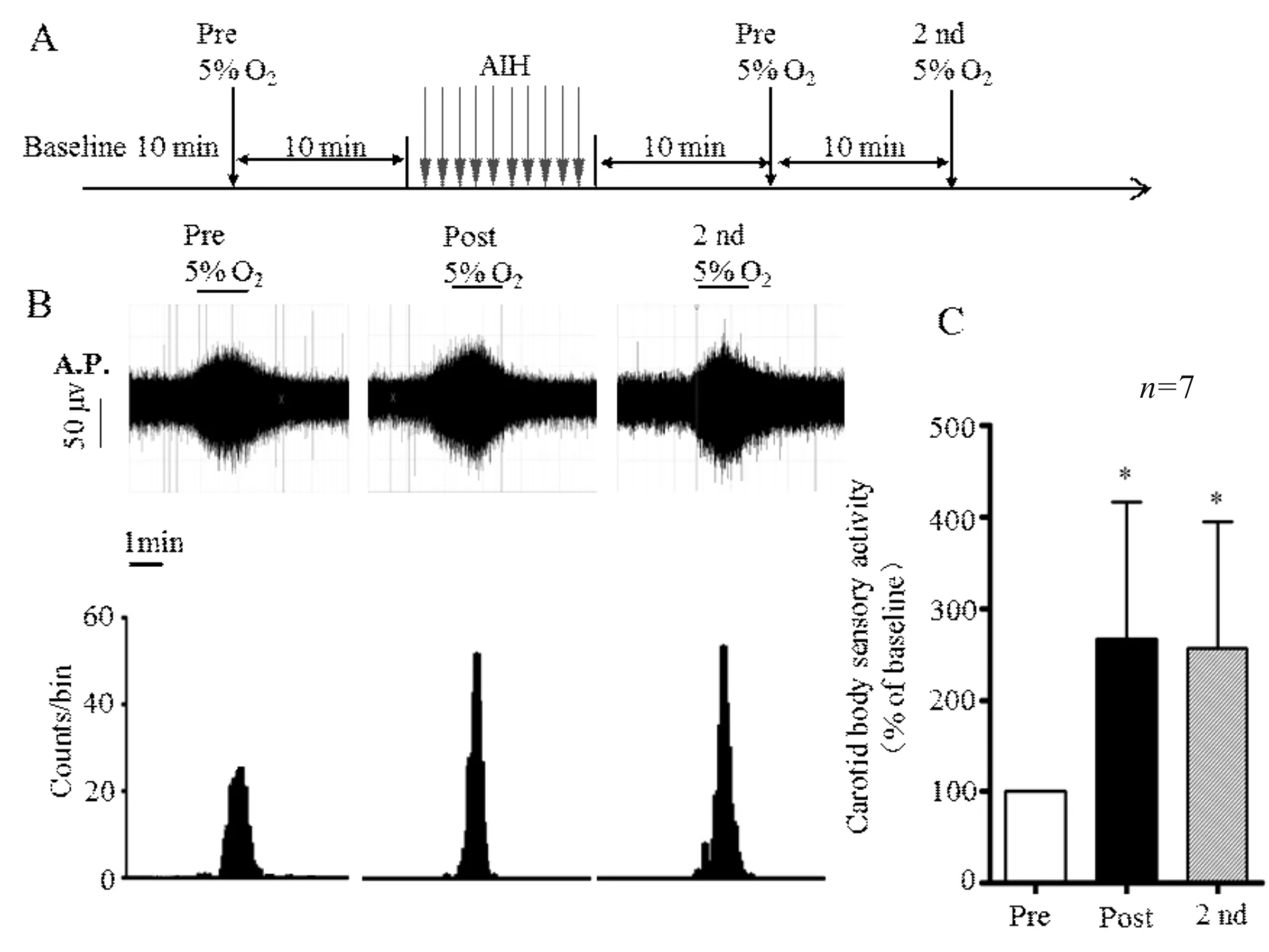
Fig. 1 Increased sensitivity of sinus nerve to hypoxia stress after acute intermittent hypoxia stress
2.2 多巴胺对急性低氧应激后颈动脉体低氧敏感性的影响
如图2A中所示,AIH之前给低氧为Pre,AIH之后第一次给低氧为Post,AIH之后给予低氧和多巴胺为5%O2+Dopamine,Post后第三次低氧为3 th。如图2B所示,5%O2+Dopamine较Post,发现窦神经给予多巴胺(100 μmol/L)后,可以抑制窦神经的活动。给予急性间歇性低氧前的低氧(Pre)刺激为基准,标化为100%,如图2C所示,Post与Pre比较,说明窦神经对低氧的反应增加。但加入多巴胺后,从5%O2+Dopamine(27±5)与Post(272±54)比较,说明多巴胺抑制了这种增强。洗脱多巴胺之后(3 th),窦神经放电增强。
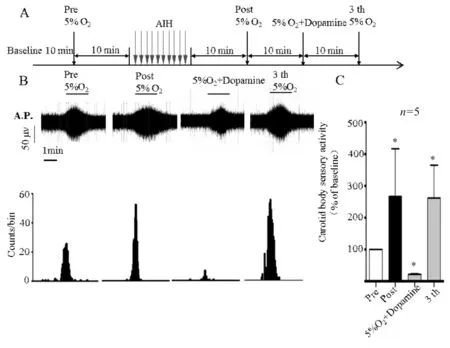
Fig. 2 Dopamine inhibits the sensitivity of carotid body to hypoxia after acute hypoxia stress
2.3 多巴胺对急性间歇性缺氧后窦神经放电抑制作用的影响
如图3A所示,AIH之前给低氧为Pre,AIH之后给低氧为Post,AIH之前低氧和多巴胺为Pre 5%O2+Dopamine,AIH之后给予低氧和多巴胺为Post 5%O2+Dopamine。如图3B所Pre 5%O2+Dopamine与Post 5%O2+Dopamine相比较(72±8vs24±3),当颈动脉体给予急性间歇性低氧后(图3A所示AIH),Post 5%O2+Dopamine条件下的窦神经放电活动减弱,说明多巴胺更加抑制窦神经的活动。
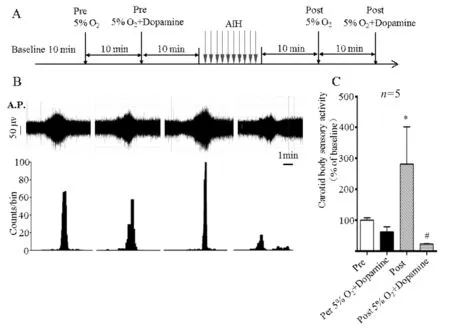
Fig. 3 Dopamine inhibits carotid body's hypoxia sensitivity enhancement after acute hypoxia stress
3 讨论
低氧对机体的影响是一个复杂的过程。有实验发现,慢性间断性低氧大鼠认知功能减退,且前额叶皮层和海马神经元病理性损伤[5],包括机体的免疫机能也受到低氧的影响[6]。阻塞性睡眠呼吸暂停综合症就是睡眠中长期氧气低通量病症,但对于早期的患者是处于急性低氧期。那么,急性间歇性低氧对于颈动脉体活动是否有影响,对此本文进行了探讨。
研究表明,颈动脉体为重要的外周化学感受器,主要功能是感受动脉血氧分压的变化,通过窦神经,反射性地对呼吸系统和心血管系统进行调节。颈动脉体可以瞬间感知机体氧浓度的变化,并迅速做出反应[7]。本实验中给予颈动脉体急性间歇性低氧刺激,颈动脉体对低氧的敏感性增强,窦神经的放电活动增加。说明急性间歇性低氧应激可以改变颈动脉体对低氧反应,急性间歇性低氧使颈动脉体出现可塑性。
多巴胺受体在中枢系统广泛表达,属于G蛋白耦联受体家族。多巴胺受体可分为D1类和D2类受体。D1类受体包括D1和D5受体(在大鼠也称D1A和D1B受体),D2类受体包括D2,D3和D4受体。D1类受体激活后升高细胞内cAMP水平,D2类受体激活后降低细胞内cAMP水平[8]。在中枢系统海马区,阻断多巴胺受体可以使大鼠的学习记忆能力降低。CA1区在D1受体基因敲除小鼠的实验中发现长时程增强完全消失,小鼠的空间学习记忆能力明显受损[9, 10]。多巴胺受体在颈动脉体中也有表达,参与对低氧的调控[11]。Gonzalez等在兔的颈动脉体实验上证明,多巴胺在颈动脉体细胞内合成,储存,当给予5 min低氧刺激后,检测孵育液,发现多巴胺作为递质从细胞分泌,多巴胺是一种兴奋性神经递质参与到颈动脉体对低氧的反应中[12, 13]。后来, Iturriaga等在猫和大鼠中也证明多巴胺的存在,但是研究发现,当给予离体灌流颈动脉体低氧刺激,多巴胺外流增加在窦神经放电快速增加后延迟出现,重复低氧灌流低氧刺激颈动脉体,窦神经放电增加而多巴胺的释放量却在减少[14]。但是,也有人认为,多巴胺受体在颈动脉体低氧调控中起到双重作用,发现给予低氧刺激颈动脉体多巴胺受体表达上调,而在孤束核多巴胺受体下调。研究发现在发育中的大鼠,多巴胺的激活可抑制N-型钙离子通道的活动,抑制神经放电活动[15]。本研究结果表明,在外源性的多巴胺存在时,对窦神经放电呈现抑制作用。而给予急性间歇性低氧处理后,在多巴胺的存在下较急性间歇性低氧前更加抑制窦神经活动。本实验施加急性间歇性低氧应激后,颈动脉体上的功能性多巴胺受体可能增多,从而更加的抑制窦神经的活动。给予外源性多巴胺,作用突触后D2R受体上,可导致AC抑制,细胞内cAMP减少引起电流抑制,导致膜兴奋性降低,从而减弱突触传递。Dopamine也可能在突触前抑制,通过负反馈抑制细胞Ca2+电流降低神经的兴奋传递。另外,当给予外源性多巴胺时,通过抑制cAMP,而抑制ATP通过P2x2/3受体对突触后的兴奋作用[16]。关于多巴胺如何调控颈动脉体-窦神经的活动还需进一步研究。
对于阻塞性睡眠呼吸暂停综合症早期患者来说,还未达到阻塞性睡眠呼吸暂停的病理指征,但患者睡眠中存在短暂的急性间歇性低氧现象。本实验发现急性间歇性低氧后,再给予低氧刺激时颈动脉体的活动加强。早期的患者睡眠中急性间歇性低氧,低氧期间窦神经的活动较急性间歇性低氧应激前增加,从而进一步调节交感神经兴奋[17],因此对于有高血压基础等疾病的患者,可能增加睡眠中猝死风险。本实验结果表明,多巴胺可以抑制急性间歇性低氧后窦神经放电活动,但是否能用多巴胺来调节早期阻塞性睡眠呼吸暂停患者睡眠中窦神经活动的兴奋性,需进一步验证。

