转录辅助激活因子p300通过调控TGF-β/Smad3信号通路参与高静水压诱导的心房纤维化
余声欢,曾珑,饶 芳,肖海茵,邓春玉,薛玉梅,吴书林,魏 薇
(1.华南理工大学医学院,广东 广州 510006;2.广东省心血管病研究所心内科, 广东省人民医院医学研究部,广东省医学科学院,广东 广州 510080)
心房颤动(atrial fibrillation,AF)是临床最常见的持续性心律失常,在一般人群中患病率达1%-2%,且随着人口老龄化和心血管疾病生存率的增加,其发病率呈逐年上升趋势[1]。结构重塑是AF发生的主要病理机制之一,成纤维细胞活化,结缔组织沉积加剧和纤维化是心房结构重构的标志[2]。高血压(hypertension,HTN)是AF的独立危险因素,心房高压对AF及其并发症的发生起着重要的作用,但心房高压在AF发生中的作用机制仍不清楚。
心血管系统承受3种机械应力,包括剪切应力、牵张力和静水压[3]。心血管静水压是指血流对单位面积血管的侧压力。HTN时心房内包括静水压在内的机械应力增加,导致心房肌细胞的拉伸和压力增加,心房舒张和收缩功能障碍,进一步导致心房重塑及AF的发生。我们课题组前期研究表明,高静水压培养的心房肌细胞株(HL-1细胞),肾素-血管紧张素系统和黏着斑激酶-Src信号通路激活[4]。我们研究发现,高压直接刺激可诱导野生型Wistar大鼠心房成纤维细胞的分泌和增殖,Smad3/转化生长因子-β(transforminggrowthfactor-β,TGF-β)信号通路介导此过程[5]。
1 材料与方法
1.1 人组织标本本研究基于赫尔辛基宣言中阐述的原则,经我院伦理委员会批准,所有患者签署知情同意书。有肺炎或其它感染性疾病者不入选。本研究共入选25例患者,收集窦性心律(sinus rhythm,SR)和AF不合并HTN患者各8例,AF合并HTN者9例,SR患者心耳由器官捐献者提供,AF和AF合并HTN患者的左心耳组织来自AF外科消融手术经胸腔镜切除,心耳组织置于冰盒中运送至实验室,分装至EP管中,储存于-80 ℃,用于蛋白检测。
1.2 实验动物SPF级C57BL/6小鼠,♂,8-12周龄,体质量(20-30)g。由广东省广州中医药大学实验动物中心提供,许可证号为SCXK(粤)2013-0034。心耳成纤维细胞由小鼠心耳分离获取,传至p2代细胞用于实验。本研究所有人体及动物实验已通过广东省人民医院(广东省医学科学院)的医学研究伦理审查(201904010451)。
1.3 主要试剂特级澳洲胎牛血清、DMEM-F12培养基和0.25% EDTA-胰蛋白酶(Gibco);姜黄素(Cayman);脱脂奶粉(BD);二甲基亚砜、4× SDS上样缓冲液(Sigma);聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜和抗p300抗体(Millipore);抗Ⅰ型胶原蛋白α1链(collage typeⅠα1 chain,Col-1A1)抗体;抗Ⅲ型胶原蛋白α1链(collage type Ⅲ α1 chain,Col-3A1)抗体;抗Smad3抗体;抗p-Smad3抗体(Abcam);抗基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)抗体;抗基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)抗体;抗TGF-β抗体(Cell Signaling Technology);抗GAPDH抗体(Proteintech);p300小干扰RNA(small interfering RNA,siRNA)和阴性对照(上海吉凯基因科技有限公司); CCK-8试剂盒(同仁);其它生化试剂均为进口分装或者国产纯化。
1.4 细胞培养和传代使用0.25% EDTA-胰蛋白酶,从8-12周龄雄性SPF级C57BL/6小鼠取左心耳进行消化,差速贴壁法分离出心耳成纤维细胞,采用含10% FBS、1×105U·L-1青霉素和100 mg·L-1链霉素的DMEM-F12培养基置于37 ℃、5% CO2恒温培养箱中培养。从培养瓶中吸出旧培养基,用2 mL PBS冲洗细胞2次,加入0.25%胰酶消化约1 min,加入含血清的培养基中和,用移液枪吹打培养皿使细胞脱落,200×g离心5 min,1 ∶2分装入新的培养皿。
1.5 细胞干预C57BL/6小鼠消化分离的心耳成纤维细胞传至p2代,将细胞接种于60 mm培养皿中置于37 ℃、5% CO2恒温培养箱中培养,待细胞密度达到70%-80%,将细胞分别置于0、20和40 mmHg静水压中培养24 h后收皿。C57BL/6小鼠消化分离的心耳成纤维细胞传至p2代,将细胞接种于60 mm培养皿中,待细胞密度达到70%-80%,换液后分别加入浓度为3 μmol·L-1和10 μmol·L-1的姜黄素干预,放入37 ℃、5% CO2、40 mmHg压力的高压培养箱继续培养24 h后收皿,用于后续实验。将C57BL/6小鼠消化分离的心耳成纤维细胞传至p2代,将细胞接种于60 mm培养皿中,待细胞密度达到70%-80%,进行转染操作。5 μg p300 siRNA、助转染剂p3000与相应体积Opti-MEM培养基充分混合,10 μL Lipofectamine 3000试剂与相应体积的Opti-MEM培养基充分混合。然后将分别含有p300 siRNA和Lipofectamine 3000脂质体的溶液充分混匀,室温下孵育15 min后放入37 ℃、5% CO2、40 mmHg压力的高压培养箱继续培养,24 h后收皿,用于后续实验。
1.6 Western blot通过细胞或剪碎研磨的组织内加入适量RIPA裂解液,同时加入蛋白酶抑制剂,冰上裂解30 min,收集裂解液,10 000 ×g离心15 min,取上清,分装后储存于-80 ℃。BCA法测定蛋白浓度后,4 × SDS上样缓冲液稀释后的30 μg样本,55 ℃加热10 min变性。8% SDS-PAGE分离蛋白,然后转至PVDF膜。TBST-脱脂牛奶室温下封1 h,加入相应I抗[p300(1 ∶1 000)、Col1A1(1 ∶2 000)、Col3A1(1 ∶2 000)、MMP-2(1 ∶2 000)、MMP-9(1 ∶1 000)、Smad3(1 ∶1 000)、p-Smad3(1 ∶1 000)、TGF-β(1 ∶1 000)和GAPDH(1 ∶10 000)],4 ℃过夜。TBST洗3次,每次10 min。根据I抗来源种属选择合适的II抗(辣根过氧化物酶标记的抗兔或抗小鼠IgG),5 %脱脂奶粉1 ∶1 000比例稀释,室温孵育1 h。TBST洗3次,每次5 min。ECL试剂盒显影蛋白条带,ImageJ软件定量分析蛋白灰度值,计算比值进行统计分析。
1.7 CCK-8原代分离的成纤维细胞传至p2代,将细胞悬液接种于96孔细胞培养板中,每孔100 μL,分别置于不同静水压的压力培养箱中培养24 h后更换培养液,每孔加入10 μL CCK-8试剂,孵育4 h后在450 nm波长处测定吸光度。
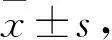
MOOC建设完成后上线试运行,检查MOOC建设的质量和效果。至少经过一个完整的教学周期,发现其中一些不尽如意的地方;可能还会产生一些新的想法,需要再添加一些内容或者闯关题、测试题,一是督促学生仔细观看视频,二是督促学生动脑思考,三是便于考核学生的学习过程,记录考核成绩。最后,再集中修改、完善。
2 结果
2.1 HTN合并AF患者左心耳组织p300及纤维化相关指标表达升高Western blot检测SR、单纯AF和HTN合并AF 3组患者左心耳组织的p300及TGF-β/Smad3信号通路相关蛋白TGF-β、Smad3/p-Smad3及下游纤维化因子Col-1A1、Col-3A1、MMP-2/9的表达。HTN合并AF组患者p300表达比单纯AF患者和SR患者明显升高(Fig 1A, C),而单纯AF组患者p300表达比SR组患者也明显升高(Fig 1A, C)。同时,HTN合并AF组患者纤维化相关蛋白表达高于单纯AF患者和SR患者(Fig 1),而单纯AF组患者纤维化相关蛋白表达高于SR患者(Fig 1),HTN合并AF组患者磷酸化Smad3(p-Smad3)和Smad3的比值p-Smad3/Smad3高于AF组和SR组(Fig 1B),而AF组患者p-Smad3/Smad3的比值高于SR组(Fig 1B)。以上结果表明,HTN合并AF患者左心耳组织的p300表达明显升高,TGF-β/Smad3信号通路激活,同时伴随着下游纤维化相关蛋白的表达升高。
2.2 高静水压可刺激小鼠心耳成纤维细胞p300及纤维化指标表达升高为了验证高静水压刺激能否促进心房成纤维细胞分泌p300和纤维化相关蛋白,使用酶解分离法消化差速贴壁分离8-12周龄C57BL/6小鼠原代心耳成纤维细胞,传至p2代分别置于0、20和40 mmHg梯度压力下培养,模仿心房内压力增高,Western blot检测p300和TGF-β/Smad3及下游纤维化因子Col-1A1、Col-3A1、MMP-2/9的表达。结果显示,与0 mmHg组相比,20 mmHg静水压下上述指标有上升趋势,但差异无统计学意义,而40 mmHg高静水压可促进小鼠心耳成纤维细胞p300表达升高(Fig 2A, C)。同时,40 mmHg高静水压刺激亦可促进心房成纤维细胞的Col-1A1、MMP-2/9、Smad3/p-Smad3和TGF-β的表达明显升高(Fig 2),其中20和40 mmHg静水压组p-Smad3/Smad3的比值与0 mmHg组相比有增加趋势(Fig 2B),但3组组间差异均无统计学意义。因此,在高静水压下,小鼠心耳成纤维细胞p300表达升高,TGF-β/Smad3信号通路激活,同时伴随着下游纤维化相关蛋白的表达升高。
2.3 姜黄素可逆转高静水压引起的p300及纤维化指标升高为探索p300是否参与高静水压引起的成纤维细胞分泌活化,使用不同浓度的p300 HAT抑制剂-姜黄素(3 μmol·L-1和10 μmol·L-1)干预小鼠原代心耳成纤维细胞,干预后置于40 mmHg压力下培养24 h,Western blot检测p300蛋白及TGF-β/Smad3信号通路蛋白和下游纤维化因子Col-1A1、Col-3A1、MMP-2/9的表达。结果显示,与单纯压力组相比,高浓度(10 μmol·L-1)姜黄素抑制p300可以逆转高静水压诱导的TGF-β/Smad3信号通路蛋白和下游纤维化因子Col-1A1、Col-3A1、MMP-2/9的表达升高(Fig 3),同时也可以逆转降低p-Smad3/Smad3的比值(Fig 3B)。这提示,p300在高静水压诱导的心房纤维化中可能通过调控TGF-β/Smad3信号通路发挥作用。

Fig 1 Increased expression of p300 and fibrotic factors in left atrial appendage tissues of patients in HTN combined with AF group
Fig 2 Expressions of p300 and fibrotic factors in fibroblasts increased by high hydrostatic pressure
2.4 p300 siRNA敲低p300表达逆转压力引起的纤维化指标升高使用p300 siRNA敲低小鼠原代心耳成纤维细胞的p300,分别置于0 mmHg和40 mmHg压力下培养,Western blot检测p300和TGF-β/Smad3信号通路相关蛋白及下游纤维化因子Col-1A1、Col-3A1、MMP-2/9的表达。结果显示,小鼠心耳成纤维细胞在加入p300 siRNA后,高静水压下p300及TGF-β/Smad3信号通路蛋白和下游纤维化因子Col-1A1、Col-3A1、MMP-2/9的表达升高得以逆转(Fig 4),同时p-Smad3/Smad3的比值有降低的趋势(Fig 4B)。因此,p300 siRNA敲低p300表达同样可以调控TGF-β/Smad3信号通路,逆转压力引起的纤维化指标升高。
2.5 姜黄素可逆转高静水压诱导的小鼠心耳成纤维细胞增殖使用CCK-8法检测不同静水压对原代小鼠心耳成纤维细胞增殖的影响,结果显示,20 mmHg和40 mmHg静水压培养小鼠心耳成纤维细胞可促进其增殖(Fig 5A),在40 mmHg 静水压下培养的成纤维细胞中加入10 μmol·L-1的p300抑制剂姜黄素后,可逆转高静水压对成纤维细胞的促增殖作用(Fig 5B)。
3 讨论
本研究发现,AF患者左心耳组织中,p300及TGF-β/Smad3信号通路相关蛋白TGF-β、p-Smad3/Smad3及下游纤维化因子Col-1A1、Col-3A1、MMP-2/9的表达和p-Smad3/Smad3蛋白表达的比值较SR者升高,合并HTN的AF患者心房组织上述指标表达较单纯AF患者和SR者高。在细胞层面,给予高静水压可使小鼠心耳成纤维细胞增殖活力增加及p300和TGF-β/Smad3信号通路相关蛋白及下游纤维化因子表达增加;抑制p300的活性和表达可以逆转高静水压诱导的TGF-β/Smad3信号通路蛋白和下游纤维化因子Col-1A1、Col-3A1、MMP-2/9的表达。证明p300表达参与了高静水压所致的心房纤维化,其作用机制可能是通过调控TGF-β/Smad3信号通路。

Fig 3 Curcumin reversed increase of p300 and fibrotic factors in fibroblasts caused by high hydrostatic pressure
AF与HTN密切相关,长期HTN引起心室僵硬度增加和收缩舒张功能障碍,引起左心房内的机械应力升高,心房超负荷引起心房结构重塑和电重塑,导致AF的发生。正常人的左房压力约8-12 mmHg,有研究指出,AF时有34%的患者左房压升高[9],HTN时左房压力也升高。HTN可导致心房发生成纤维细胞活化在内的结构重构,从而进一步导致心房纤维化。心房纤维化在心律失常折返的维持中发挥了中心作用,AF患者纤维组织的含量和分布不仅与AF的机制有关,而且与AF的并发症和治疗失败风险相关[10]。目前,心房高压致心房纤维化的具体机制尚不明确。心血管系统承受机械应力在AF发病的细胞机制方面的研究,主要集中在牵张力对心房肌细胞结构重构和电重构的影响[11],这些研究通过利用硅胶膜对细胞进行拉伸,模拟细胞在高牵张力下的病理状态,但忽略了静水压的作用,高静水压对细胞的作用值得进一步研究。少量文献报道了静水压对心房重构的影响,有研究表明,在80-160 mmHg的高静水压培养Wistar大鼠心肌细胞60 min,可诱导心肌细胞早期肥大反应标志c-fos mRNA表达升高[12]。另有研究发现,在180 mmHg高静水压培养的大鼠心肌H9c2细胞中,高静水压通过激活G蛋白偶联受体Apelin上调磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路调节自噬,并促进心肌细胞的肥大[13],以上研究所采用的模型均为心肌细胞,成纤维细胞较少受到关注。心脏成纤维细胞占所有心脏细胞的30%,通过分泌胶原蛋白、弹性蛋白、原纤蛋白、纤连蛋白、层粘连蛋白和基质金属蛋白酶维持结缔组织稳态,异常的成纤维细胞活化和分化为肌成纤维细胞导致胶原蛋白及其它细胞外基质过度沉积及和病理性纤维化[14]。我们原代分离小鼠心耳成纤维细胞,并使用我们课题组自行研制的可以提供和维持一定压力的装置(专利号:ZL 2014 20109263.1),更好地模拟心房高压的病理环境。正常人的左房压力约8-12 mmHg,本研究使用20 mmHg模拟心房内较高压力环境,40 mmHg模拟心房的更高压力环境。
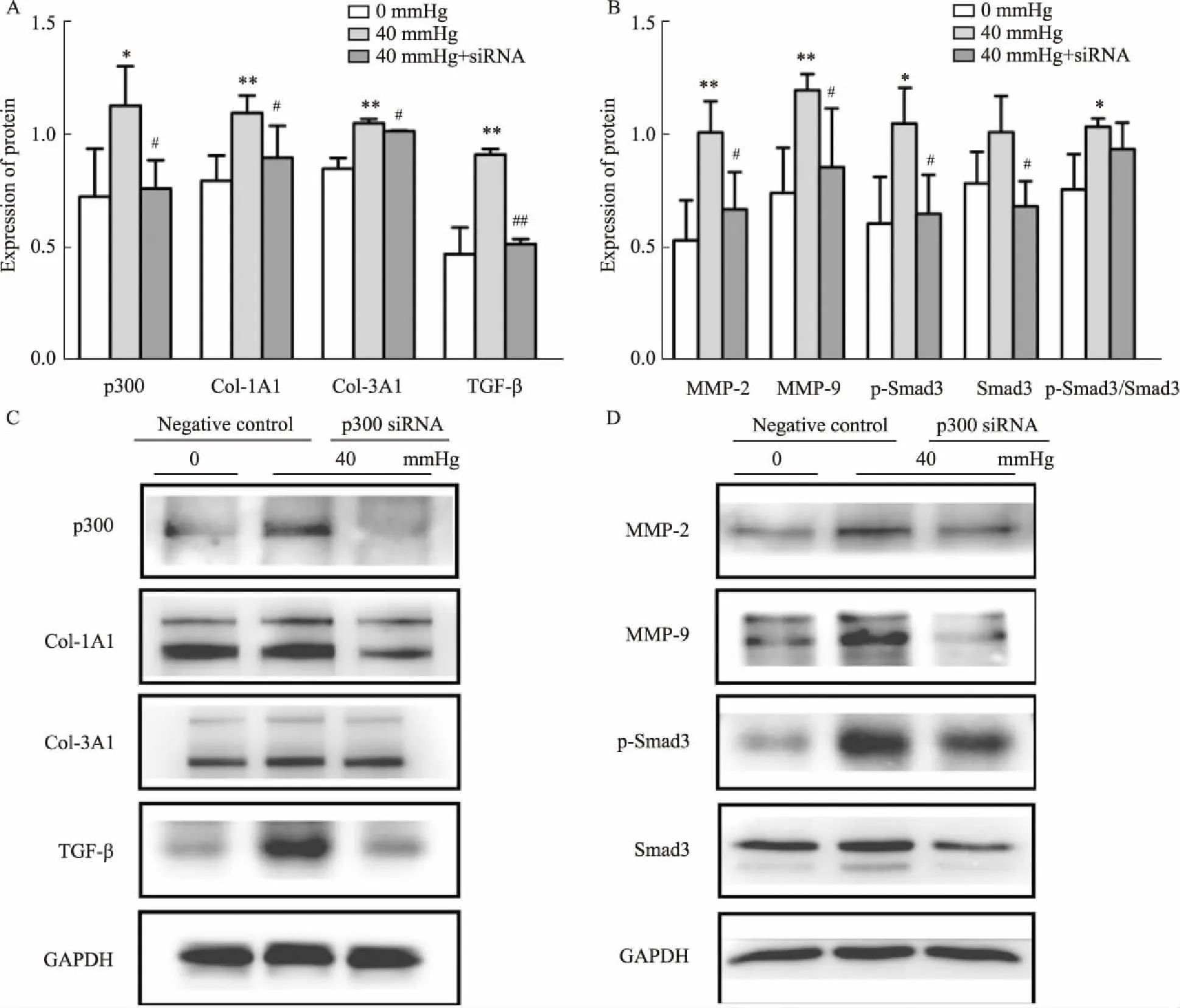
Fig 4 Knockdown of p300 expression reversed increase of fibrotic factors in fibroblasts caused by high hydrostatic pressure

Fig 5 Curcumin reversed proliferation of mouse atrial appendage fibroblasts induced by high hydrostatic pressure
转录辅助激活因子p300具有内在乙酰转移酶活性,但与转录因子不同,p300不直接与DNA结合,通过乙酰化组蛋白和非组蛋白包括转录因子来调控转录[6]。p300在表观基因调控中起的作用主要是通过乙酰化组蛋白实现的,HAT结构域通过乙酰化组蛋白,组蛋白H2A-H2B二聚体从核小体移至组蛋白伴侣,松弛染色质结构,促进DNA与转录因子结合[15]。有研究表明,在正常皮肤和肺成纤维细胞中异位表达p300可以增强TGF-β/Smad3通路介导的Col-1A2启动子的活性,而使用HAT缺失的p300转染成纤维细胞对Col-1A2启动子的活性的影响则明显降低[16]。另有研究显示,p300抑制剂L002可抑制HTN所致的心脏和肾脏纤维化,主要机制是通过抑制血管紧张素Ⅱ(angiotensn Ⅱ,AngⅡ)/TGF-β介导的p300上调,进而抑制组蛋白乙酰化和Smad的磷酸化[7]。本研究结果发现在单纯AF和HTN合并AF患者心耳组织以及在高静水压细胞模型中,p300表达升高,同时纤维化蛋白表达也升高,提示p300在高静水压诱导的心房纤维化中发挥重要作用。
姜黄素是从姜黄中提取的黄色结晶物质,具有抗氧化、抗炎、抗病毒、抗真菌、抗细菌和抗癌等多种功效。从姜黄中分离的主要有姜黄素,去甲氧基姜黄素(demethoxycurcumin,DMC)和双去甲氧基姜黄素(bisdemethoxycuecumin,BDMC)3种姜黄素类似物,3种姜黄素均有相似的p300 HAT特异性抑制作用。有研究发现,用姜黄素或姜黄素类似物DMC和BDMC预处理原代乳大鼠心肌细胞,可抑制去氧肾上腺素诱导的心肌肥大[17]。姜黄素作为p300 HAT特异性抑制剂,可以通过抑制p300乙酰化酶活性调节纤维化相关因子表达,其作为食用色素广泛用于食品工业。在本研究中,姜黄素预处理小鼠心耳成纤维细胞后置于40 mmHg静水压下培养,结果显示姜黄素抑制了成纤维细胞中p300蛋白的表达,同时纤维化相关因子表达也下降,且高浓度姜黄素处理组p300和纤维化相关因子的表达下降更加明显。本研究进一步验证了p300在高静水压诱导的心房纤维化中发挥重要作用。姜黄素为p300 HAT特异性抑制剂,但其作用广泛,为了进一步明确p300在高静水压中对心房纤维化的特异性作用,本研究使用p300 siRNA特异性敲低p300的表达,发现结果与姜黄素处理一致,在p300表达被敲低后,纤维化相关因子表达也下降,进一步验证了p300在加压条件下对纤维化相关因子表达的调控作用。
本研究还对p300参与高静水压致心房纤维化的可能分子机制进行了初步的研究。TGF-β/Smad3信号通路是纤维化的经典通路,TGF-β是公认的纤维化相关蛋白,TGF-β通过与转化生长因子受体II相互作用,招募并磷酸化转化生长因子受体I,磷酸化Smad3蛋白,p-Smad3是Smad3蛋白的活化形式,与Smad4结合后入核,调控包括纤维化相关蛋白基因在内的目标基因转录,而未磷酸化的Smad3则在胞浆内以非活化形式存在[18]。因此p-Smad3蛋白表达水平的高低和p-Smad3与Smad3的比值是反映TGF-β/Smad3信号通路的激活强度重要标志。本研究结果显示,单纯AF和HTN合并AF患者组织和高静水压细胞模型的TGF-β/Smad3信号通路被激活,其相关蛋白TGF-β、p-Smad3和未活化的Smad3蛋白表达均升高,p-Smad3/Smad3的比值同时也有升高的趋势。这提示p300在高静水压诱发心房纤维化中发挥作用可能与TGF-β/Smad3信号通路有关。在高静水压细胞模型中加入姜黄素后,TGF-β、p-Smad3和Smad3蛋白表达降低,同时p-Smad3/Smad3的比值降低。进一步使用p300 siRNA敲低p300的表达后,TGF-β、p-Smad3和Smad3蛋白表达降低,p-Smad3/Smad3的比值亦有降低的趋势。这提示,p300通过调控TGF-β/Smad3信号通路参与了高静水压所致的心房纤维化。
综上,本研究在人组织中验证了HTN可促p300和纤维化相关因子的分泌增加。在细胞层面建立了小鼠心耳成纤维细胞高静水压模型,验证了成纤维细胞在加压条件下p300和纤维化相关因子的分泌增加和增殖活力增加,同时验证了p300对细胞增殖和纤维化因子分泌的调控作用及可能机制。本研究拓展了我们对HTN诱发心房纤维化的机制的认识,证实在高静水压条件下p300可以调控纤维化相关因子,有望成为预防和治疗心房纤维化的新靶点。

