基于活性氧/硫氧还蛋白结合蛋白通路探讨紫草素对布鲁氏菌感染小鼠的保护作用Δ
贾永利,杨新明,张培楠,孟宪勇,胡长波
(河北北方学院附属第一医院骨外科,河北 张家口 075000)
布鲁氏菌病是一种常见的人畜共患病,因布鲁氏菌感染引起。布鲁氏菌为革兰阴性胞内寄生菌,主要有消化道、呼吸道及皮肤接触等多种感染途径,可导致动物不育、流产,严重降低畜牧业经济效益,并可造成患者心、肝、脑及泌尿等全身器官和或(系统)病变,导致盗汗、浑身无力和发热,极大威胁人们的生命健康[1-3]。布鲁氏菌能引发人类机体严重的免疫炎症反应,细胞免疫及体液免疫均参与其中,布鲁氏菌感染机体后,可激活免疫细胞,促使其合成分泌炎症因子,引发炎症;还可诱导机体免疫系统生成免疫球蛋白G(IgG)、免疫球蛋白M(IgM),形成免疫复合物,进一步激发免疫效应,促使炎症进展[4-6]。免疫炎症反应是机体受到外界刺激时发生的复杂病理过程,活性氧(ROS)/硫氧还蛋白结合蛋白(TXNIP)通路是参与介导该过程的主要信号,减少ROS的产生,可下调TXNIP表达,抑制炎症反应,预防细菌感染引起的急性肺损伤,因此,抑制ROS/TXNIP通路可作为布鲁氏菌病的潜在治疗手段[7]。紫草素是提取自紫草的天然活性成分,具有良好的抗菌、消炎作用,能显著抑制金黄色葡萄球菌、大肠埃希菌及白色念珠菌等多种常见菌的生长,并可减少炎症因子释放,减轻炎症损伤,缓解脂多糖诱导的小鼠肺损伤[8-9]。因此,推测紫草素对布鲁氏菌病也可能有较好的治疗作用。本研究基于ROS/TXNIP通路对紫草素保护布鲁氏菌感染小鼠的作用进行探讨,现报告如下。
1 材料与方法
1.1 材料
1.1.1 仪器:Multiskan FC型酶标仪购自上海腾名生物科技有限公司;Mini-PROTEAN Tetra型蛋白电泳仪、Trans-Blot Turb型蛋白快速转膜仪购自美国Bio-Rad公司;TD-4M型低温高速离心机购自济南来宝医疗器械有限公司;GenoSens 2000 Touch型系列凝胶成像系统购自上海勤翔科学仪器有限公司。
1.1.2 实验细菌:布鲁氏菌购自美国菌种保藏中心,批号25840。
1.1.3 药品与试剂:紫草素(原料药,纯度≥98%)购自上海乔羽生物科技有限公司,批号为QY-0022;布鲁氏菌液体培养基、选择性培养基购自青岛海博生物技术有限公司,批号为HB7027、HB0315-1;ROS抑制剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)(批号为ab143032)、小鼠IgG酶联免疫吸附试剂盒(批号为ab151276)、小鼠IgM酶联免疫吸附试剂盒(批号为ab215085)、小鼠γ干扰素(IFN-γ)酶联免疫吸附试剂盒(批号为ab100689)、小鼠肿瘤坏死因子α(TNF-α)酶联免疫吸附试剂盒(批号为ab100713)、小鼠白细胞介素6(IL-6)酶联免疫吸附试剂盒(批号为ab222274)、兔源GAPDH一抗(批号为ab9485)、兔源TXNIP一抗(批号为ab263899)及羊抗鼠二抗(批号为ab188865)购自美国Abcam公司;ROS测定试剂盒购自上海雅吉生物科技有限公司,批号为E004;全血总蛋白提取试剂盒购自上海贝博生物试剂公司,批号为BB-31967-1;BCA试剂盒、化学发光试剂购自上海经科化学科技有限公司,批号为JK-201、JK-305;RIPA裂解液购自上海碧云天公司,批号为P0013K。
1.1.4 实验动物:SPF级BALB/C小鼠购于河北省实验动物中心,雌雄不限,10周龄,体重22~26 g,动物生产许可证号为SCXK(冀)2019-0001,动物使用许可证号为SYXK(冀)2019-0009,动物质量合格证号为LD501134。在河北北方学院附属第一医院动物实验室中饲养,室内温度约25 ℃、相对湿度约50%,保持安静,良好通风。
1.2 方法
1.2.1 小鼠模型的建立及分组处理:将BALB/C小鼠随机分为对照组、模型组、紫草素组(50 mg/kg)、NAC组(ROS抑制剂NAC 20 mg/kg)、紫草素+NAC组(紫草素50 mg/kg+ROS抑制剂NAC 20 mg/kg),每组16只。除对照组外,其余组构建布鲁氏菌感染小鼠模型。参照文献[10]操作,将布鲁氏菌菌种涂布接种在布鲁氏菌选择培养基上培养,72 h后挑取单个、光滑的菌落,接种在液体培养基中,继续培养72 h,吸取菌液1 ml,以12 000 r/min离心后以PBS缓冲液漂洗布鲁氏菌沉淀,以PBS缓冲液重悬,采用麦氏比浊法计数,并稀释菌液为5.0×106CFU/ml,每只小鼠腹腔注射该菌液200 μl建立感染小鼠模型,对照组16只小鼠腹腔注射PBS缓冲液200 μl。以0.9%氯化钠溶液溶解紫草素和NAC,分别制备成5 mg/ml的紫草素溶液[11]、2 mg/ml的NAC溶液[12]、紫草素和NAC的混合溶液(紫草素、NAC质量浓度分别为5、2 mg/ml),紫草素组、NAC组和紫草素+NAC组小鼠每日以10 ml/kg剂量的相应溶液灌胃,模型组和对照组小鼠每日以相同剂量的0.9%氯化钠溶液灌胃,均每日灌胃1次,共进行14 d。
1.2.2 标本采集及小鼠肝脾指数测定:末次灌胃给药24 h后,称量五组小鼠体重后,脱颈处死,从腹主动脉取血5 ml,其中每组8只小鼠的血液于4 ℃下,以3 000 r/min离心15 min,吸取上清液置于Ep管中;剩余8只小鼠的血液,取2 ml进行ROS水平检测;剩余3 ml以全血总蛋白提取试剂盒提取总蛋白后,采用BCA试剂盒测量其浓度(步骤按照各自试剂盒说明书进行),血清与血中总蛋白均放置于-80 ℃储存,以备后续实验使用。取血后,每组随机选择8只小鼠取出肝脏和脾脏,称其重量,计算肝脾指数,脏器指数=脏器湿重/体重×100%;剩余8只小鼠吸取腹腔积液1 ml,称重后,然后取脾脏组织1 g,加入RIPA裂解液2 ml,匀浆后,以3 000 r/min离心,取上清液,和腹腔积液一起置于4 ℃储存备用。
1.2.3 小鼠腹腔积液、脾脏载菌量测定:取“1.2.2”项下腹腔积液和脾脏组织样品液各10 μl涂布接种在布鲁氏菌选择培养基上培养,72 h后观察菌落形成情况,进行细菌计数,载菌量以CFU/g表示。
1.2.4 血清IFN-γ、IL-6、TNF-α、IgG及IgM水平测定:取“1.2.2”项下血清,4 ℃下解冻,以酶联免疫吸附法按照试剂盒的操作步骤测定血清IFN-γ、IL-6、TNF-α、IgG及IgM水平。
1.2.5 血液中ROS水平、TXNIP蛋白水平检测:使用ROS测定试剂盒测量“1.2.2”项下全血ROS水平,具体步骤按照试剂盒说明书进行。取出血液蛋白样品液,各样本分别取20 μl,110 V恒定电压下电泳,然后以同样电压湿转,将分离蛋白转印至聚偏二氟乙烯膜上,采用5%浓度的脱脂奶粉室温孵育2 h,行封闭处理,以稀释比为1∶2 000的兔源TXNIP、GAPDH一抗溶液于4 ℃下孵育过夜,以TBST缓冲液漂洗3次,加入稀释比为1∶5 000的羊抗鼠二抗溶液室温孵育2 h,以TBST缓冲液漂洗3次,使用化学发光试剂使蛋白条带显色,使用凝胶成像仪拍照,最终以Quantity One软件分析图像,得出TXNIP蛋白的相对表达量。
1.3 统计学方法

2 结果
2.1 五组小鼠肝脾指数比较
与对照组比较,模型组小鼠的肝脏和脾脏指数明显升高;与模型组比较,紫草素组、NAC组及紫草素+NAC组小鼠的肝脏和脾脏指数明显降低;与紫草素组及NAC组分别比较,紫草素+NAC组小鼠的肝脏和脾脏指数均明显降低,上述差异均有统计学意义(P<0.05),见表1。
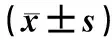
表1 五组小鼠肝脾指数比较Tab 1 Comparison of liver and spleen indicators of
2.2 五组小鼠腹腔积液载菌量比较
与对照组比较,模型组小鼠腹腔积液载菌量明显升高;与模型组比较,紫草素组、NAC组及紫草素+NAC组小鼠腹腔积液载菌量明显降低;与紫草素组及NAC组分别比较,紫草素+NAC组小鼠腹腔积液载菌量均明显降低,上述差异均有统计学意义(P<0.05)。见表2。

表2 五组小鼠腹腔积液载菌量比较Tab 2 Comparison of bacterial load in peritoneal effusion of mice among 5 group
2.3 五组小鼠脾脏载菌量比较
与对照组比较,模型组小鼠脾脏载菌量明显升高;与模型组比较,紫草素组、NAC组及紫草素+NAC组小鼠脾脏载菌量明显降低;与紫草素组及NAC组分别比较,紫草素+NAC组小鼠脾脏载菌量均明显降低,上述差异均有统计学意义(P<0.05),见表3。

表3 五组小鼠脾脏载菌量比较Tab 3 Comparison of bacterial load in spleen of mice
2.4 五组小鼠血清IFN-γ、IL-6及TNF-α水平比较
与对照组比较,模型组小鼠血清IFN-γ、IL-6、TNF-α水平明显升高;与模型组比较,紫草素组、NAC组及紫草素+NAC组小鼠血清IFN-γ、IL-6及TNF-α水平明显降低;与紫草素组及NAC组分别比较,紫草素+NAC组小鼠血清IFN-γ、IL-6、TNF-α水平均明显降低,上述差异均有统计学意义(P<0.05),见表4。
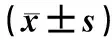
表4 五组小鼠血清IFN-γ、IL-6及TNF-α水平比较Tab 4 Comparison of serum IFN-γ, IL-6 and TNF-α levels of mice among 5 group
2.5 五组小鼠血清IgG、IgM水平比较
与对照组比较,模型组小鼠血清IgG、IgM水平明显升高;与模型组比较,紫草素组、NAC组及紫草素+NAC组小鼠血清IgG、IgM水平明显降低;与紫草素组及NAC组分别比较,紫草素+NAC组小鼠血清IgG、IgM水平均明显降低,差异均有统计学意义(P<0.05)。见表5。

表5 五组小鼠血清IgG、IgM水平比较Tab 5 Comparison of serum IgG and IgM levels of mice
2.6 五组小鼠血液中ROS水平和TXNIP蛋白表达水平比较
与对照组比较,模型组小鼠血液中ROS水平和TXNIP蛋白表达水平明显升高;与模型组比较,紫草素组、NAC组及紫草素+NAC组小鼠血液中ROS水平和TXNIP蛋白表达水平明显降低;与紫草素组及NAC组分别比较,紫草素+NAC组小鼠血液中ROS水平和TXNIP蛋白表达水平均明显降低,上述差异均有统计学意义(P<0.05),见图1、表6。

A.对照组;B.模型组;C.紫草素组;D.NAC组;E.紫草素+NAC组A. control group; B. model group; C. Shikonin group; D. NAC group; E. Shikonin+NAC group图1 蛋白免疫印迹检测五组小鼠血液中TXNIP蛋白表达Fig 1 Expression of TXNIP protein in blood of mice in 5 groups detected by protein immunoblotting
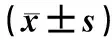
表6 五组小鼠血液中ROS水平和TXNIP蛋白表达水平比较Tab 6 Comparison of ROS level and expression level of TXNIP protein in blood of mice among 5 group
3 讨论
本研究通过腹腔注射布鲁氏菌菌液制备布鲁氏菌感染小鼠模型,结果显示,感染小鼠的肝脏指数、脾脏指数、腹腔积液载菌量及脾脏载菌量显著升高,血清IFN-γ、IL-6、TNF-α、IgG和IgM水平显著升高,表明布鲁氏菌在小鼠体内生长,并引发免疫炎症反应,造成肝脾肿大受损,说明模型建立成功。
紫草素为天然药物紫草的主要活性成分,具有抑菌、抗炎、抗肿瘤和抗病毒等多种药理作用,可破坏细菌细胞膜完整性,抑制白色念珠菌、大肠埃希菌和蜡状芽孢杆菌等多种菌株生长,并可阻止心肌缺血再灌注引发的炎症发生,降低机体氧化应激水平,减轻心肌梗死小鼠的心肌损伤[11,13-14]。由此推测,紫草素也可能抑制布鲁氏菌生长,并通过减轻炎症改善布鲁氏菌病的临床症状。本研究以紫草素灌胃布鲁氏菌感染模型小鼠,结果显示,紫草素可降低布鲁氏菌感染小鼠的肝脏指数、脾脏指数、腹腔积液载菌量和脾脏载菌量,降低布鲁氏菌感染小鼠血清IFN-γ、IL-6、TNF-α、IgG和IgM水平,表明紫草素可抑制布鲁氏菌在小鼠体内生长繁殖,降低炎症因子及抗体水平,减轻细胞和体液免疫应答,抑制炎症发生及进展,缓解肝脾器官损伤。
ROS/TXNIP通路是机体中调控炎症反应的重要信号通路,机体受到细菌感染、缺血及缺氧等外界刺激时,ROS大量产生,促进TXNIP表达,诱导下游NOD样受体蛋白3炎症信号激活,导致炎症发生;NAC是ROS清除剂,可降低ROS水平,下调TXNIP蛋白表达,进而抑制炎症反应发生及进展[15-17]。因此,ROS/TXNIP可作为布鲁氏菌病的潜在治疗靶点。本研究结果显示,小鼠感染布鲁氏菌后,体内ROS/TXNIP处于激活状态,而紫草素可下调ROS水平和TXNIP蛋白表达水平,表明ROS/TXNIP通路参与调控布鲁氏菌感染的病理过程,下调该通路蛋白表达,可减轻感染小鼠的临床症状;NAC与紫草素作用相似,均可抑制ROS/TXNIP激活,减轻炎症,降低小鼠肝脾损伤;进一步研究结果显示,紫草素及NAC联合应用,可进一步降低布鲁氏菌感染小鼠的肝脏指数、脾脏指数、腹腔积液载菌量和脾脏载菌量,降低血清IFN-γ、IL-6、TNF-α、IgG和IgM水平,降低血液中ROS水平、TXNIP蛋白表达水平,相比紫草素、NAC单独处理,作用更强,表明两者联合应用具有协同作用,可更有效地抑制小鼠体内布鲁氏菌繁殖生长,减少炎症因子及抗体合成分泌,抑制细胞和体液免疫应答,减轻炎症,改善小鼠症状。
综上所述,紫草素具有明显的抗布鲁氏菌作用,可抑制布鲁氏菌在动物体内生长,减轻机体免疫应答,抑制炎症反应,缓解肝脾器官损伤,改善细菌感染症状,为布鲁氏菌病的临床治疗提供了新的思路,抑制ROS/TXNIP通路激活可能是其药理机制之一。但本研究还未使用该通路激动剂进行对照验证,需后续深入研究,改善其不足。

