生长抑素及短期埃索美拉唑对胃癌炎症因子、胃蛋白酶、胃泌素-17的影响
彭 洋
天津市职业病防治院中西医结合科 300011
由于人们生活习惯的改变,饮食不规律,生活压力过大,胃癌的发病率逐年上升。据国家癌症中心2015年相关数据显示,胃癌发病率仅次于肺癌,居恶性肿瘤发病率居第二位。80%的新病例在诊断时已发展到进展期[1]。与日韩早期胃癌诊断率较高、欧美胃癌发病率较低相比,我国在胃癌防治方面仍面临非常严峻的形势[2]。我国胃癌诊治水平参差不齐,进一步加大了胃癌的治疗难度。早期胃癌仍然可以通过内镜下全切除术治愈,但晚期胃癌很难治愈。晚期胃癌的治疗主要包括手术、化疗和放疗[3]。化疗虽然能明显抑制胃癌相关症状,延长患者生存时间,但也面临着耐药性、药物毒性和经济负担等一系列问题[4]。然而,胃癌对顺铂、5-FU、长春花碱等抗癌药物的耐药是胃癌非手术治疗的主要障碍。因此,提高肿瘤细胞的化疗敏感性,降低肿瘤细胞的多药耐药已成为治疗不能手术的晚期胃癌的关键,寻找一种疗效好、安全性高、抗肿瘤耐药、成本低的化疗药物尤为重要。因此本文以我院2016年12月—2020年12月共收治的100例胃癌患者作为观察对象,探讨生长抑素及短期埃索美拉唑对胃癌炎症因子、胃蛋白酶、胃泌素-17的影响,具体报道如下。
1 资料与方法
1.1 一般资料 选取我院2016年12月—2020年12月收治的100例胃癌患者进行分析,将其随机分为实验组和对照组,两组一般资料对比无明显差异(P>0.05),见表1。

表1 两组患者一般资料对比
1.2 选择标准 纳入标准:经胃镜检查及组织病理学确诊为胃癌,接受紫杉醇、氟尿嘧啶等常规化疗药物治疗[5];身体状况及血液检查均能耐受化疗;研究经医院伦理委员会批准,患者签字同意。排除标准:胃癌远端转移,不能进行根治性手术;合并其他严重恶性肿瘤;合并心、肝、肾等器官疾病;合并感染性或代谢性疾病;有慢性营养不良史。
1.3 方法 对照组给予禁食、胃肠减压、维持水电解质平衡、营养支持、抑制胰腺分泌等综合治疗。在此基础上,实验组加入生长抑素和埃索美拉唑,生长抑素(生产厂家:北京双鹭制药有限公司,国药准字:H20054016,规格:3mg)3mg溶于48ml生理盐水中,然后用微量泵以4ml/h(0.25mg/h)的速度泵送,1次/d;注射用埃索美拉唑(生产厂家:阿斯利康制药有限公司,国药准字:H20093314,规格:40mg)40mg溶于100ml生理盐水中,静脉滴注,2次/d。两组均持续治疗7d。
1.4 观察指标 (1)炎症指标:C-反应蛋白(CRP)、降钙素原(PCT)、白细胞计数(WBC);(2)胃蛋白酶(PG)、胃泌素-17(G-17)指标:电化学发光法测定血清G-17水平;乳胶免疫比浊法测定血清PG水平。
1.5 疗效评价标准 根据实体瘤评价标准,当治疗后靶点消失且无新病灶出现时,定义CR(完全缓解),肿瘤标志物水平正常,维持时间4周以上;治疗后靶点最大直径及缩小量>30%,PR(部分缓解)持续时间>4周;SD(稳定)为治疗后部分缓解和进展之间的目标病变;PD(进展)为最大直径和增加超过20%的患者或治疗后新病变[6]。临床总有效率为CR+PR,疾病控制率为CR+PR+SD。

2 结果
2.1 两组患者炎症因子指标对比 治疗前两组患者CRP、WBC以及PCT水平比较,无明显差异(P>0.05);治疗7d后,实验组的CRP、WBC以及PCT水平均显著低于对照组(P<0.05)。见表2。

表2 两组患者炎症因子指标对比
2.2 两组患者胃蛋白酶和胃泌素-17指标对比 治疗前两组患者的PGR、PGⅠ、PGⅡ与G-17对比无显著差异(P>0.05);治疗7d后,实验组的PGR、PGⅠ明显高于对照组,G-17明显低于对照组(P<0.05),而两组PGⅡ比较差异无统计学意义(P>0.05)。见表3。

表3 两组患者胃蛋白酶和胃泌素-17指标对比
2.3 两组患者治疗后临床效果对比 治疗7d后,实验组患者的总有效率为36.0%、疾病控制率为68.0%,均显著高于对照组的18.0%、46.0%(P<0.05)。见表4。
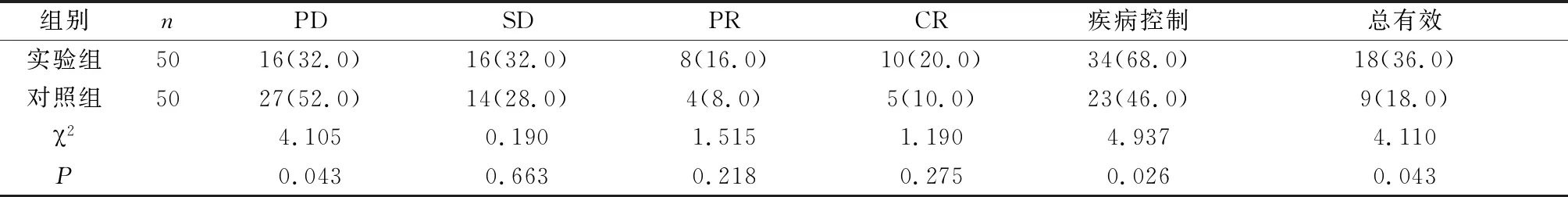
表4 两组患者治疗后临床效果对比[n(%)]
3 讨论
胃癌是一种常见的恶性肿瘤,其发病率和死亡率均居世界前列。胃癌大多是通过胃炎—萎缩—肠化—不典型增生的过程演变而来,其中萎缩、肠化和不典型增生是胃癌的癌前病变[7]。本病早期无明显症状,导致大多数患者发现本病已发展到晚期,无法通过手术治愈[8]。在临床上,胃癌的主要治疗方法是化疗,以延长患者的生命。在临床上,生长抑素和埃索美拉唑都是常用的控制和治疗胃癌的药物,但两者联合应用的研究较少。
生长抑素是胰岛D细胞分泌的一种环状多肽激素。主要分布于中枢神经系统和胃肠道,存在于人体各器官,以胃和胰腺含量最高[9]。生长抑素的生物学功能是通过在细胞膜表面结合生长抑素受体来激活信号转导途径。目前主要用于预防腹部手术后炎性肠梗阻的发生。据报道,生长抑素的应用可促进胃癌术后患者的康复。甘涛等[10]在研究中提出联合生长抑素能有效改善胃癌患者的营养状况和预后,同时提供肠内营养支持,但缺乏炎症反应等更多指标。埃索美拉唑作为新一代质子泵抑制剂,是目前已知的最强的质子泵抑制剂。它除了在治疗消化性溃疡、胃食管反流病等方面的应用外,还可能在癌症化疗或化学辅助治疗方面有较大的潜在作用。目前,埃索美拉唑对胃癌细胞的作用及其机制尚不清楚。因此,研究埃索美拉唑对胃癌AGS细胞的作用,进一步了解其可能的机制,为质子泵抑制剂作为胃癌化疗或辅助化疗提供基础理论依据。
本文结果表明,治疗7d后,实验组CRP、WBC及PCT均低于对照组(P<0.05),表明生长抑素有双向免疫调节作用,能同时抑制抗炎细胞因子及炎性细胞因子活性,促使机体的抗炎症反应及炎症反应维持在低水平平衡状态,埃索美拉唑可呈浓度依赖性地显著抑制胃癌AGS细胞增殖,并对相关炎症因子也有很好的效果;治疗7d后,实验组PGR、PGⅠ高于对照组,G-17明显低于对照组(P<0.05)。生长抑素联合短期埃索美拉唑治疗胃癌患者的过程中,G-17是一种主要由胃窦和十二指肠G细胞分泌的胃肠激素,是胃窦萎缩的血清学标志物。胃癌患者G-17水平明显升高,其可作为胃癌早期诊断的一个指标。实验组总有效率、疾病控制率均高于对照组(P<0.05)。生长抑素能降低门静脉血流量,且对全身血流动力学无影响,止血成功率较高,毒副作用较少。埃索美拉唑为奥美拉唑单一异构体,其生物利用度、药代动力高于奥美拉唑。埃索美拉唑作为新型质子泵抑制剂,作用于人体胃壁细胞,可减少胃酸分泌,维持胃酸pH值,进而减弱攻击因子作用力,改善胃黏膜血流供给,加强胃黏膜防御力,并提升了胃癌患者的总有效率与疾病控制率。
总而言之,生长抑素联合短期埃索美拉唑治疗与控制胃癌效果显著,能够提升患者炎症因子、胃蛋白酶以及胃泌素-17相关指标情况,值得临床应用推广。

