三黄凝胶对大鼠耳廓痤疮模型核因子-κB和白细胞介素-37的影响
牛凡琪,郭斐斐,牛凡红,刘婧,王思农
(甘肃中医药大学,甘肃 兰州 730000)
痤疮是临床上的常见病[1]之一,发病机制复杂,研究认为痤疮丙酸杆菌高度表达而诱发炎性反应[2]。一方面,核因子(NF)-κB 信号通路[3]的表达被激活或是抑制已成为炎性反应发生不同进展的重要因素;另一方面,抗炎细胞因子白细胞介素(IL)-37[4]通过高水平表达抑制炎性反应[5],在炎性反应中起着不可替代的作用。本研究以酶联免疫吸附测定(ELISA)法检测外用三黄凝胶的大鼠耳廓痤疮模型中NF-κB和抗炎细胞因子IL-37活性表达情况,探讨三黄凝胶治疗痤疮的机制[6]。
1 材料与方法
1.1 材料
1.1.1 实验动物 甘肃中医药大学实验动物中心提供的SPF级Wistar大鼠60只,人工喂养6~8周,体质量(200±20)g,雌性∶雄性=1∶1。实验动物许可证号:SCXK(甘)2015-001。
1.1.2 药物和试剂 甘肃中医药大学附属医院提供三黄凝胶(含3.6 g生药/10 g)作为治疗组的药物。对照组的药物:重庆华邦制药股份有限公司提供0.025%维A酸乳膏(批次:H50021817);天津市富宇精细化工有限公司提供100%油酸(批次:101212);上海中乔新舟生物科技有限公司提供大鼠血清NF-κB试剂盒(批次:EK0531)和大鼠血清IL-37试剂盒(批次:EK0837)。
1.2 方法
1.2.1 造模方法 选择60只Wistar健康大鼠,采用随机抽样法分6组:空白组和模型组、阳性对照组以及三黄凝胶低浓度组、中浓度组、高浓度组,每组10只,除空白组,其余组建立大鼠耳廓复合痤疮模型[7],即在各组大鼠的右侧耳廓开口处均匀外抹100%油酸,0.5 mL/次,1次/d,给药 3 周,采用随机抽样法从模型组选择2只大鼠,在无菌实验室将大鼠的耳朵剪下,使用HE染色法处理皮损组织,观察病理。光镜下观察到:增厚严重的角质层,扩张的毛囊和过度角化,并且角化皮损见于毛囊口、漏斗部,以及堵塞的角栓塞,壶状似的扩大和消失的皮脂腺,然后参照痤疮组织学判定(实验性)分级标准[8]:毛囊漏斗部无粉刺(-);少量的密集角化皮损见于毛囊漏斗部(+);中等量的角化皮损见于毛囊漏斗部,延伸至皮脂腺(2+);广泛角化皮损(和人的开放性痤疮皮损类似)见于扩张毛囊内(3+)。(+)~(3+)提示大鼠耳廓的痤疮模型已形成。
1.2.2 动物分组、给药 在造模完成后,开始涂抹药物。使用人和大鼠之间换算公式计算用药剂量。给大鼠的用药剂量为:0.025%维A酸乳膏给予阳性对照组[5 g/(kg·d)](和换算公式计算结果一致);给药[0.08 g生药/(kg·d)](换算公式计算结果的2倍)于三黄凝胶高浓度组;给药[0.04 g生药/(kg·d)](和换算公式计算结果一致)于三黄凝胶中浓度组;给药[0.02 g生药/(kg·d)](换算公式计算结果的1/2倍)于三黄凝胶低浓度组。在大鼠的右耳廓造模处给药,1次/d,给药4周,于空白组和模型组不给药。
1.3 肉眼、组织病理学观察 每天观察、记录每组大鼠耳处造模以及用药治疗后的皮肤症状,最后一次外用药24 h后,在无菌实验室使用工具剪掉所有组的鼠耳,HE染色处理后,可以通过光镜来观察组织病理学变化。
1.4 NF-κB和抗炎细胞因子IL-37活性表达水平的检测 在给药结束后经过24 h,采集所有大鼠心脏血,通过离心、分离技术处理血清(放置-80℃环境下,使用ELISA法检测NF-κB和抗炎细胞因子IL-37活性表达水平。)
1.5 统计学分析 通过SPSS 25.0统计软件对实验数据进行处理、分析,均数±标准差表示定量资料,单因素方差分析比较组间均数,差异有统计学意义(P<0.05)。
2 结果
2.1 观察造模前后皮损情况 见图1。
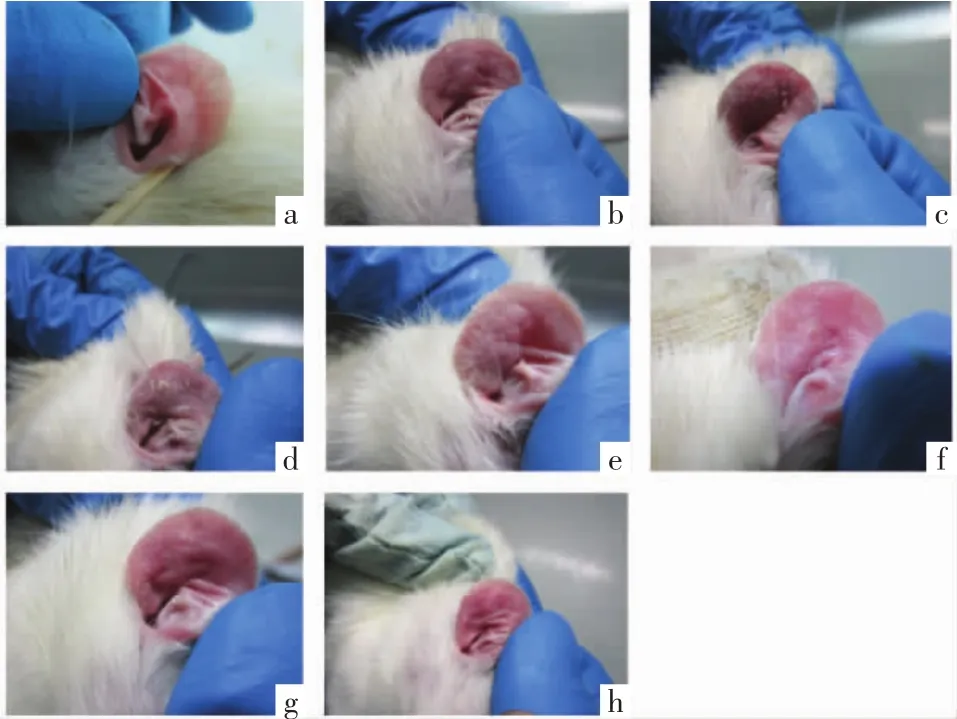
图1 使用药物治疗后的4组和未使用药物的2组鼠耳皮肤
空白组:鼠耳部皮肤未发生明显改变,与正常组织基本一致;颜色粉红,质地很柔软,毛细血管清晰可见。大鼠的内耳开口处:皮肤平滑,未见角化物质和粉刺、红肿。
模型组:观察1周,大鼠耳部颜色微微变红,可见许多扩张的毛细血管,变硬、增厚的表皮。观察2周,鼠耳皮肤变红肿,皮温比空白组稍高,鼠耳表皮粗糙、增厚,有脱屑、结痂现象。第3周,耳部皮肤比第2周红肿更甚,皮温也升高明显,质地干燥、粗糙,表皮也增厚显著,脱屑和结痂的情况有所加重,可见隆起的丘疹。
2.2 治疗后大鼠耳的皮损变化情况 使用药物治疗1周后,各治疗组的鼠耳皮肤:小范围的症状逐渐好转,颜色略红,柔软质地,薄薄的表皮,结痂掉落,皮肤触之无灼热感。在给药3周后,观察三黄凝胶高浓度组的大鼠耳廓情况:局部触之柔软和光滑,颜色正常、表皮皮温正常,没有肿胀、脱屑、结痂。观察三黄凝胶的低浓度组、中浓度组、阳性对照组,和模型组相比:皮损症状有了明显的改善。肉眼观察模型组,皮损没有明显的好转;空白组没有明显的变化。
2.3 观察组织、病理情况 见图2。
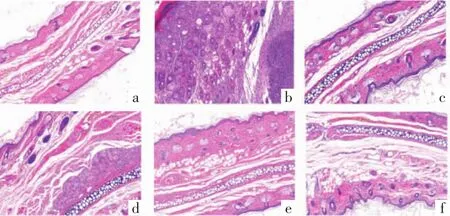
图2 染色处理后的鼠耳病理(HE染色×100)
空白组:大鼠耳部的表皮层:厚薄适中,可清晰看见毛囊和真皮以及表皮界限,还可见真皮层有炎性细胞存在,其他没有明显变化。
模型组:在造模完成后,增厚的角质层和纤维组织、过度的角化、粗大的毛囊。广泛角化物质见于毛囊口、漏斗部;同时观察到:角栓塞形成、像壶状样扩大、皮脂腺的消失,并且可见炎性细胞的浸润,和血管增厚的纤维组织。
阳性对照组:和模型组相比:可见变薄的纤维层,以及浸润的炎性细胞、血管数量大幅度降低。
三黄凝胶组:与模型组对比,当药物浓度不断增加的情况下,存在角质层、纤维组织厚度渐渐变薄的现象,还有炎性细胞和血管数量同时减少。
2.4 对比各组的鼠耳廓痤疮模型与空白组的NF-κB和IL-37活性表达情况
2.4.1 NF-κB在模型组中表达水平升高显著,差异有统计学意义(F=194.650,P<0.05)。对比模型组,在三黄凝胶低浓度、中浓度、高浓度组和阳性对照组中,NF-κB活性表达水平都有不同程度的降低,差异有统计学意义(F=194.650,P<0.05)。对比阳性对照组,在三黄凝胶低浓度、中浓度组中NF-κB活性表达水平相差无几,差异无统计学意义(F=194.650,P>0.05)。三黄凝胶高浓度组的NF-κB活性表达水平显著降低,差异有统计学意义(F=194.650,P<0.05)。
2.4.2 对比空白组,IL-37在模型组中表达水平升高显著,差异有统计学意义(F=192.090,P<0.05)。对比模型组,在阳性对照组和三黄凝胶高浓度、中浓度、低浓度组中,IL-37水平都有明显降低,差异有统计学意义(F=192.090,P<0.05)。三黄凝胶中浓度、低浓度组和阳性对照组中IL-37水平相近,差异无统计学意义(F=192.090,P>0.05)。三黄凝胶高浓度组比阳性对照组中IL-37水平降低明显,差异有统计学意义(F=192.090,P<0.05)。
根据数据水平、病理和肉眼观察比较,可以得出:三黄凝胶可以降低大鼠的NF-κB和IL-37活性表达水平,见表1。
表1 对比每组鼠耳粉刺模型NF-κB和IL-37 含量 (pg/mL,±s)
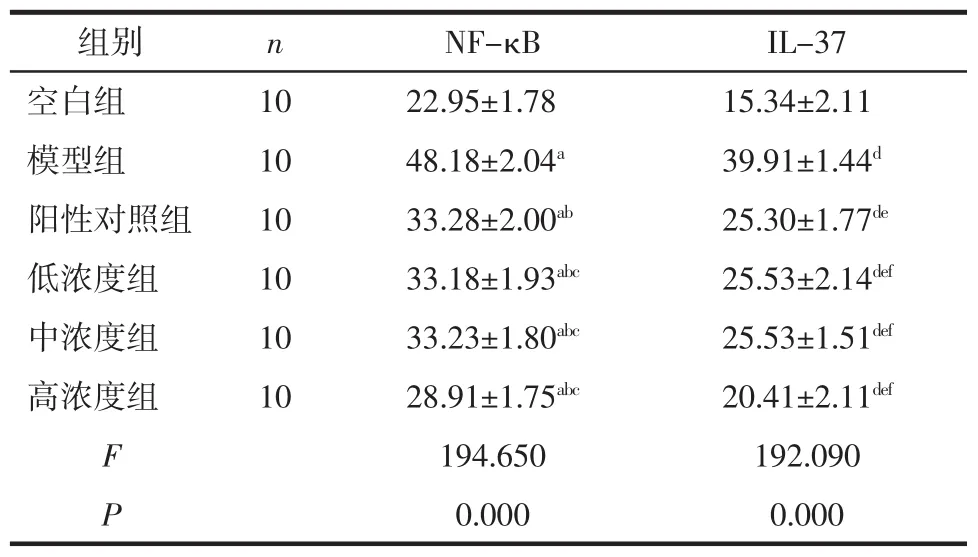
表1 对比每组鼠耳粉刺模型NF-κB和IL-37 含量 (pg/mL,±s)
注:NF-κB 中,a示与空白组比较,P 分别是 0.000、0.000、0.000、0.000、0.000;b示与模型组比较,P 分别是 0.000、0.000、0.000、0.000;c示与阳性对照组比较,P 分别是 0.903、0.951、0.000;IL-37 中,d示与空白组比较,P 分别是 0.000、0.000、0.000、0.000、0.000;e示与模型组比较,P 分别是 0.000、0.000、0.000、0.000;f示与阳性对照组比较,P分别是 0.777、0.782、0.000。
组别 n NF-κB IL-37空白组 10 22.95±1.78 15.34±2.11模型组 10 48.18±2.04a 39.91±1.44d阳性对照组 10 33.28±2.00ab 25.30±1.77de低浓度组 10 33.18±1.93abc 25.53±2.14def中浓度组 10 33.23±1.80abc 25.53±1.51def高浓度组 10 28.91±1.75abc 20.41±2.11def F 194.650 192.090 P 0.000 0.000
3 讨论
痤疮与皮肤的特发性炎性反应密切相关,炎性因子IL-1、IL-6、IL-8的高水平表达可导致瘢痕的形成[9-11]。NF-κB是一种调节多种炎性反应表达的诱导性转录因子[12],是联系炎性反应的关键信号分子。肿瘤坏死因子(TNF)-α、IL-6、IL-8[13]等至少 27种不同炎性反应靶基因可以被NF-κB激活,进而产生大量中性粒细胞浸润、聚积于炎性反应部位,比如一氧化氮炎性效应分子[14]。此外,NF-κB可以刺激IL-1β、TNF-α等细胞因子表达,并且细胞因子还可以刺激NF-κB,进一步使NF-κB活化,让炎性反应持续、放大[15]。同时,IL-37是新发现的抗炎细胞因子,由巨噬细胞刺激炎性细胞因子时产生,抑制炎性细胞因子的激活,在痤疮中起到抑制炎性反应的作用[16]。IL-37在正常情况下呈低水平表达,在痤疮模型中炎性因子的作用下水平迅速升高,发挥作用,抑制炎性反应[17]。IL-37通过降低IL-1α、IL-6、IL-1β、干扰素(IFN)-γ、IL-18、TNF-α 的水平来控制炎性反应的发展[18]。
根据痤疮组织学判定(实验性)分级标准建立大鼠耳廓痤疮模型,当造模的鼠耳廓皮肤、病理学变化与人的痤疮皮损基本一致,则说明了痤疮模型造模的可行性。“三黄膏”常用于治疗痤疮,药物组成:黄连、黄芩、黄柏、凡士林、芝麻油。实验中的三黄凝胶在“三黄膏”基础上结合现代技术进行剂型转变,以原来药物为基础,利用现代制作工艺,以卡波姆940作为基质,另外增加丹参、当归、苦参、白及、冰片、白芷、茯苓和薄荷,将多余的色素脱去,添加(月桂氮酮)促透剂和(三乙醇胺)调节剂制作成三黄凝胶。在多年的临床应用中,观察发现三黄凝胶在治疗中、重度痤疮方面有显著疗效[19],能直达病位,和皮肤耦合的效果也极佳,有吸收药物快、作用时间长、明显改善局部皮损的优点。清热消肿是黄芩、黄柏、黄连(可以减少炎性细胞因子的释放)共同的功效;当归能显著修复皮肤创面,还有抗炎作用,并能降低毛细血管的通透性,使前列腺素E2(PGE2)生成减少,减轻皮肤局部炎性反应[20-21];丹参可以促进组织修复、再生,皮肤局部微循环得到调节,成纤维细胞的生长得到抑制;此外,创伤性炎性反应范围可以被丹参通过免疫调节控制在适宜范围之内,加快修复破坏组织。
此研究证实,大鼠的耳廓痤疮模型中NF-κB和IL-37活性表达水平能够被三黄凝胶显著降低。三黄凝胶的低浓度、中浓度组和阳性对照组的治疗效果基本相同,三黄凝胶的高浓度组比阳性对照组的治疗效果更好。因而推断:三黄凝胶高浓度组通过降低抗炎细胞因子IL-37水平,并抑制NF-κB的活性表达,从而减少了NF与对应炎性反应的靶向基因结合、表达,起到治疗炎性反应的效果。
——护肾

