2020年全球新药研发报告(Ⅰ)
Graul A I, Sorbera L A
( 科睿唯安 )
1 引言
年度新药报告迄今已有33年的历史。2020年度新药报告从历史和研究的角度对过去一年中首次在各国获批上市的148种化学实体、生物制剂及产品拓展进行了介绍。
在本报告涵盖的148种产品中,全球范围内共有70种新分子实体和生物制剂于2020年首次获批上市。此外,有42种重要的新产品拓展(本报告的专用说法,指既往上市药物的新联合用药、新剂型和新适应证)在全球范围内推出。另有27种新产品,包括新型化学药物、生物制剂以及新的产品拓展获批,但无法确认这些产品是否在2020年12月31日前上市。其余9种产品获批用于紧急使用,详见下文。
表1总结了2010—2020期间各疾病领域的上市新药数量。
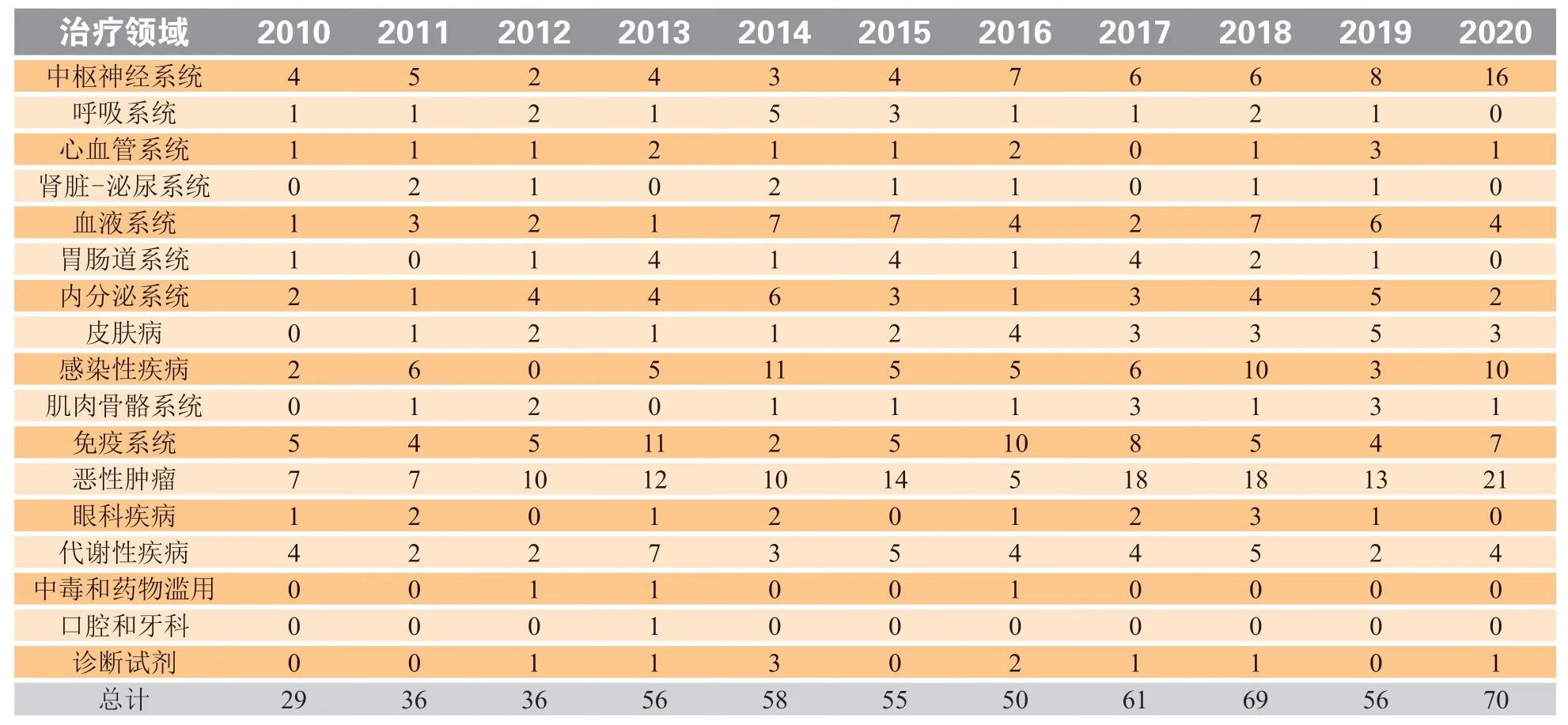
表1 2010—2020期间上市的化学药物和生物制剂(按治疗领域划分)*Table 1 New drugs and biologics by therapeutic category, launched in 2010-2020
新分子药物方面,最活跃的治疗类药物仍为抗肿瘤药物,有21种新产品于2020年首次上市,其次是中枢神经系统药物,有16种。
有9种首创新药于2020年首次上市,包括治疗偏头痛、HIV感染、高胆固醇血症和多种恶性肿瘤的新药。在本报告中,首创新药定义为在任何国家上市、针对任何适应证且具有全新作用机制的首款药物。
美国仍是全球最活跃的新药市场,在美国上市的新药数量占全球新上市产品的54%。美国FDA始终致力于加快新药审评的进程。2017年,美国研究人员发现,2011—2015年期间FDA的药物审评时间比欧洲药品管理局(EMA)平均少60天[1];此后,美国监管机构的审评速度进一步加快。FDA采用快速通道和加速审批的方式使更多新药获批,拒绝的新药数量越来越少,以至于有人指责FDA已成为受监管企业的合作伙伴。日本是2020年第二大活跃的新药市场,有14种新药上市(占全球新上市药物总数的22%)。同样值得注意的是,来自中国本土制药企业的新型化学药物和生物制剂数量持续增加。2020年,全球首次上市的产品中有8个来自中国,占全球总数的12%(见图1)。
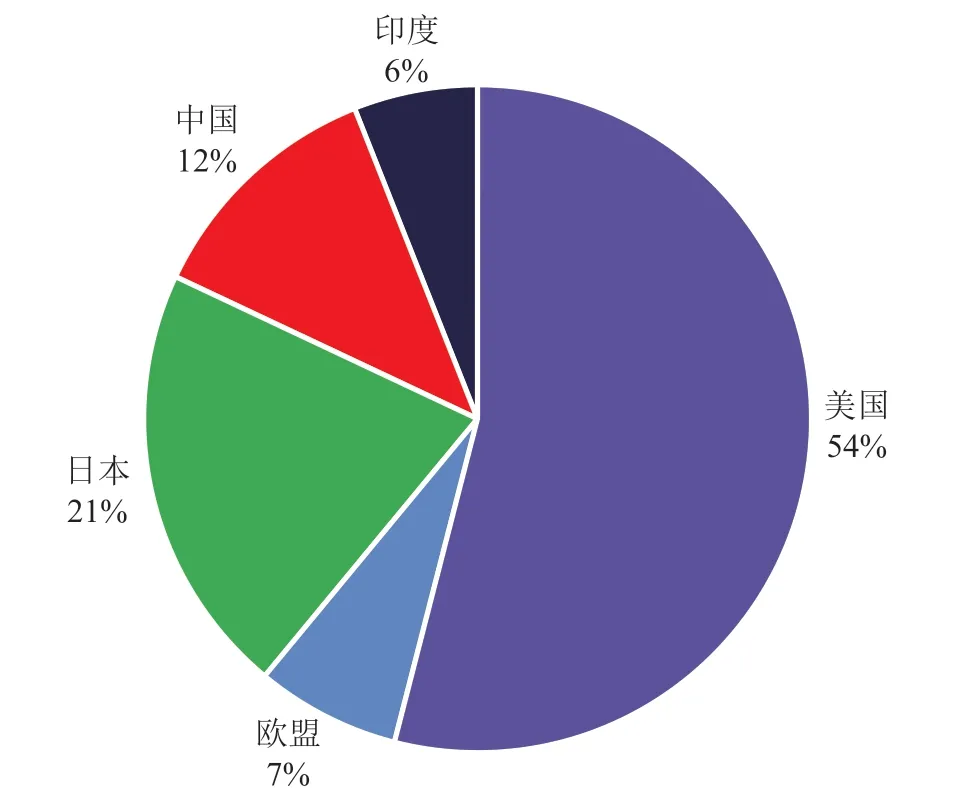
图1 2020年各国上市新药分布情况Figure 1 Distribution of new drug launches by country, 2020
监管机构可加快新药的开发和审评进程(主要为FDA,尽管其他国家也设立了相应的程序),并通过授予更多的特殊资格认证为制药公司提供激励。美国国会授权的第一个此类项目是1983年出台的孤儿药法案,该法案的提出和实施旨在加速罕见病治疗药物的开发。多年来,许多国家纷纷效仿这一由美国开创的孤儿药计划,在本国也设立了类似计划。FDA的“快速通道”资格认定于1988年设立,旨在促进开发治疗严重疾病和填补医疗需求缺口的药物,对此类药物进行加速审评。随后,FDA于1992年通过了处方药申报者付费法案(PDUFA),其中包括“加速审批”和“优先审评”程序,且同时首次正式要求制药公司向监管机构支付审评费用。1997年,PDUFA法案将目标审评时间从1年缩短至10个月。2012年,美国国会增加了“突破性疗法”的资格认定,使得FDA有权对那些疗效相较现有疗法有实质性改善的新药免除正常的审批程序和要求。2012年,FDA在认识到市场对抗细菌和抗真菌感染药物的需求后,设立了合格的感染性疾病产品(QIDP)资格认定计划。美国批准的新药中约有3/4获得了某种类型的加速审评资格[2]。在欧盟,优先审评药物(PRIME)计划的实施现已进入第4个年头,其重点关注的药物为可显著改善现有疗法的疗效或为无药可用的患者带来获益的药物。EMA还实施了“加速评估”计划,加快了对填补医疗需求缺口的药物的审评(从210天缩短至150天)。在日本,“SAKIGAKE”(创新药物)资格认定系统于2015年设立,旨在促进创新药物、器械和再生医学产品的开发。2020年,在Orbis计划启动后仅1年,即有一批新疗法获批上市。Orbis项目是由6个国家(澳大利亚、巴西、加拿大、瑞士、英国和美国)的药品监管机构达成的一项协议,目的是对有治疗前景的新型抗肿瘤药物加速患者可及[3]。
从此类加速审评计划中获益最大的2个治疗领域是抗肿瘤药物和罕见病疗法。《华尔街日报》开展的一项研究发现,2015—2018年间获批的大多数抗肿瘤药物均获得了快速通道资格,其中仅有19%在获批时提供了表明药物可显著延长总生存期的证据[2]。而监管机构要求的获得完全批准所需的上市后研究结果,与加速审评时提供的小样本研究结果并非总是一致,原因是这些小样本研究往往采用的是替代性终点[4]。
总体而言,2020年在全球范围内上市的所有新型化学药物、生物制剂和产品拓展中,约有半数产品在其上市的国家被授予至少1项特殊资格认定。
在针对这个特殊年份所编写的报告中,我们还增加了一个新章节,对用于防治新型冠状病毒肺炎(COVID-19)的重新定位的已上市药物以及已获得EUA的新型化学药物和生物制剂进行了概述。在新冠疫情大流行期间,几乎所有的药物和疫苗均通过EUA或类似途径在相应的国家获批上市。2020年度报告共介绍了9种获得EUA用于防治COVID-19的化学药物和生物制剂,这些药物的信息详见表2,但未列入表1的新上市产品中。
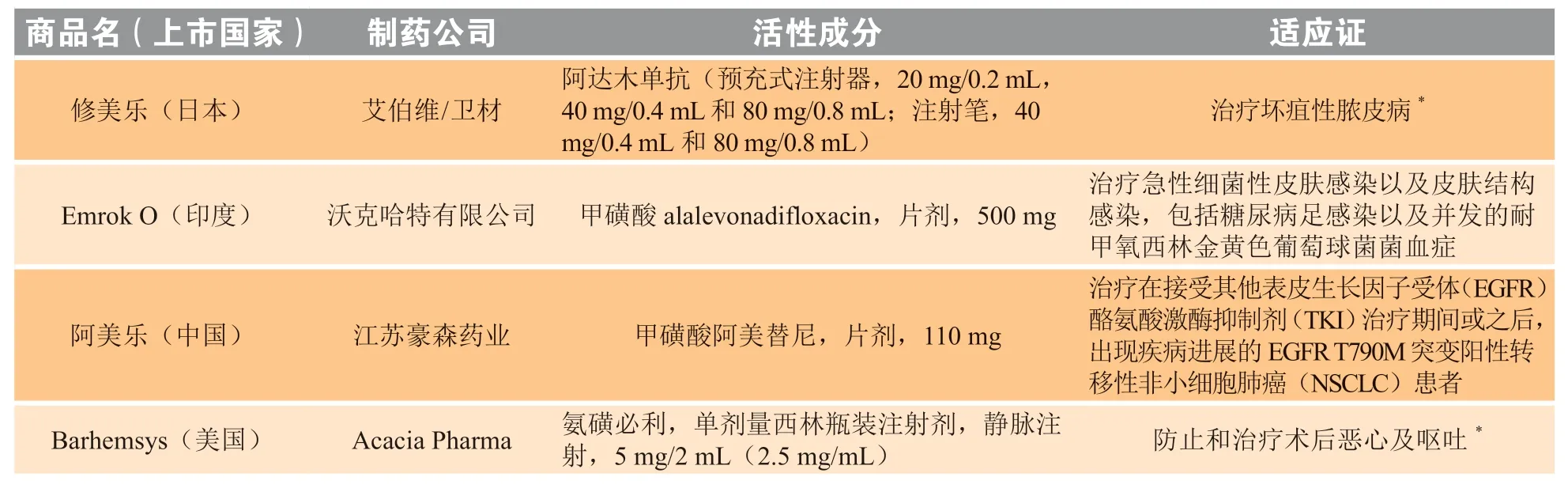
表2 2020年新上市产品一览Table 2 New product intros 2020
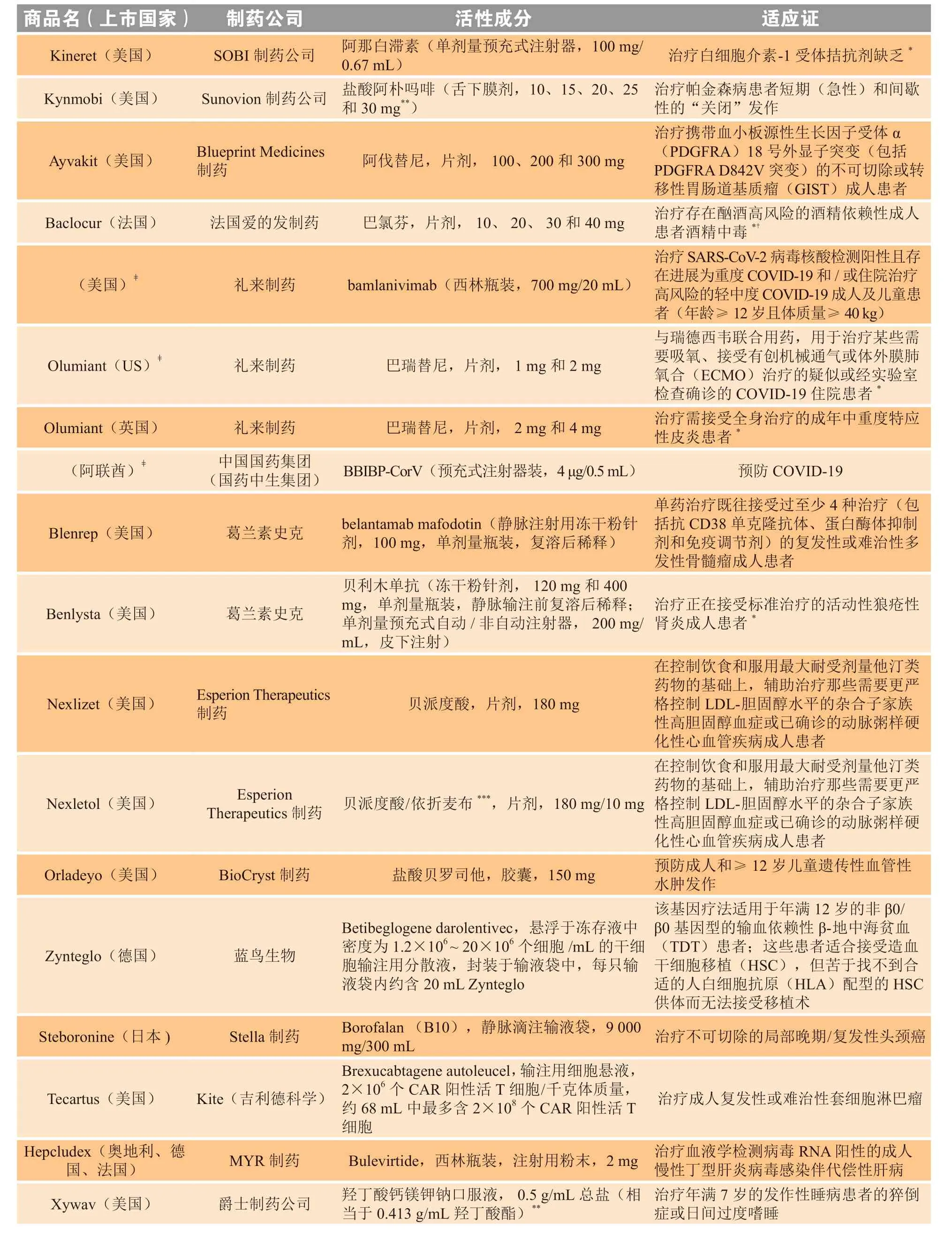
续表2
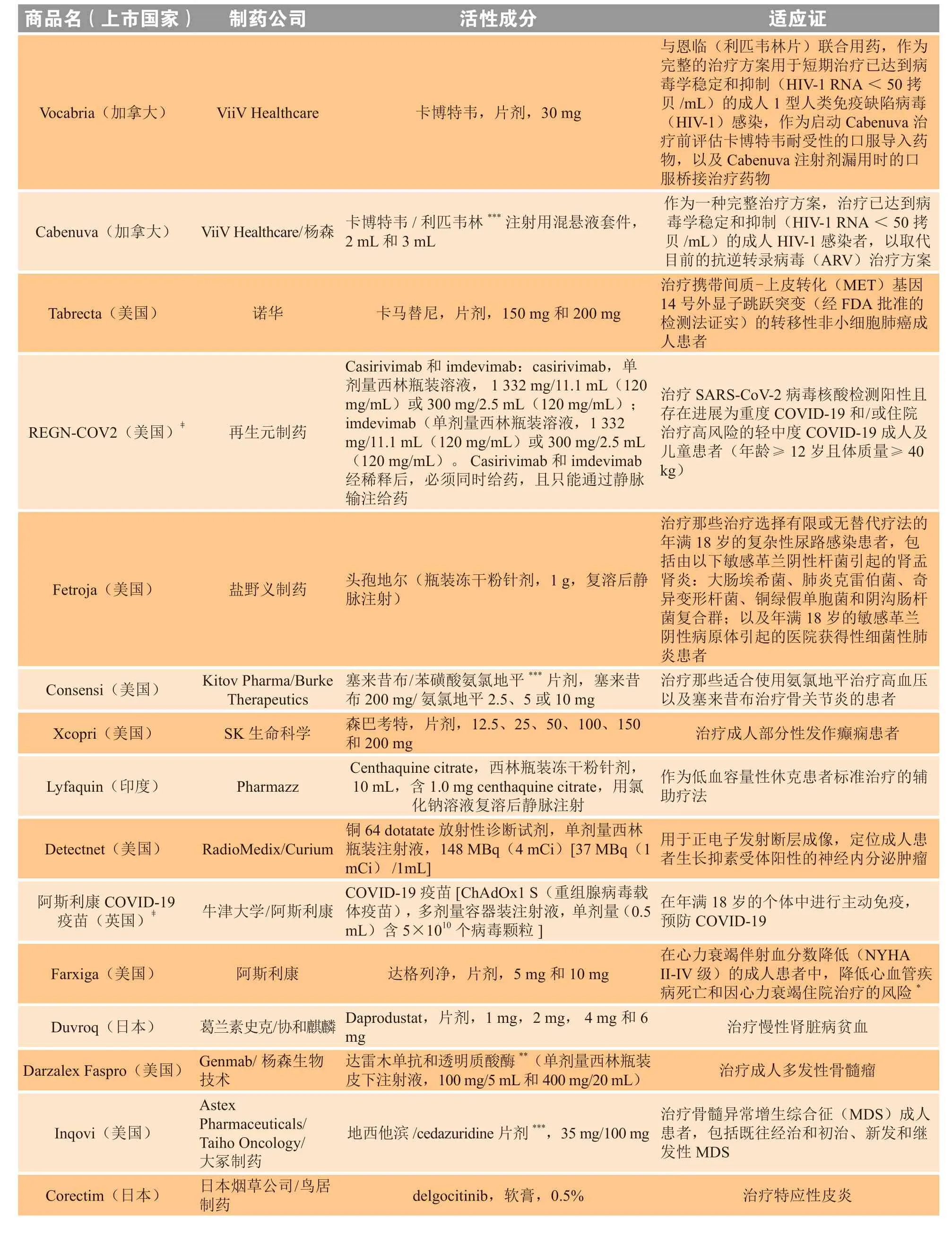
续表2
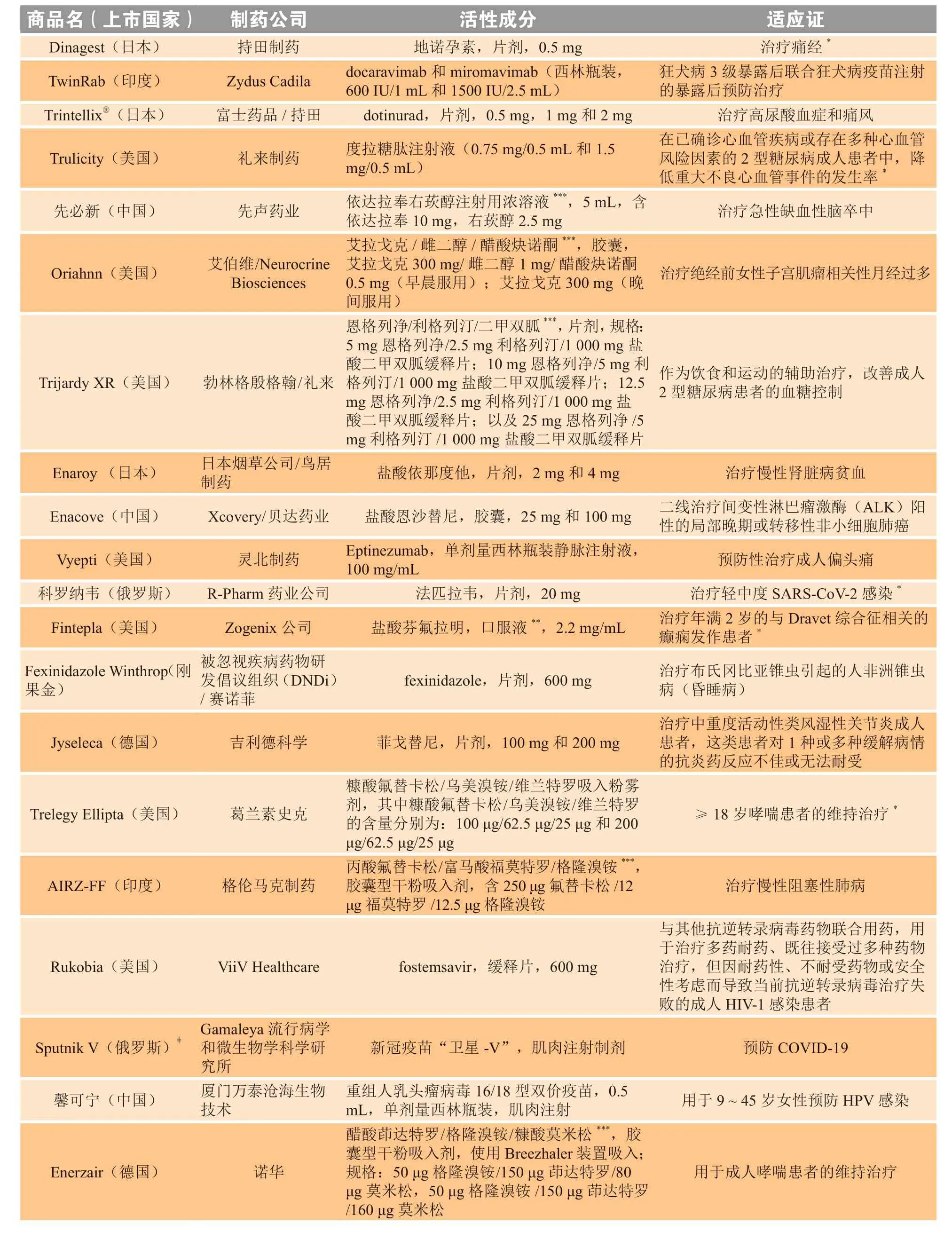
续表2
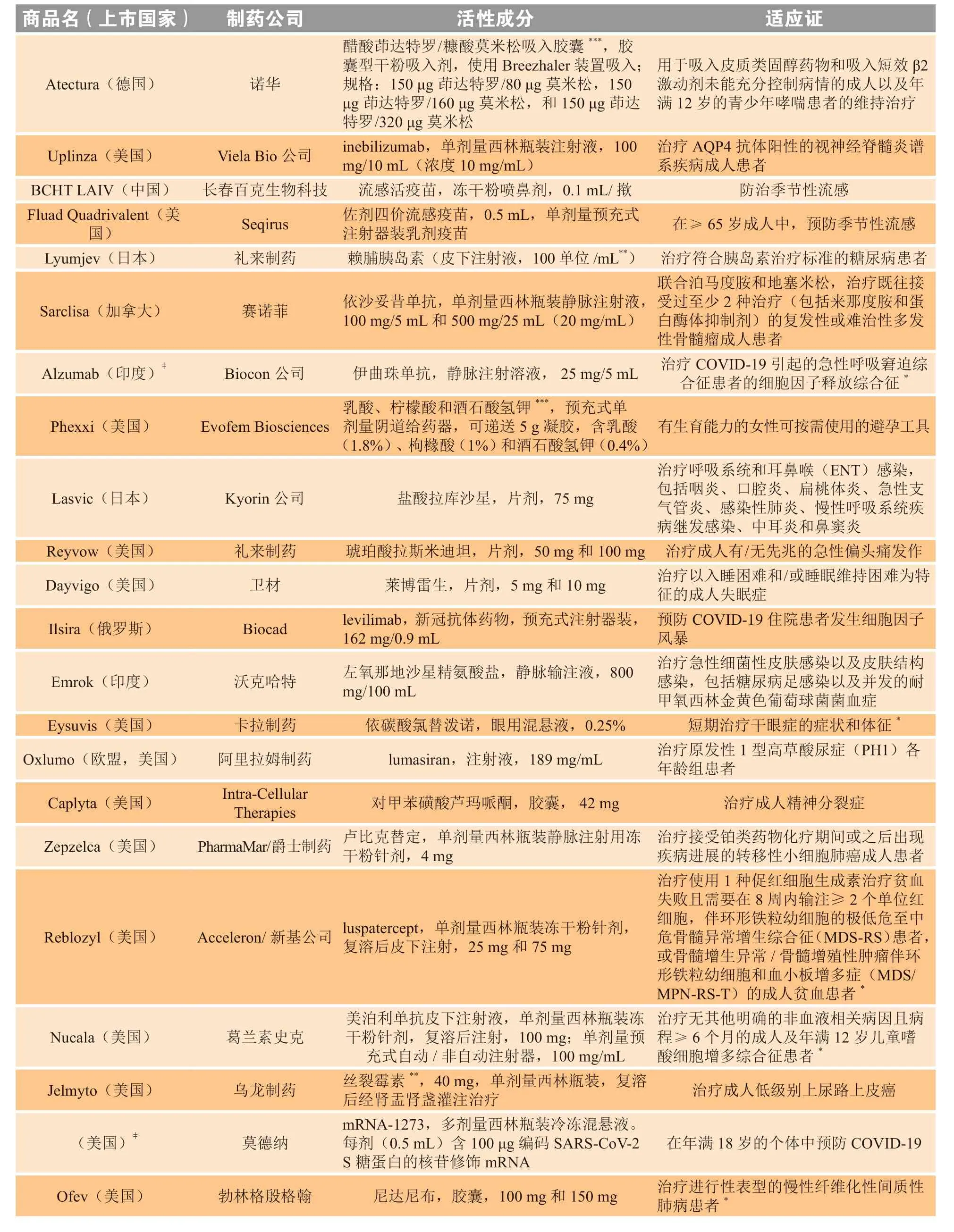
续表2
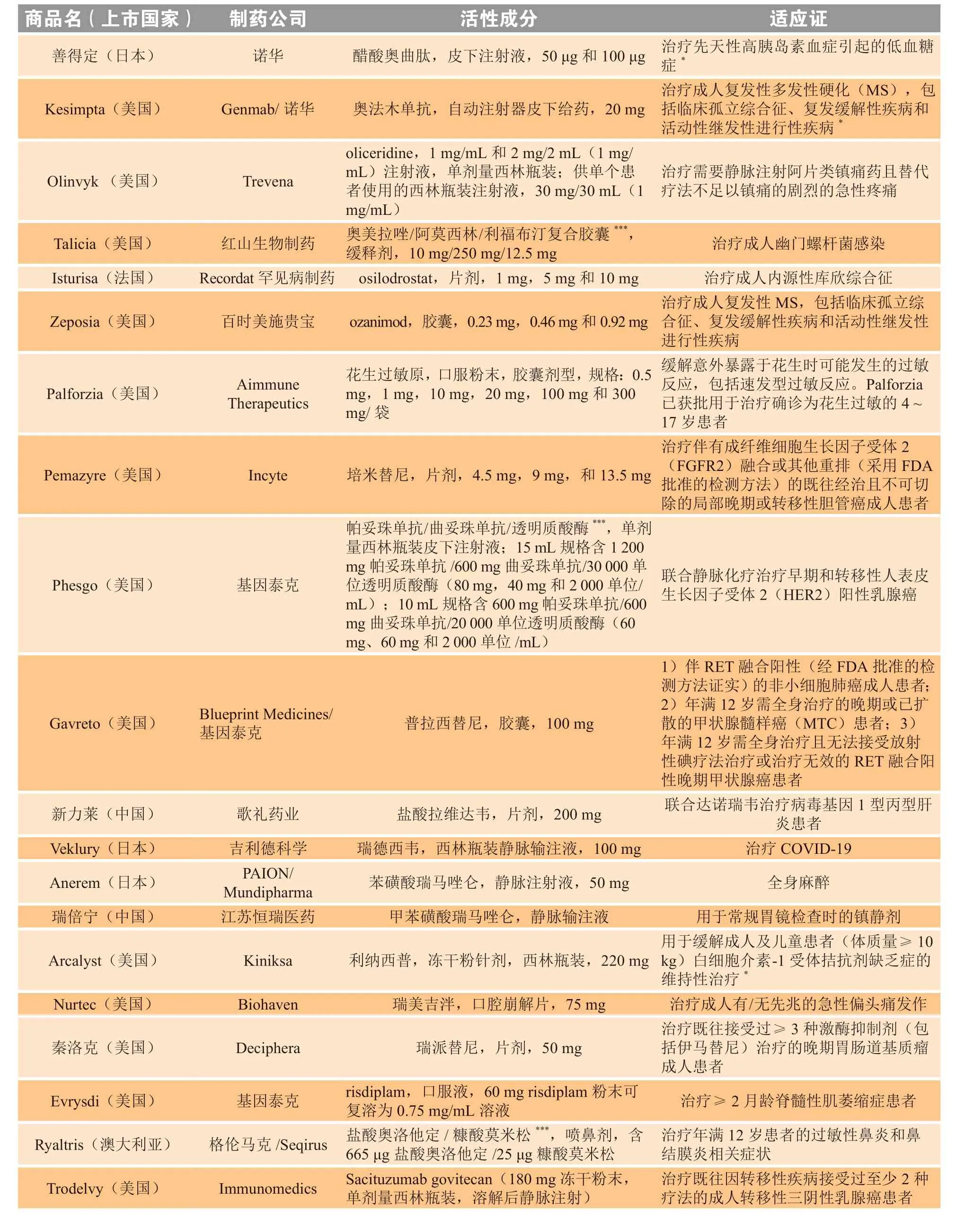
续表2
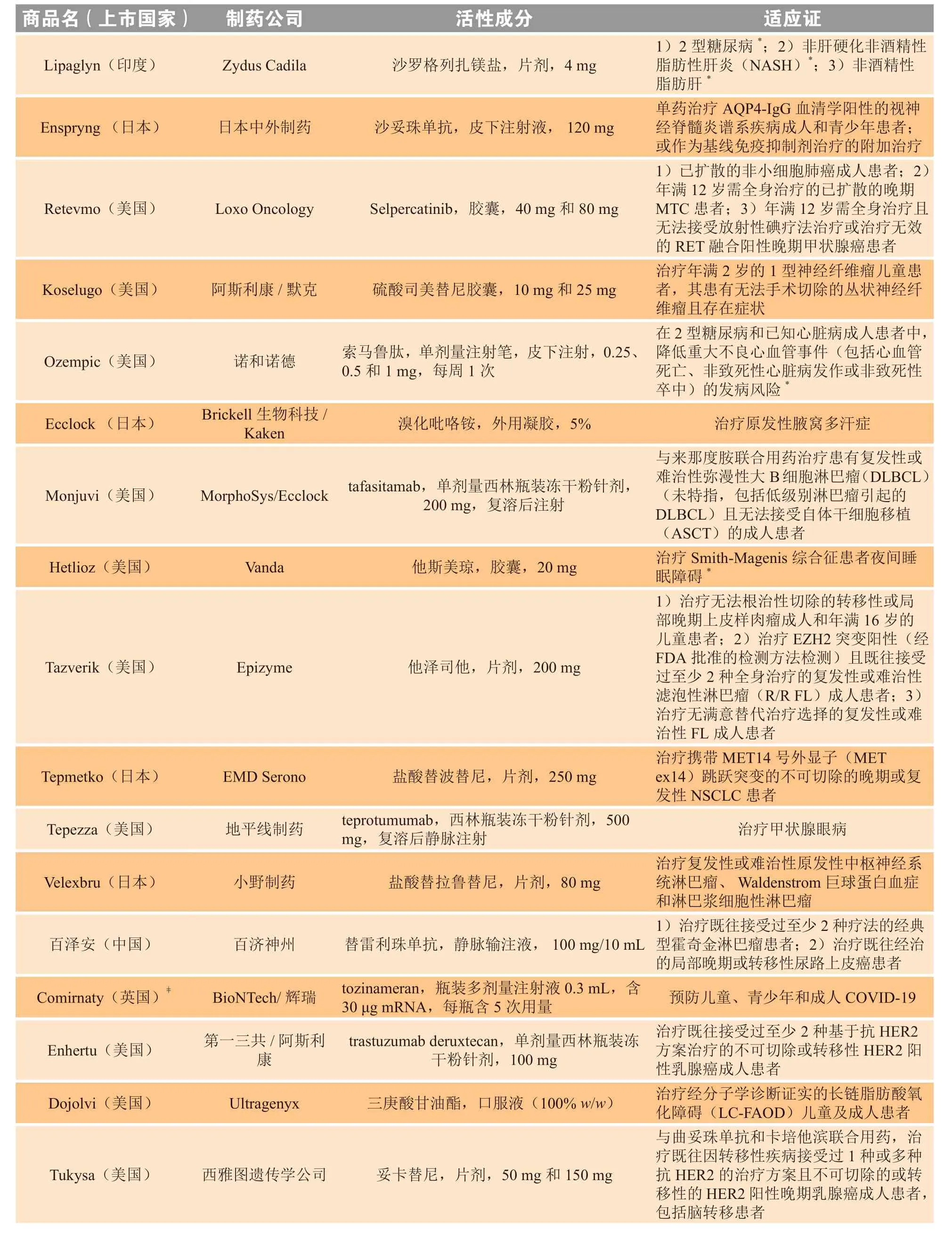
续表2
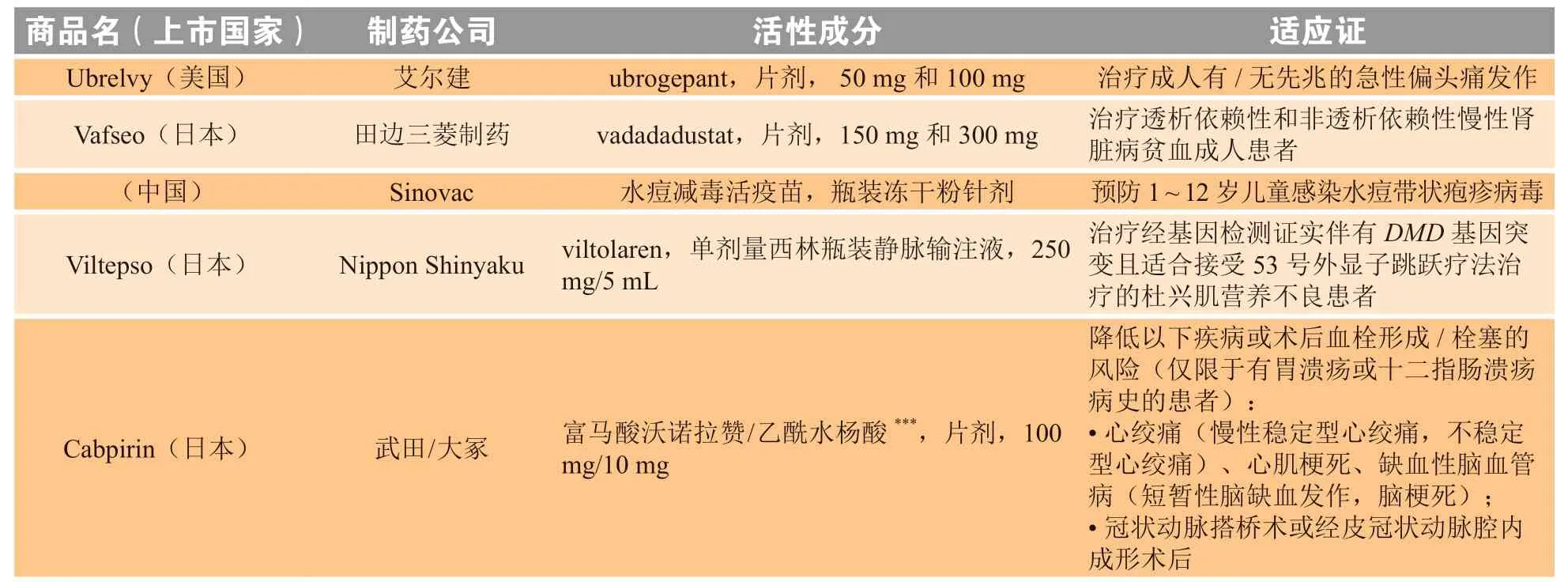
续表2
2 镇痛剂和麻醉剂
2020年有2款苯二氮䓬类新药上市。第1款是江苏恒瑞医药研发的甲苯磺酸瑞马唑仑(瑞倍宁),在中国上市,用于常规胃镜检查时镇静。几个月后,PAION公司研发的苯磺酸瑞马唑仑(Anerem)在日本上市,相关权利已授权给萌蒂公司,适应证为全身麻醉。
2020年8月,oliceridine(Olinvyk;Trevena公司)获得美国FDA批准,用于治疗剧烈程度较高、需要静脉注射阿片类镇痛药物且无有效替代疗法的急性疼痛。Oliceridine是一种μ-阿片受体激动剂,可达到静脉注射阿片类药物的镇痛效果,起效快(2 ~ 5 min),且肾功能损害患者使用该药时无需调整剂量。该药基于开发计划的Ⅲ期研究结果获批,这项研究在1 500多例中重度急性疼痛患者中对oliceridine进行了评价。在硬组织和软组织手术模型中开展的2项关键有效性研究中,该药物显示出快速镇痛效果,与安慰剂相比,结果具有显著差异。Oliceridine于2020年11月在美国上市。该药适于在医院或其他受控的临床环境中进行短期使用,不适于居家使用。
2020年9月,Heron Therapeutics公司的Zynrelef获得欧盟委员会(EC)批准,用于治疗成人中小手术伤口引起的术后疼痛。Zynrelef是一种非阿片类、具有双重作用机制的局部镇痛药。Zynrelef是一种固定剂量复方制剂,含局部麻醉剂丁哌卡因和低剂量的非甾体类抗炎药美洛昔康;注射至手术部位后,镇痛效果可持续约72 h。Zynrelef的获批基于Heron Therapeutics开展的两项评价Zynrelef的多中心、双盲、阳性对照和安慰剂对照的Ⅲ期研究(NCT03295721和NCT03237481)的结果。这2项Ⅲ期研究均达到了主要终点和所有4个关键的次要终点。与生理盐水安慰剂和丁哌卡因溶液(目前用于术后疼痛控制的标准局部麻醉药物)相比,Zynrelef可在72 h内显著缓解疼痛并减少阿片类药物的使用,Zynrelef显著提高了术后无需使用阿片类药物的患者的比例。Heron Therapeutics公司预期Zynrelef将于2021年在欧盟上市。
3 精神药理学药物
食欲素OX1/OX2受体拮抗剂lemborexant(Dayvigo;卫材)在美国首次上市,随后不久在日本上市,用于治疗以入睡和/或睡眠维持困难为特征的失眠症。FDA对lemborexant的批准基于一项包括2项关键性Ⅲ期研究(SUNRISE 2和SUNRISE 1)的结果,在总共约2 000例成人失眠症患者中分别评价了lemborexant相较对照药物(为期1个月)和lemborexant相较安慰剂(为期6个月)的疗效和安全性。在SUNRISE2研究中,lemborexant在主要有效性指标(主观入睡延迟)方面优于安慰剂,差异具有显著统计学意义。Lemborexant在改善主观睡眠效率、入睡时间和睡眠维持方面亦优于安慰剂,差异具有统计学意义。在SUNRISE 1研究中,lemborexant在主要有效性指标(持续睡眠潜伏期)方面优于安慰剂,差异具有显著统计学意义。Lemborexant在改善睡眠效率和入睡后易醒方面也优于安慰剂,结果具有显著统计学意义。食欲素(又称下丘脑泌素)属于下丘脑神经肽,于20世纪90年代末首次被报道。此后,研究发现,食欲素可通过保持觉醒来调节睡眠/觉醒周期,并且有助于食欲调节和维持能量稳态。现已上市的靶向作用于食欲素的失眠药物仅有2款,lemborexant是第2款,首款是于2014年上市的苏沃雷生(suvorexant)。
VandaPharmaceutical公司研发的tasimelteon(Hetlioz)是一种褪黑素MT1/MT2受体激动剂,已上市多年,用于治疗完全失明患者的睡眠-觉醒障碍,其另一种适应证于2020年在美国获批,用于治疗与Smith-Magenis 综合征(SMS)相关的夜间睡眠障碍。SMS是一类罕见的神经发育性疾病,由人类染色体17p的小段缺失引起。SMS的一个关键特征是患者昼夜节律“颠倒”,由此导致SMS患者的夜间入睡极为困难。Tasimelteon是FDA批准的首款SMS治疗药物。适用于成人的胶囊制剂已上市,适用于儿童的液体制剂预计在2021年第1季度上市。
对甲苯磺酸芦玛哌酮(Caplyta;Intra-Cellular Therapies公司)是一种基于多系统协同作用的非典型抗精神病药物,于2019年末获得FDA批准。芦玛哌酮对血清素5-HT2A受体具有强效拮抗活性,还可与多巴胺(D1和D2)受体结合,是突触前D2受体的部分激动剂和突触后多巴胺受体的拮抗剂。此外,临床前数据表明,芦玛哌酮作为谷氨酸能磷蛋白的间接调节剂具有独特的作用机制,可通过哺乳动物雷帕霉素通路靶蛋白(mTOR),增加受体D1依赖的N-甲基-D-天冬氨酸(NMDA)和α-氨基-3-羟基-5-甲基-4-异唑丙酸(AMPA)活性,这种作用机制可带来强效、快速的抗抑郁效果。芦玛哌酮于2020年3月在美国首次上市。
4 神经系统药物
发作性睡病是一种使人衰弱的慢性神经系统疾病,其特征是日间过度嗜睡(EDS)和无法正常调节睡眠-觉醒周期。据估计,在美国每2 000人中就有1人罹患发作性睡病,症状通常初发于儿童期或青春期。γ-羟基丁酸盐(GHB,羟丁酸钠)类药物是发作性睡病的标准治疗方案。GHB是天然的神经递质和神经调节剂,通过专有受体,刺激GABAB和抑制多巴胺能神经元发挥作用。大型的随机临床试验表明,GHB可控制发作性睡病所有主要症状包括猝倒症、EDS、无法抗拒的睡意和夜间睡眠障碍。2020年,FDA批准了Jazz制药公司开发的Xywav(羟丁酸钙镁钾钠)口服液,该药为新型GHB制剂,适用于治疗7岁及以上发作性睡病患者的猝倒症或EDS。与此前上市的药物相比,Xywav含有相同浓度的羟丁酸盐,但钠含量比已上市的药物降低了92%,大幅降低患者服用羟酸盐治疗药物时所摄入的钠量,可能有助于使患者每日的钠摄入量符合美国心脏协会推荐的标准。
降钙素基因相关肽(CGRP)是由37个氨基酸组成的血管舒张神经肽。CGRP广泛分布于中枢和外周神经系统以及心血管系统,在这些系统中发挥一系列生物学效应和生理功能,对偏头痛的病理生理机制(包括神经调节和血管扩张)起着至关重要的作用。抗CGRP单克隆抗体和CGRP受体拮抗剂是治疗偏头痛的最新疗法。已有3款此类药物于2018年上市;2020年,另有3款药物获批,均在美国上市,即抗CGRP单抗eptinezumab(Vyepti;灵北制药)、小分子CGRP拮抗剂ubrogepant(Ubrelvy;艾尔建)以及rimegepant(Nurtec;Biohaven)。单抗类药物必须通过注射给药,而小分子拮抗剂则具有可口服给药的优势。
首创新药5-羟色胺1F (5-HT1F)受体激动剂琥珀酸拉斯米迪坦(Reyvow;礼来)为一款新型神经作用型抗偏头痛药物(NAAMA)。前几代抗偏头痛药物的作用机制均涉及血管收缩作用,而NAAMA则可以在不引起血管收缩的情况下发挥疗效。拉斯米迪坦可选择性地靶向作用于三叉神经通路中的5-HT1F受体。2019年10月,该药获得美国FDA批准,用于成人偏头痛(伴或不伴先兆症状)的急性治疗。礼来在该药经过美国毒品管理局(DEA)审评后,于2020年初将该药上市。
先必新(Sanbexin)是一款新型固定剂量复方制剂,含有自由基清除剂依达拉奉及右旋莰醇,由先声药业面向中国市场开发。该复方制剂在急性缺血性卒中患者中的疗效显著高于依达拉奉单药治疗。2020年,先必新在中国获批上市。
Kynmobi是标准抗帕金森药物阿朴吗啡的一款新型舌下膜剂,于2020年在美国获批上市,用于治疗帕金森病患者短期(急性)和间歇性的“关闭期”发作。此款可快速起效的新型制剂由Synovion开发,并获得了Michael J.Fox帕金森病研究基金会的资助,为患者提供了快速改善运动障碍及在有需要时更好地控制运动症状的便捷方法。
森巴考特(Xcopri)是韩国SK生物制药公司发现并开发的一种新型抗惊厥药,于2020年5月在美国上市,适应证为成人部分发作性癫痫。该药物通过双重作用机制发挥抗惊厥作用:既可抑制钠离子持续通过电压门控钠通道流入细胞内,还是非苯二氮䓬类GABAA通道的变构调节剂。在全球范围内开展的临床试验对森巴考特的有效性和安全性进行了研究,包括2项随机、双盲、安慰剂对照研究(研究013和研究017)和1项大型、多中心、开放的安全性研究(研究021)。这3项研究均入组了患有无法控制的局灶性癫痫成人患者,这些患者同时服用1 ~ 3种其他抗癫痫药物。在随机化研究中,与安慰剂相比,森巴考特可显著降低惊厥的发作频率,多达1/5的患者在维持治疗期间实现了零惊厥发作。
苯丙胺类衍生物芬氟拉明作为成人肥胖症的治疗药物已上市数十年,但最终因严重的副作用(包括肺动脉高压、心脏瓣膜病和心肌纤维化)以及滥用倾向从市场撤回。但在临床应用期间,人们发现低剂量的芬氟拉明在治疗严重痉挛性疾病(如Dravet综合征和Lennox-Gastaut综合征)方面十分有效,并具有良好的风险-获益特征。尽管已知芬氟拉明可调节大脑中5-HT的活性,但其在治疗癫痫方面的作用机制仍未明确。芬氟拉明既可干扰5-HT在神经元囊泡中的储存,又可抑制5-HT的再摄取。该药治疗癫痫的使用剂量远低于先前用于抑制食欲的剂量,且研究已证明其在年轻的Dravet综合征患者中具有安全性和有效性。2020年6月,FDA基于2项入组了202例2 ~ 18岁受试者的研究,批准盐酸芬氟拉明(Fintepla;Zogenix公司)用于治疗≥2岁的Dravet综合征患者。这些研究测量了惊厥发作频率较基线的变化。在这2项研究中,芬氟拉明治疗组的儿童在试验期间癫痫发作频率的降低幅度显著低于安慰剂组的儿童。在治疗3 ~ 4周时观察到癫痫发作频率出现降低,并在14 ~ 15周的治疗期间持续保持这种降低幅度[5–6]。芬氟拉明因用于治疗Dravet综合征被认定为孤儿药。
抗CD20单克隆抗体奥法木单抗(Kesimpta;Genmab/诺华)2020年在美国获批上市,用于治疗成人复发型MS,包括临床孤立综合征、复发-缓解型MS和活动性继发性进行性MS。MS是奥法木单抗的新适应证,该药物已于2009年上市,最初用于治疗慢性淋巴细胞白血病。
MS患者的另一个福音是鞘氨醇1-磷酸受体(S1PR1和S1PR5)激 动 剂Ozanimod(Zeposia;百时美施贵宝)在美国获批上市。该药是这种相对新型机制的第3款上市药物,适用于治疗成人复发型MS,包括临床孤立综合征、复发-缓解型MS和活动性继发性进行性MS。该药的同一适应证也已在欧盟获批。
脊髓性肌萎缩症(SMA)是一种常染色体隐性神经退行性疾病,主要在儿童期发病,累及脊髓和脑干的运动神经元。SMA是一种罕见疾病,在全球范围内均有发病。该病在活产婴儿中的发病率约为1/11 000,人群携带率约为1/50[7]。5年前还没有药物获批用于该适应证。直至2017年FDA批准了首个SMA治疗药物上市才改变了这一状况。该药名称为诺西那生钠注射液nusinersen,是一种反义寡核苷酸,可增强SMN2基因对完整长度的SMN蛋白的表达,适用于治疗Ⅰ型SMA。2019年,Onasemnogene abeparvovec这 一针 对SMA的 首个基因替代疗法在美国获批上市。2020年,SMA第3款治疗药物获批;该药物是基因泰克公司开发的risdiplam(Evrysdi),是一种SMN2剪接修饰剂口服小分子药物。该药获批基于2项旨在广泛代表SMA患者的临床研究数据:在有症状的2 ~ 7个月龄婴儿中开展的FIREFISH研究(NCT02913482)和在2 ~ 25岁儿童和成人中开展的SUNFISH研究(NCT02908685)。在这2项研究中,risdiplam在各年龄段和不同严重程度(Ⅰ、Ⅱ和Ⅲ型)患者中均改善了其运动功能。该药帮助婴儿患者摆脱了对呼吸机的永久性依赖,并使他们获得了在没有支撑的情况下也能坐立的能力。
肌营养不良症(muscular dystrophies,MD)是一组在临床症状、遗传学和生物化学方面均具有异质性的先天性神经肌肉类疾病,以进行性肌肉萎缩和肌无力(从肌肉的微观变化开始)为特征;目前已发现30多种MD,最常见的一类为杜兴肌营养不良(DMD)。DMD患者(通常为男性,年龄3 ~ 5岁)的初期症状为下肢肌无力、腓肠肌假性肥大和典型的步态不稳。该疾病进展迅速,大多数患者在青春期早期即开始使用轮椅;许多患者会在青少年晚期或成年早期死亡。患儿的智力发育和学习成绩可能会受到一定程度的损害。10年前仍无针对任何类型MD的治疗药物在任何国家获批。自ataluren于2014年上市以来,DMD患者及其家属的境况迅速开始改善;目前已有5种此类药物上市。2020年,此类药物家族中又增加了一个新成员——viltolarsen(Viltepso;日本新药株式会社),其于3月在日本获批,并于5月在日本上市。作为首个面向日本市场开发的外显子跳跃疗法药物,viltolaren适用于治疗证实存在DMD基因突变且适合接受外显子53跳跃疗法治疗的DMD患者。Viltolarsen于2020年下半年在美国获批上市,这是首款并且是唯一一款适用于4岁以下儿童的DMD药物。
视神经脊髓炎谱系疾病(NMOSD),又称Devic病,是一种以视神经炎症和脊髓炎症为主要症状并可累及脑和脊髓的罕见的慢性自身免疫性疾病。视神经炎可导致疼痛和视力丧失,脊髓炎则可能影响身体下半部的某些或所有运动、感觉和自主神经功能。根据美国罕见疾病组织的统计数据,全球每10万人中就有1 ~ 10人受到NMOSD的困扰[8]。在NMOSD患者中,抗水通道蛋白-4(AQP4)抗体检测阳性的比例约为80%。这些抗AQP4自身抗体由CD19+B细胞分泌,主要与中枢神经系统中的星形胶质细胞结合。通常认为抗AQP4抗体与中枢和外周神经系统的神经细胞结合后,可形成膜攻击复合物,由此对视神经、脊髓和脑组织造成损伤。2019年前,该病患者的治疗选择仅限于免疫抑制剂或皮质类固醇药物。2019年,补体抑制剂依库珠单抗(eculizumab)获批用于治疗NMOSD;2020年,又有2种新药获批上市。
2020年6月,FDA批准了VielaBio公司开发的人源化抗CD19单克隆抗体inebilizumab(Uplizna),用于治疗抗AQP4抗体阳性的NMOSD成年患者,治疗方案为初始给药后进行维持治疗,每年给药2次。该药获批部分基于一项在全球范围内开展的关键性、安慰剂对照的N-MOmentum研究的结果,该研究(NCT02200770)入组了213例抗AQP4抗体阳性患者和17例抗AQP4抗体阴性患者。该研究表明,inebilizumab可显著降低NMOSD发作的风险,因而达到主要终点。具体而言,治疗6个月时,抗AQP4抗体阳性组未出现复发的患者比例为89%,而安慰剂组的这一比例仅为58%。在关键次要终点(包括与NMOSD相关的住院治疗次数减少)中,inebilizumab也带来了显著获益。此外,该药物具有良好的安全性和耐受性特征[9]。Inebilizumab已获得孤儿药和突破性疗法资格认定,于2020年夏季在美国上市。
同样在6月,日本和加拿大的监管机构批准了抗白介素-6受体(IL-6R)单克隆抗体satralizumab(Enspryng;日本中外制药/基因泰克),作为单药治疗或基于免疫抑制剂治疗的附加疗法,用于治疗AQP4-IgG血清学阳性的NMOSD成人和青少年患者。FDA随后于8月也批准了satralizumab。Satralizumab是唯一获批的靶向和抑制IL-6R活性的NMOSD治疗药物,其可在NMOSD相关炎症的治疗中发挥重要作用。该药采用新型的再循环抗体技术设计,与传统技术相比,可延长抗体循环使用的持续时间,给药方案为每4周经皮下给药1次。Satralizumab于2020年8月首次在日本上市。
1型神经纤维瘤病(NF1)是另一种罕见的神经系统遗传性疾病,针对该疾病的首款治疗药物于2020年获批上市。NF1由17号染色体上被称为NF1的基因突变引起,每2 500 ~ 3 000名新生儿中即有1人罹患此病。NF1基因负责调控神经纤维瘤蛋白的生成,该蛋白被认为是一种肿瘤抑制因子。该病特征为皮肤和神经的多发性良性肿瘤,即丛状神经纤维瘤(PN),以及皮肤表面出现异常的色素沉着区域。NF1患者也可能出现巨头畸形和/或相对身材矮小,以及其他异常症状,如癫痫、学习障碍和注意力缺陷、言语困难和骨骼畸形。相关的症状和其他异常表现的范围及严重程度可能存在较大的个体差异。尽管大多数NF1患者智力正常,但约50%的受累儿童存在学习障碍[10]。2020年4月,FDA批准了MEK1/2抑制剂硫酸司美替尼(Koselugo;阿斯利康/默沙东),该药用于治疗有症状且丛状神经纤维瘤无法手术切除的≥2岁的儿童NF1患者。这是首款获批用于治疗NF1 PN的药物。该药获批基于SPRINT Stratum 1 Ⅱ期研究的阳性结果。研究结果表明,在有症状且PN无法手术切除的NF1儿童患者中,硫酸司美替尼单药治疗,每日口服2次,总缓解率(ORR)达66%(33/50)。ORR被定义为确认完全缓解或部分缓解(肿瘤体积至少缩小20%)的患者比例。33例获得缓解的患者证实为全部达到部分缓解[11]。该药物在美国被认定为孤儿药,并在获批准后立即上市。
(待续)
原文来源:Drugs of Today,2021, 57(2): 101-177

