肾纤维化相关信号通路研究进展
唐露,司晶,徐寒梅
(中国药科大学,江苏 南京 211198)
肾纤维化(renal fibrosis,RF)是一种慢性进行性纤维化肾病,是几乎所有慢性肾脏疾病(chronic kidney disease,CKD)和进展性肾病的最终途径[1]。CKD和RF影响着10%的世界人口,有相当比例的人群会进展为终末期肾衰竭,需要终身透析和肾移植,给患者、家庭以及社会带来巨大的经济负担[2–3]。
RF是一种慢性疾病,目前其明确的发病机制尚不清楚。RF发病因素有很多,肾脏在受到损伤、感染、高血压以及不良生活习惯等多种因素影响后,肾脏发生固有细胞受损、纤维化和硬化,这个过程即肾脏纤维化的过程,其病理特征为损伤、炎症、肌成纤维细胞活化迁移和肾小管上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT),以及细胞外基质(extracellular matrix,ECM)沉积和重塑[4]。损伤后纤维基质的沉积最初可能有助于组织修复,轻度损伤后纤维基质能在组织修复过程中被吸收。然而,在发生CKD的慢性损伤中,损伤是不断进行的,纤维基质不会被完全吸收,纤维基质沉积不受抑制,最终破坏器官结构,减少血液供应,扰乱器官功能。纤维化会降低组织修复的能力,最终导致肾衰竭[1,5]。转化生长因子(TGF)-β、Wnt和Hedgehog(Hh)的表达增加均影响着RF的发生发展,这些因子所在的信号通路与RF有着密切的关系。
1 TGF-β/Smad信号通路
1.1 TGF-β/Smad信号通路的起源与机制
TGF-β是一种多功能蛋白质,能够调节巨噬细胞、活化的T细胞和B细胞、未成熟的造血细胞、中性粒细胞和树突细胞等细胞的增殖、分化、凋亡、黏附和迁移[6],该蛋白超家族成员包括TGF-β、活化素(activin)、骨形态发生蛋白(BMP)、生长分化因子(GDF)等。在哺乳动物中TGF-β由TGF-β1、TGF-β2和TGF-β3共3种亚型组成,体外功能相似,但体内功能差异较大,其中TGF-β1是最丰富的亚型[7]。
如 图1所 示,经 典TGF-β1/Smads信 号 通 路开启需要潜在相关肽(latency-associated peptide,LAP)与潜在TGF-β结合蛋白(latent TGF-β binding protein,LTBP)结合形成复合物,随后复合物被广泛的蛋白酶[包括纤溶酶、基质金属蛋白酶(matrix metalloproteinase,MMP)-2和MMP-9]切 割,释放活性形式的TGF-β1。活性TGF-β1与其Ⅱ型受体(TβRII)结合,激活TGF-βⅠ型受体(TβRI)激酶,进一步磷酸化Smad2和Smad3,激活的Smad2和Smad3随后与Smad4形成异源三聚体复合物并转移到细胞核中,与其他转录因子、共激活因子和辅助抑制因子共同调控特定基因的表达[8–10]。

图1 组织纤维化中的经典TGF-β1/Smads信号通路Figure 1 Classic TGF-β1/Smads signaling pathway in tissue fibrosis
1.2 TGF-β/Smad信号通路在肾纤维化中的作用
TGF-β是大多数CKD中诱导肾纤维化的主要因素。TGF-β1可通过激活经典(基于Smad)和非经典(基于非Smad)信号通路诱导肾纤维化,从而导致肌成纤维细胞的激活、ECM的过量积累和ECM降解的抑制[11]。
Smad蛋白在纤维化调节中的作用较为复杂,具有促纤维化和抗纤维化这2种作用,并且在TGF-β/Smad和其他信号通路之间具有复杂的纽带作用。
1.2.1 TGF-β/Smad3与肾纤维化Smad3是抗纤维化治疗的一个有潜力的靶点,Smad3基因敲除可抑制梗阻性肾病、糖尿病肾病、高血压肾病和药物毒性相关肾病的纤维化。在正常情况下,磷酸化的Smad3只有在完成激活核内转录的任务并被转运出细胞核后,才能通过泛素-蛋白酶体途径被识别和降解。有研究构建了一种新的蛋白质靶向嵌合分子(PROTAC),其可通过靶向胞质内Smad3的泛素化和降解来预防肾纤维化[12–13]。
肌成纤维细胞是器官纤维化中ECM产生的主要来源,TGF-β/Smads在不同来源的肌成纤维细胞的分化或活化中起主导作用,在人体活检中检测到EMT。体外研究表明,TGF-β1诱导培养的肾小管上皮细胞分化为肌成纤维细胞样细胞,并产生大量的ECM,主要通过依赖于Smad3的方式介导[14]。
内皮细胞-间充质转化(endothelial-mesenchymal transition,EndMT)在纤维化的肾脏中被发现,可导致肾脏纤维化,TGF-β在体外和体内均可促进EndMT。从内皮细胞中有条件地敲除Tgfr2可抑制肾纤维化,Smad3特异性抑制剂(Smad3-specific inhibitor,SIS3)对Smad3的抑制可预防EndMT并减轻糖尿病肾病[6]。
纤维细胞,一种来源于骨髓单核细胞前体的Ⅰ型胶原产生细胞,是肾纤维化模型中肌成纤维细胞的来源。TGF-β1通过Smad2/3和JNK途径促进纤维细胞向肌成纤维细胞转化。骨髓来源的巨噬细胞基于TGF-β/Smad3依赖机制,通过巨噬细胞-肌成纤维细胞转化(MMT)显著促进肾纤维化[15]。
1.2.2 TGF-β/Smad4与肾纤维化Smad4在TGF-β/BMP信号通路中能促进Smad2/3和Smad1/5/8复合物的核移位。体外系膜细胞Smad4缺乏抑制胶原蛋白Ⅰ(Collagen I)启动子活性,管状上皮细胞中Smad4的条件性缺失显著减少了单侧输尿管梗阻(UUO)模型小鼠的纤维化,而不影响Smad3的活化[16]。
1.2.3 TGF-β/Smad7与肾纤维化Smad7是TGF-β/Smad信号的负反馈抑制剂,Smad3复合物响应TGF-β1的Smad7转 录,Smad7与Smad2和Smad3竞争活化TβRI上的结合位点,因此Smad7负调控TGF-β/Smad信号通路[17]。TGF-β1激活Smad泛素调 节 因 子(Smad ubiquitination regulatory factor,Smurf),通过转录后修饰降解Smad7,从而增强TGF-β/Smad3信号。Smads信号因此失衡,这成为组织纤维化的关键因素,最终会加速ECM的积累,加速肌成纤维细胞发生EMT、EndMT和MMT[4,9]。
1.3 TGF-β/Smad信号通路抑制与肾纤维化
TGF-β具有高度多效性的功能,因此持续的抑制可能会引起较大的副作用,长期全身性TGF-β抑制治疗可能会影响伤口愈合、组织修复和抗炎作用。在纤维化的啮齿动物模型中,抑制TGF-β能降低ECM的产生,但是抑制TGF-β也会干扰免疫细胞,完全阻断TGF-β的小鼠患自身免疫性疾病的风险增加,同时会加剧炎症、使病情恶化[18]。在诱导输尿管梗阻后,肾小管细胞中TGF-βRII的条件性敲除造成肾脏炎症增加,白细胞介素(IL)-1β和肿瘤坏死因子(TNF)-α上调[16]。应研究更优的策略来阻断纤维化肾脏中TGF-β的功能,使其对其他器官的干扰最小,为了克服这些副作用,可开发用于位点特异性TGF-β阻断或关闭TGF-β信号传导恶性循环的方法。
2 Wnt/β-catenin信号通路
2.1 Wnt/β-catenin信号通路的起源与机制
Wnt信号通路是由配体蛋白质Wnt和膜蛋白受体结合激发的信号通路。Wnt1基因最初被命名为Int1,于1982年被鉴定为一种通过整合小鼠乳腺肿瘤病毒前体DNA在病毒诱导的乳腺肿瘤中激活的基因,Int1基因在小鼠正常胚胎发育中发挥重要作用,与果蝇的无翅(Wingless)基因功能相似,均可控制胚胎的轴向发育,基于两者基因与蛋白功能的相似性,被合并命名为Wnt[19–20]。Wnt蛋白是一组分泌型脂质修饰糖蛋白,其中许多通过典型Wnt途径发挥作用,β-catenin是关键的介质[21]。
Wnt/β-catenin信号通路是经典的Wnt信号通路。Wnt/β-catenin信号通路对于调节细胞黏附、迁移、EMT、胚胎发育以及组织和器官的稳态具有重要作用。Wnt/β-catenin信号通路的失调与肾纤维化的进展密切相关,激活Wnt/β-catenin信号可提高包括肾脏在内的各种器官中成纤维细胞的活性,该途径可能在组织损伤后被重新激活[22]。
Wnt信号的典型途径由细胞内蛋白β-catenin介导(见图2)。在没有Wnt配体的情况下,磷酸化触发蛋白酶体降解,细胞内β-catenin水平受到限制。激活后,Wnt配体与Wnt受体卷曲蛋白Frizzled(Fzd)和共受体低密度脂蛋白受体相关蛋白5和6(low density lipoprotein receptor-related protein 5 and 6,LRP5/6)结合,从而激活胞质内的蓬乱蛋白(dishevelled,Dvl)。然后Dvl抑制β-catenin破坏复合物,该复合物由支架蛋白Axin、腺瘤性息肉病大肠埃希菌蛋白(APC)、糖原合酶激酶-3β(glycogen synthase kinase-3β,GSK3β)的丝氨酸/苏氨酸激酶和酪蛋白激酶1(casein kinase 1,CK1)组成。未磷酸化的β-catenin在细胞质中累积并进入细胞核,在那里它与转录因子的T细胞因子(T cell factor,TCF)/淋巴增强子结合因子(lymphoid enhancerbinding factor,LEF)家族相互作用来调节Wnt靶基因[20,23]。
2.2 Wnt/β-catenin信号通路在肾纤维化中的作用
Wnt/β-catenin的几个直接靶标包括纤连蛋白、成纤维细胞特异性蛋白1(fibroblast-specific protein 1,Fsp1)、MMP-7、纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,PAI-1)和肾素-血管紧张素系统(renin-angiotensin system,RAS)成分。其中,纤连蛋白是ECM成分,Fsp1是成纤维细胞和肌成纤维细胞的标志[23]。
在急性缺血再灌注损伤小鼠模型中,多种Wnt配体(Wnt2、Wnt2b、Wnt4、Wnt5a、Wnt7b和Wnt10b)协同上调。Wnt蛋白位于干细胞区室,在上皮损伤反应中高表达,说明其在细胞再生中发挥着作用,尤其是Wnt4,通过调节细胞周期蛋白cyclinD1和cyclinA来促进管状上皮细胞的再生。再生肾中积累的巨噬细胞表面表达Wnt配体,包括Wnt4、Wnt7b、Wnt10a和Wnt10b。分离的缺血再灌注损伤小鼠巨噬细胞中Wnt配体高表达,同时上皮细胞中Wnt信号增加,小鼠体内巨噬细胞的消融导致Wnt的表达减少,表明Wnt来源于此[24]。

图2 Wnt/β-catenin信号通路Figure 2 Wnt/β-catenin signaling pathway
Wnt在慢性肾病动物模型的肾脏中表达增加。在肾纤维化的UUO模型中,肾小管细胞中19种Wnt蛋 白(除Wnt5b、Wnt8b和Wnt9b外)和10种Fzd受体(除Fzd4和Fzd5外)中的大部分蛋白表达增加。研究表明,Wnt和β-catenin不仅参与慢性肾病的发展,而且也参与纤维化的发展。小鼠管状细胞中的活性β-catenin过表达引起了一些纤维化的特征,如上皮去分化和EMT[25–26]。
Wnt/β-catenin激活的减少与肾纤维化模型的显著改善结果相关。Dickkopf1(Dkk1)是一种Wnt拮抗剂,结合LRP5/6受体并抑制经典Wnt信号通路。将编码Dkk1的基因注射到肾纤维化模型小鼠体内,发现胶原沉积减少、间质扩张减少和α平滑肌肌动蛋白(α-SMA)表达降低,说明能减少β-catenin的积累和纤维化[27–28]。分泌型卷曲相关蛋白1(SFRP1)作为Wnt信号的双相调节剂,在高浓度时抵消Wnt诱导的效果,在低浓度时促进。UUO损伤后,缺乏SFRP1的小鼠纤维化水平增加,波形蛋白和α-SMA表达水平增加[29–30]。
3 Hedgehog信号通路
3.1 Hedgehog信号通路的起源与机制
Hedgehog(Hh)信号最早在果蝇中被发现[31]。Hedgehog是一种共价结合胆固醇的分泌性蛋白,果蝇该蛋白的基因发生突变会导致幼虫体表出现许多刺突,形似刺猬,故名Hedgehog。Hh通路是一种非常复杂的信号通路,从果蝇到人类都非常保守,在哺乳动物中,Hh信号在胚胎发育、大脑和脊髓的分化和增殖以及内部器官和肢体的模式中起着至关重要的作用,以便发育中的组织具有正确的大小、适当的细胞类型以及神经支配和血管化的程度[32]。异常的Hh信号会引发多种肿瘤疾病,包括基底细胞癌、前列腺癌、乳腺癌和肺癌。Hh信号在肾单位的形成和肾脏的发育中起着重要作用,这种信号通路的异常激活将导致肾纤维化[33]。
哺乳动物中主要有3个基因来编码Hh蛋白,即Shh(Sonic hedgehog)、Ihh(Indian hedgehog)和Dhh(Desert hedgehog)。Hh信号通路包括2种跨膜蛋白,一种是12次跨膜蛋白Patched(Ptch),另一种是7次跨膜蛋白Smoothened(Smo)。在哺乳动物中,Ptch的2种亚型由Ptch1和Ptch2编码,Ptch1是唯一明确参与Hh信号激活的,其局限于靶细胞并在对Hh蛋白的反应中上调。Ptch2与Hh蛋白共表达,但其转录与途径激活无关。Smo的拓扑结构类似于G蛋白偶联受体,具有信号转导子的作用。Gli蛋白由Gli基因编码且具有锌指结构,是Hh信号通路的主要效应因子,在哺乳动物中有Gli1、Gli2、Gli3等3种亚型,3种Gli转录因子在介导Hh信号传导中很重要,Gli2和Gli3具有激活剂和阻抑剂的功能,而Gli1仅作为激活剂[34–35]。
如图3所示,Ptch蛋白定位在初级纤毛上,当Hh配体缺失时能够抑制Smo活性。Hh配体与Ptch蛋白结合使膜表面Ptch下调,中和Ptch对Smo的抑制作用,使得Smo在膜表面富集活化,随后Smo激活下游信号,破坏Gli磷酸化复合物(Gli-sufufu-cos2),活化的Gli在细胞核中积累,然后控制靶基因的转录,如细胞周期蛋白D1和细胞周期蛋白E等[36]。
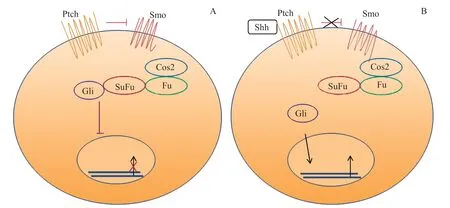
图3 组织纤维化中经典Hedgehog信号通路Figure 3 Classic Hedgehog signaling pathway in tissue fibrosis
3.2 Hedgehog信号通路在肾纤维化中的作用
在肾纤维化过程中,Ihh诱导促进了肾皮质和髓质中Ptch1和Gli1的表达,特别是邻近的管状上皮中。并且,Gli1的诱导能被Smo拮抗剂IPI-926(saridegib)完全抑制[37]。Ihh和Shh在肾的管状上皮细胞中表达,以及Gli1和Gli2在肾间质中的表达,表明Hh在肾纤维化过程中以旁分泌方式起作用,类似于其在肾发育过程中的作用。Hh信号还通过直接调节一系列纤维生成基因(例如Gli1、Snail1、Ⅰ型胶原、纤连蛋白、结蛋白和α-SMA的基因)的表达来诱导肌纤维母细胞的活化和ECM的产生,从而导致ECM沉积和瘢痕的形成。
越来越多的证据表明,大部分肾肌成纤维细胞可能来源于通过EMT分化的肾小管上皮细胞,EMT在肾纤维化中发挥着重要的作用[38],单侧或双侧输尿管梗阻大鼠的肾脏样本显示Shh途径蛋白、间充质标志物的表达增强,上皮标志物的表达降低,外源性Shh激活信号通路,环巴胺阻断Shh信号可消除Shh介导的EMT以及肌纤维母细胞,并降低TGF-β1的表达和ECM的产生[39]。
尽管研究表明Hh信号在肾脏发育中起着关键作用,但其在肾脏内环境稳定中的作用尚未得到研究[40]。在一些肾纤维化动物模型发生发展的早期,外泌体的产生增加,主要发生在肾小管近端上皮细胞中,同时Shh也参与诱导。体内注射管状细胞衍生的外泌体加重了肾损伤和纤维化,Shh信号抑制剂能抑制外泌体的作用。敲除Rab27a(一种对外泌体形成至关重要的蛋白质),保护了小鼠的肾功能并减轻了肾纤维化病变。研究表明,小管衍生的外泌体通过递送Shh配体在肾纤维化中起着重要作用。因此,针对外泌体的策略可能是开发抗肾纤维化疗法的新途径[41]。
4 结语
综上所述,信号通路在肾纤维化的发生发展中发挥着巨大的作用,降低一些信号在一定程度上确实有抑制肾纤维化的效果,但是同时也会带来其他一些问题。由于肾纤维化的发生是一个复杂的过程,受多种细胞因子和信号通路的调节,单一地研究其中一条信号通路并不能很好地治疗肾纤维化,进一步研究各信号通路之间的交叉信号或可成为肾纤维化治疗的突破口。

