有机阳离子转运体在脑内分布的药理学意义
刘晓楠,刘晓东,刘李
(中国药科大学药学院药物代谢研究中心,江苏 南京 210009)
1 有机阳离子转运体概述
有机阳离子转运体(organic cation transporter,OCT)是溶质转运体22(solute carrier 22,SLC22)家族的成员,包括OCT1、OCT2和OCT3这3种亚型,分别由SLC22A1、SLC22A2和SLC22A3基因编码。1994年,OCT1作为OCT第一个成员从大鼠肾cDNA文库中被克隆出来;此后,OCT1、OCT2和OCT3相继在人、大鼠、小鼠和兔中被克隆和表征[1]。研究人员基于对人类氨基酸序列的两两比较发现,OCT1和OCT2同源性较高(70%相同,84%相似),OCT3与OCT1(50%相同,70%相似)和OCT2(50%相同,73%相似)同源性较低[2],尽管如此,三者的结构特征和生物学特性十分相似[3]。
OCT1、OCT2和OCT3基本转运特性相似,其转运方式是钠离子非依赖性的双向转运,决定转运方向的主要驱动力是转运的有机阳离子的电化学梯度[4]。OCT的底物通常是相对分子质量较小、具有亲水性的有机阳离子,特别是OCT1和OCT2,其底物具有广泛的分子结构。常见的外源性底物包括糖尿病治疗药物二甲双胍、抗病毒药阿昔洛韦/扎西他滨、抗肿瘤药顺铂、N-甲基-D-天冬氨酸受体拮抗剂美金刚和组胺H2受体拮抗剂雷尼替丁等,内源性底物主要是生物胺类神经递质,包括5-羟色胺(5-HT)、去甲肾上腺素(NE)、多巴胺(DA)、肾上腺素和组胺等[1],其中很多底物同时也是OCT的抑制剂,表1列举了人OCT常见的底物和抑制剂[5]。
OCT的组织分布较为广泛[6](见表2)。人OCT1主要在肝脏表达,一般被认为是肝特异性转运体,在其他组织如心、骨骼肌、肾、脑和胎盘等也有弱表达。鼠OCT1除表达在肝外,在肾和小肠中均有高表达。OCT1主要表达在肝细胞的窦膜上,鼠OCT1还表达在小肠细胞的基底膜、近曲小管的S1和S2段上皮细胞基底膜以及气管和支气管上皮细胞管腔膜[7]。OCT2主要表达在肾脏,一般被认为是肾特异性的转运体,但在其他组织如脾、胎盘、小肠、脑和蛛网膜脑也可检测到OCT2存在。在人肾脏中,OCT2水平高于其他转运体,且主要表达在整个近曲小管上皮组织,而在大鼠肾脏中OCT2主要表达在近曲小管的S1和S2段。与OCT1类似,OCT2主要表达在肾小管和肠上皮细胞的基底膜、气管和支气管上皮的管腔膜,脑中OCT2主要表达在蛛网膜上皮细胞的管腔膜[8]。不同的是,OCT1主要集中在肾皮质近曲小管,而OCT2主要分布在外髓质外纹近曲小管,即OCT1和OCT2沿近曲小管差异性分布。OCT1和OCT2被认为是肾有机阳离子分泌必需的转运体。人OCT3主要表达在肌肉、肝、胎盘和心,在其他组织如脑、肺、肠和某些肿瘤组织中也有表达。OCT3主要表达在胎盘滋养体的基底膜、肝细胞窦侧膜、肾近曲小管上皮小细胞基底膜、支气管上皮和肠上皮管腔膜。在鼠脑的海马、最后区、穹窿下器官、内侧下丘脑和第三脑室也有OCT3表达[9]。近年来越来越多的研究表明,虽然OCT在大脑中表达水平较低,但在维持脑内环境稳态方面发挥了重要作用。以下将重点介绍OCT在脑内的分布情况、OCT在脑内内源性物质稳态调控中的作用及其在药理学研究中的意义。

表2 人有机阳离子转运体的组织分布Table 2 Distribution of human organic cation transporters
2 有机阳离子转运体在脑内的分布
OCT在脑中的表达一直存在争议,有研究证明,OCT1和OCT2在FVB小鼠和瑞士小鼠血脑屏障管腔侧不表达[10],在分离的人脑微血管中也不表达[11–12],但是Lin等[13]利用分离的人、小鼠、大鼠的脑微血管内皮细胞和永生化成年大鼠脑内皮细胞,观测OCT1和OCT2的细胞定位,证实OCT1和OCT2均表达于人、小鼠和大鼠脑微血管内皮细胞的管腔侧,并参与90%以上1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)的脑摄取。Wu等[14]研究表明,OCT1和OCT2在血脑屏障上的表达与小鼠品系有关,且与幼鼠相比,老龄小鼠OCT1和OCT2 mRNA及蛋白表达水平均降低。Chaves等[15]同样也研究了小鼠、大鼠和人分离的脑微血管中OCT的表达和功能情况,结果表明,OCT在小鼠、大鼠和人分离的脑微血管中均有表达,但表达量较低。因此,受动物物种、品系和年龄等因素以及检测方法的影响,对OCT在脑内表达情况的认识存在差异是可以理解的。综合现有研究结果来看,比较公认的看法是OCT1和OCT2主要表达于脑微血管内皮细胞的管腔侧,这与其参与血脑屏障处MPTP的摄取功能是一致的。除此之外,OCT2还在皮层、海马、纹状体以及一些皮层下区域表达[16–20],主要表达在神经元和脉络丛细胞[9]。有趣的是,OCT2分布的部分区域也含有丰富的单胺能神经元[19,21],不禁让人猜测OCT2在单胺类递质传递中的作用。与OCT1和OCT2相比,OCT3在脑内分布更加广泛,特异性抗体免疫组化研究显示,在大鼠脑内几乎所有脑区可检测到OCT3至少低水平的表达[22],表达水平相对较高的区域包括皮层、海马、纹状体、下丘脑、丘脑和小脑等[17],主要分布于神经元和胶质细胞[9],这也是OCT3在脑微环境稳态调节中发挥重要作用的基础。表3总结了OCT在人、大鼠和小鼠脑内的分布。

表3 有机阳离子转运体在人、大鼠和小鼠脑内的分布Table 3 Distribution of organic cation transporters in the brains of human, rat and mouse
3 有机阳离子转运体在脑中的作用
OCT在脑中的分布与其维持脑内内源性物质平衡和保护中枢神经系统的作用是一致的。OCT1和OCT2主要分布在血脑屏障的腔侧面,促进阳离子药物和外源性物质通过血脑屏障,而OCT2和OCT3分布于不同脑区的神经元或胶质细胞,调节脑间质内单胺类神经递质、阳离子药物和毒素的浓度。
3.1 在单胺类递质传递中的作用
早期研究表明,OCT参与内源性5-HT、NE和DA等单胺类神经递质的转运,具有高容量、双向转运和低亲和力的特点[25]。
单胺类神经递质在中枢神经控制生理功能和调节情绪、攻击性、性活动、食欲和动机方面起着关键作用。除了神经递质释放和受体激活的机制外,转运体介导的从突触间隙中摄取神经递质以起到清除作用是相关神经回路的关键组成部分。大多数关于单胺摄取的研究都集中在高亲和力钠依赖型转运体上,主要包括多巴胺转运体(dopamine transporter,DAT)、去甲肾上腺素转运体(norepinephrine transporter,NET)和5-羟色胺转运体(serotonin transporter,SERT)等,它们构成单胺转运体的“uptake1家族”[25]。自从人们证明了OCT在脑中表达并可以传递单胺类神经递质之后,OCT便以“uptake2家族”[26]的身份重新被人们认识。OCT2和OCT3作为uptake2单胺转运系统的主要成员[26],在脑内起到单胺类神经递质代偿性清除的作用(见图1)。
研究表明,降低大鼠脑内OCT3的表达可以增加伏隔核和前额叶皮层细胞外DA浓度,增加甲基苯丙胺诱导的依赖于多巴胺能通路激活的多动行为[27]。OCT对皮质酮的抑制作用十分敏感[28],在使用DAT抑制剂之后,皮质酮可急剧降低大鼠伏隔核中DA的清除,快速调节DA信号传导[29]。
Decynium-22(D22)是OCT的阻断剂,可以阻断OCT对脑内单胺类递质的清除,显示出类似抗抑郁作用,而这种作用在高亲和力单胺转运体缺失或被抑制时显得更加明显,例如D22可减少大脑对5-HT的清除,在SERT缺陷小鼠中发挥类似抗抑郁作用,但在野生型小鼠中没有作用[30];D22也能增强氟伏沙明(一种选择性5-HT再摄取抑制剂型的抗抑郁药)对野生型小鼠的抗抑郁作用,但对Slc22a3-/-小鼠没有作用[31]。除此之外,应用皮质酮或去甲变肾上腺素抑制OCT3功能可增加应激状态下大鼠中央杏仁核细胞外5-HT浓度[32],调节大鼠在应激事件中的生理反应和行为。这些数据表明OCT3在5-HT神经传递的稳态调节中发挥重要作用,并部分解释了一些患者对抗抑郁药物的耐药性。一些抗抑郁药物如地西帕明、瑟曲林、帕罗西汀、阿米替林、亚米帕明和氟西汀等均能抑制OCT3活性,说明它们对OCT3活性的抑制作用在一定程度上也是抗抑郁药物整体治疗效果的一部分[33]。
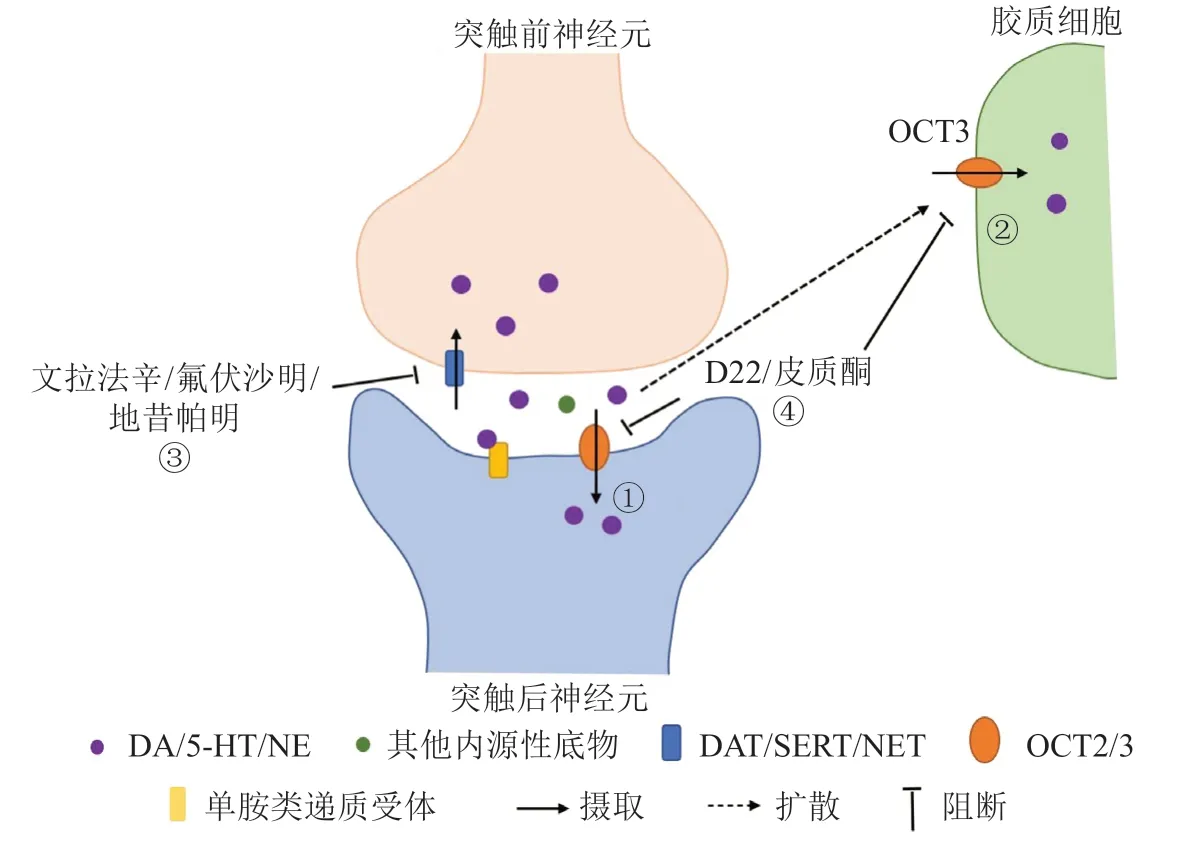
图1 OCT2/3在单胺类递质传递中的作用Figure 1 The role of OCT2/3 in monoamine delivery
文拉法辛是5-HT和NE再摄取抑制剂,在文拉法辛的存在下,Slc22a2-/-小鼠海马内NE和5-HT清除减弱,导致突触后神经元活性的改变[34]。前文提到的D22是OCT的阻断剂,研究表明,D22同样能阻断NE在脑中的清除,从而增强地昔帕明的抗抑郁样作用[35]。
另外,OCT3蛋白还定位于核膜和内膜系统,包括神经元和胶质细胞外周核的泡状结构和线粒体,表明OCT3不仅有助于清除细胞外单胺,还在细胞内单胺的分布和处置中发挥作用[36]。
3.2 影响药物在血脑屏障处的分布
血脑屏障中OCT的功能和表达可能影响底物的转运,从而影响外源性药物和毒性物质在脑中的分布(见图2)。MPTP是一种重要的神经毒素,用于帕金森病动物模型的建立,MPTP经由OCT1和OCT2摄取通过血脑屏障,然后在脑内转化为神经毒素MPP+,沉默OCT1或OCT2的基因或应用OCT1/2抑制剂金刚烷胺均可抑制MPTP的摄取[13–14]。在瑞士小鼠的脑微血管内皮细胞中,OCT1和OCT2的mRNA含量很低,几乎可以忽略[14],这也许可以部分解释C57BL/6小鼠对MPTP引起的神经毒性敏感,而瑞士小鼠具有耐药性[37]。戊烷脒是一种有效的抗锥虫病药物,可用于治疗Ⅰ期人类非洲锥虫病,但戊烷脒在冈比亚锥虫进入中枢系统后作用效果较差,研究发现戊烷脒是OCT1的底物,在管腔侧由OCT1摄取进入脑微血管内皮细胞,随后被P-糖蛋白(P-gp)外排至血液,因此戊烷脒很难通过血脑屏障进入脑内[38]。体外研究表明,拉莫三嗪、普拉克索通过血脑屏障进入脑内是通过OCT1的转运作用实现的[39]。除此之外,氟哌啶醇的2种吡啶类神经毒性代谢物虽在肝脏代谢形成,但在脑内也可以检测到,体外研究发现这2种代谢物都是OCT的底物,这可能是其在脑内积累的原因[40]。
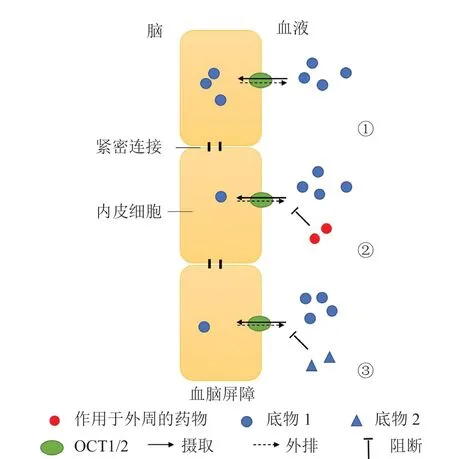
图2 OCT1/2在血脑屏障中的作用Figure 2 The role of OCT1/2 at blood-brain barrier
3.3 与药物的相互作用
大量的内源性和外源性化合物包括精神活性物质已在体外实验中被证明可与OCT相互作用[41],有机阳离子药物在临床使用中十分常见,理论上它们也会干扰大脑的OCT功能。已知作用于中枢神经系统的药物包括精神刺激剂可卡因、安非他明和3,4-亚甲基二氧甲基苯丙胺[17,24]以及大量的抗抑郁药[42]都是潜在的OCT阻断剂。以N-甲基-D-天冬氨酸受体为靶点的药物,无论是高亲和力拮抗剂(如苯环己哌啶和MK801等),还是低亲和力拮抗剂(如氯胺酮、美金刚和金刚烷胺等)都有阻断OCT的作用[17–18]。由于一些药物的脑部浓度可达到血浆浓度的几倍,可以推测,这些药物在较高的脑部浓度下可能对OCT的功能产生影响,例如抗抑郁药安非他酮可抑制人脑OCT2活性[42],抗精神病药物氯氮平和抗焦虑药地西泮可抑制人脑OCT3活性[42–43]。然而,受体内外不同环境的调控作用,这些化合物在体外对OCT的亲和力并不能反映在体内的亲和力,体内实际情况还有待证实。如前所述,OCT参与脑内单胺类递质稳态调控,这些对OCT存在抑制作用的药物是否会影响脑内单胺稳态,这种抑制作用是否对这些药物的临床效果有影响还有待研究。此外,神经毒素DSP-4对OCT表现出强烈的抑制作用,OCT可能是其产生神经毒性的靶标之一[44]。百草枯的一价阳离子(PQ+)是导致多巴胺能神经元毒性的主要物质,它同时是DAT和OCT3的底物,广泛分布于胶质细胞的OCT3可以摄取一部分PQ+进入胶质细胞,从而对PQ+的多巴胺能神经元毒性起到缓冲作用,OCT3缺乏使胶质细胞的缓冲作用减弱,导致进入多巴胺能神经元的PQ+含量增多,从而加剧PQ+对多巴胺能神经元的损伤[45]。
一些在外周发挥作用的药物,也有可能会通过血液扩散而影响脑内OCT功能,例如在体外对OCT有抑制作用的抗病毒药阿昔洛韦、拉米夫定、阿巴卡韦和齐多夫定[46–47],抗糖尿病药二甲双胍[48],细胞抑制剂顺铂[49],抗酸药西咪替丁[50],抗疟药奎宁[51],止痉挛药曲司氯铵[52]等,这些药物如果长期使用可能会影响大脑的OCT功能,导致难以预料的潜在副作用。至于在脑中发挥作用的药物,其在体内对OCT影响的实际情况仍有待证实。
3.4 在脑内的其他作用
压力和下丘脑-垂体-肾上腺皮质轴调节异常被认为是抑郁症和创伤后应激障碍等精神疾病的重要风险因素之一,Slc22a2-/-小鼠在受到压力刺激时释放大量的皮质酮,损害下丘脑-垂体-肾上腺皮质轴功能,从而使机体在不可预测的慢性轻度压力(UCMS)的刺激下更容易表现出抑郁相关行为(包括自我护理、空间记忆、社会互动和应激敏感的自发行为等)[28]。因此,OCT2可能是情感性疾病治疗的潜在药理学靶点[34,53]。
组胺也是脑中重要的神经递质,参与焦虑、睡眠-觉醒周期、食欲、学习和记忆等各种生理功能,组胺的清除主要是在胶质细胞中完成的。研究表明,表达在胶质细胞上的OCT3是组胺的低亲和力转运体,与质膜单胺转运体共同参与突触间隙组胺的清除[54]。
4 结语
随着人们对OCT越来越深入的了解,其在脑中的作用也逐渐被重视,无论是作为低亲和力单胺转运体调控脑中单胺类递质稳态,还是参与血脑屏障中药物的运输,OCT在药理学研究和临床研究中都具有重要意义。另外,人类基因多态性以及其他调节机制对OCT的调控作用,可能影响抑郁或焦虑等情绪相关疾病以及帕金森病和阿尔茨海默病等神经退行性疾病的易感性。基于目前的发现可以预测,长期使用抗糖尿病药、细胞抑制药和抗病毒药物等在外周发挥作用的药物,如果存在对OCT的抑制作用,可能会产生额外的中枢神经系统副作用。在未来,继续研究OCT在调控单胺类递质稳态方面的替代作用,对提高抗抑郁和抗焦虑治疗的疗效和精神类疾病的控制有重要意义。

