Alu基因定量检测用于胃癌转移模型评估的研究
吴朋朋,柳森森,张彩勤,赵勇,白冰,王洁,师长宏*
(1.空军军医大学实验动物中心,西安 710032;2.空军军医大学基础医学院,西安 710032)
Alu家族是一种仅存在于灵长类基因组中的散布重复序列,可用于检测各种遗传改变[1]。1989年,Nelson等[2]首先提出Alu-PCR技术,用于不同种属的遗传多态性分析(Alu重复序列之间碱基序列的插入,缺失,易位和引发位点的突变等),且能够显示个体间的差异。Alu-PCR是一种非常敏感的检测方法,能够从大量鼠类组织样品中准确灵敏地检测出人的肿瘤细胞,甚至可以从石蜡包埋组织切片提取的DNA中检测出Alu重复序列[3],从而量化肿瘤细胞[4]。Schneider等[5]采用了更加灵敏的实时荧光定量PCR方法,重新设计了针对人Alu序列的特异性定量引物,发现可以从相当于1×106个小鼠细胞中检测出一个人类肿瘤细胞,适合于扩增不同肿瘤细胞中的Alu序列。这说明Alu序列的物种特异性和高度重复性可用于人类基因组DNA的敏感定量分析。
胃癌(gastric cancer,GC)是全世界最常见的恶性肿瘤,在中国癌症致死的相关病例中,胃癌排在首位[6]。尽管胃癌在手术和其他辅助治疗上取得了不错的进展,其侵袭和易转移的特性使得多数患者诊时就已达到中晚期,甚至出现远端转移,极大的影响了治疗效果,使患者的生存质量降低。胃癌早期转移的发生无法预测,且胃癌转移标本采集困难,仅仅依据临床表现、手术及用药效果来评价胃癌预后已很难满足治疗肿瘤的需求[7-8]。
胃癌的异种移植模型能够模拟人胃癌在体内的发生、发展及转移等一系列生物学特性,是研究胃癌的一个重要工具[9]。本课题组前期将临床胃癌患者新鲜的手术标本移植到裸鼠体内成功建立了人胃癌裸鼠转移模型(patient derived xenograft,PDX),不仅形成移植瘤,而且成功检测到了肝转移和肺转移病灶,该模型为临床胃癌的转移研究提供了有效的个体化转移模型[10]。由于Alu序列特异性存在于人类组织中,当小鼠组织中有人类肿瘤细胞所形成的转移灶,则可通过RT-PCR检测人Alu基因序列的表达来评估肿瘤在小鼠组织脏器的转移程度[11]。因此,本研究通过设计人Alu基因特异性引物,经RT-PCR检测不同胃癌裸鼠转移模型各组织人Alu基因的表达,分析其与裸鼠各组织胃癌细胞转移程度的关系,为评估胃癌转移模型中各组织胃癌转移瘤的转移程度,以及胃癌转移动物模型的评估提供有效的分子生物学方法。
1 材料与方法
1.1 材料
1.1.1 实验动物
60只6~7周龄SPF级雄性裸鼠,体重22~25 g,购自北京维通利华生物技术有限公司【SCXK(京)2016-0011】,饲养在中国人民解放军空军军医大学实验动物中心屏障设施内【SYXK(陕)2019-001】。环境温度20~26℃,相对湿度40%~70%,12 h光照/12 h黑暗,饲料经辐照处理,饮用水经高压灭菌处理,实验鼠自由摄食和饮水。动物实验通过了空军军医大学实验动物福利及伦理委员会批准(审批号:20180512)。
1.1.2 细胞及肿瘤样本
人胃癌细胞SGC-7901、MKN45及人正常胃黏膜细胞GES1购买于国家实验细胞资源共享平台,小鼠成纤维细胞(L929)为本实验室保存。细胞培养条件为RPMI-1640培养基(10%胎牛血清+1%青链霉素),37℃、5%CO2孵箱中培养。
临床胃癌标本来自空军军医大学西京消化病医院,肿瘤标本的取得经过患者本人及家属同意,并签署知情同意书,相应实验通过西京医院医学伦理委员会的批准(审批号:2015432)。
1.1.3 主要试剂与仪器
基质胶(Matrigel Matrix)由美国BD公司生产;异氟烷购自深圳瑞沃德生命科技有限公司;RPMI-1640培养基和0.05%胰酶购自美国HyClone公司;胎牛血清购自浙江天杭生物科技股份有限公司;苏木精和伊红染色液购自北京Leagene生物技术有限公司;基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒和质粒DNA提取试剂盒购买于北京天根生化科技有限公司;荧光定量PCR及质粒构建等分子生物相关试剂均购自大连宝生物工程有限公司。酶标仪(Biotek Take,美国);基因扩增仪(eppendorf,德国);荧光定量PCR仪(StepOne Plus,Thermo Fisher,美国)等。
1.2 方法
1.2.1 Alu基因扩增及标准质粒的构建
根据NCBI人类基因组DNA中的Alu基因(XR_948994)序列以及相关文献[12-13],设计并合成特异性引物(表1),提取人胃癌细胞SGC-7901、MKN45和正常胃黏膜细胞GES1基因组DNA,按PrimeSTAR® HS DNA Polymerase操作说明,PCR扩增Alu基因(Alu865引物)。琼脂糖凝胶电泳鉴定正确后,用DNA回收试剂盒回收目的基因(865 bp)并克隆至pMD19-T载体中,连接产物转化至E.coli Competent Cell JM109。转化菌提取质粒经酶切鉴定正确后,由宝生物工程(大连)有限公司用pMD18-R测序引物进行测序。
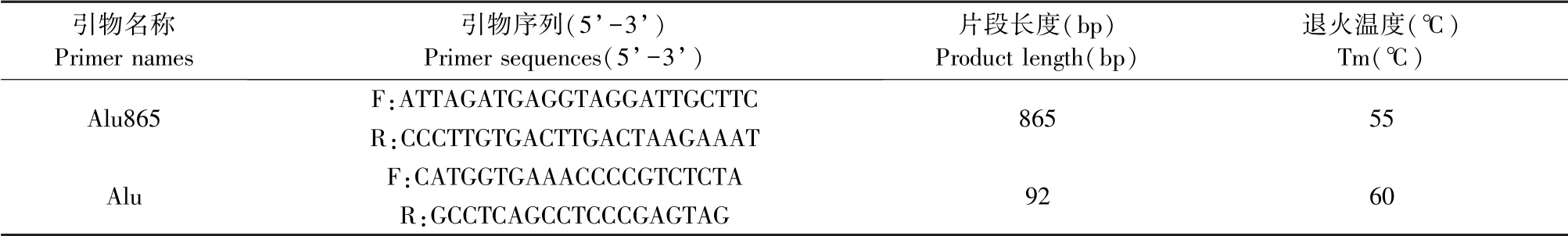
表1 引物序列信息Table 1 Information of the primer sequences
1.2.2 绘制Alu基因表达标准曲线
将Alu基因标准质粒梯度稀释为不同浓度(50、10、2、0.4、0.08、0.016、0.0032 ng/μL),去离子水为阴性对照组(NTC),按SYBR® Premix Ex TaqTMII操作说明进行Alu基因的定量检测(Alu引物)。每组样本检测3次,每次检测均做3个复孔,最终Ct值以平均数表示(以下Ct值均相同),根据拷贝数计算公式计算待测样本中Alu基因的拷贝数[14]。
Alu基因拷贝数(copies/μL)=[质粒浓度(ng/μL)×1μL]×10-9×(6.02×1023copies/mol)/[(质粒分子量+插入片段分子量)×660]
1.2.3 不同比例胃癌肿瘤细胞(SGC-7901)中Alu基因的检测
在小鼠成纤维细胞(L929)悬液中混合胃癌肿瘤细胞(SGC-7901),使得L929细胞中SGC-7901细胞的百分比分别达到0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%。提取各组的基因组DNA,测定每组Alu基因的Ct值并绘制标准曲线。
1.2.4 胃癌裸鼠转移模型的制备及人Alu基因的检测
选取SGC-7901和MKN45胃癌细胞,分别用无菌PBS将细胞稀释成1×107/0.2 mL细胞悬液接种到10只6~8周龄的裸鼠皮下,继续饲养观察。每周测量1次肿瘤体积,肿瘤体积计算公式采用V=1/2×l×w2,其中l为肿瘤最长直径,w为肿瘤最短直径。肿瘤生长至约1000 mm3,将模型鼠安乐死后采集每只裸鼠的肝、脾、肺、肾和皮下肿瘤组织,取部分样本用4%多聚甲醛固定,用于病理切片染色观察和肿瘤相关标志物免疫组化检测;部分样本提取基因组DNA进行人Alu基因的测定。
1.2.5 Alu基因检测评估人胃癌病人异种移植模型转移趋势
将采集的3例临床胃癌患者新鲜肿瘤标本(C26284、C72448和C61262)用剪刀修整为直径1 mm左右的组织块,与基质胶1∶1混匀后用套管针注射于6~8周龄的裸鼠皮下,伤口消毒后继续饲养观察。同时裸鼠尾静脉注射胃癌细胞(SGC-7901)作为胃癌转移模型阳性对照组,正常裸鼠作为阴性对照组。待肿瘤生长至1000 mm3后,模型鼠进行安乐死,采集裸鼠肝、脾、肺、肾和皮下肿瘤,取部分样本组织用4%多聚甲醛固定,用于病理切片染色观察;部分组织提取基因组DNA,用于人Alu基因的检测分析。
1.3 统计学分析
统计分析采用SPSS 18.0软件进行统计学分析。各组数据以平均值±标准差(±s)表示,组间比较采用t检验,以P<0.05为差异具有显著性,P<0.01为差异极具有显著性。
2 结果
2.1 Alu基因扩增及标准质粒的构建
以人胃癌细胞基因组DNA为模板构建的Alu基因标准质粒,经PCR鉴定和Alu基因序列测序,结果与NCBI的Alu序列完全相符(见图1),说明了本研究设计的Alu引物具有较好的特异性且Alu基因广泛存在于人胃癌细胞及肿瘤组织中。
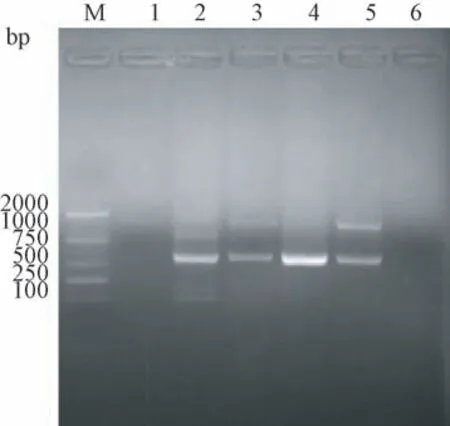
图1 各细胞系中Alu基因的扩增Note.M.DL2000 DNA Marker.1.Genomic DNA of mouse.2.SGC-7901.3.MKN45.4.GES1.5.Genomic DNA of gastric cancer tumors.6.Negative control.Figure 1 PCR amplification of Alu gene in the gastric cancer cell lines
2.2 Alu基因标准曲线的绘制
实时定量PCR检测不同浓度质粒Alu基因的Ct值绘制标准曲线,并根据拷贝数计算公式计算待测样本中Alu基因的拷贝数。结果显示,Alu基因的Ct值与其拷贝数呈负线性相关(R2=0.9979),即Alu基因的Ct值越低,其拷贝数越高(见图2、表2)。
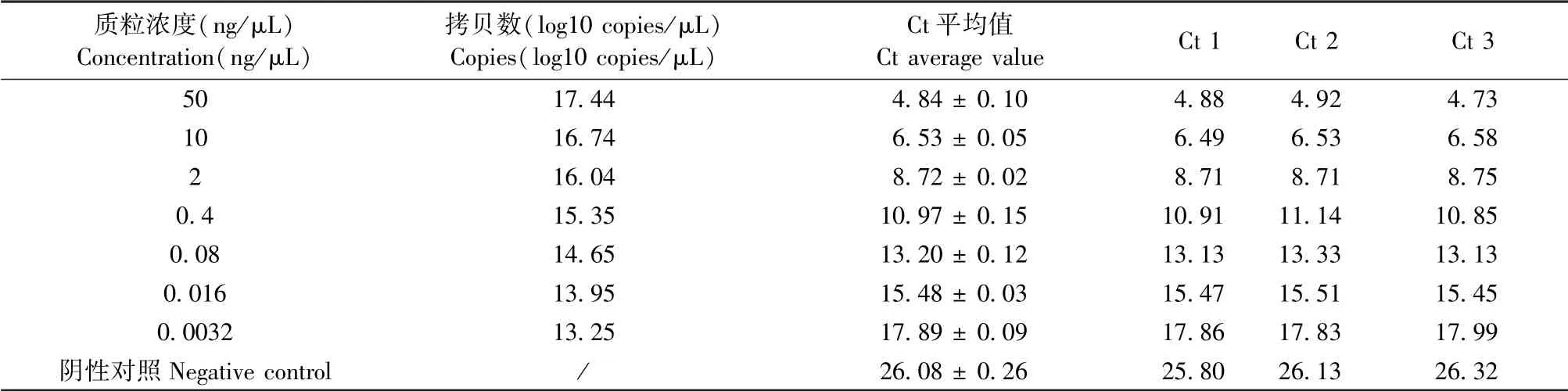
表2 不同浓度标准质粒Alu基因的表达Table 2 Alu gene expression in different concentration of Alu plasmids
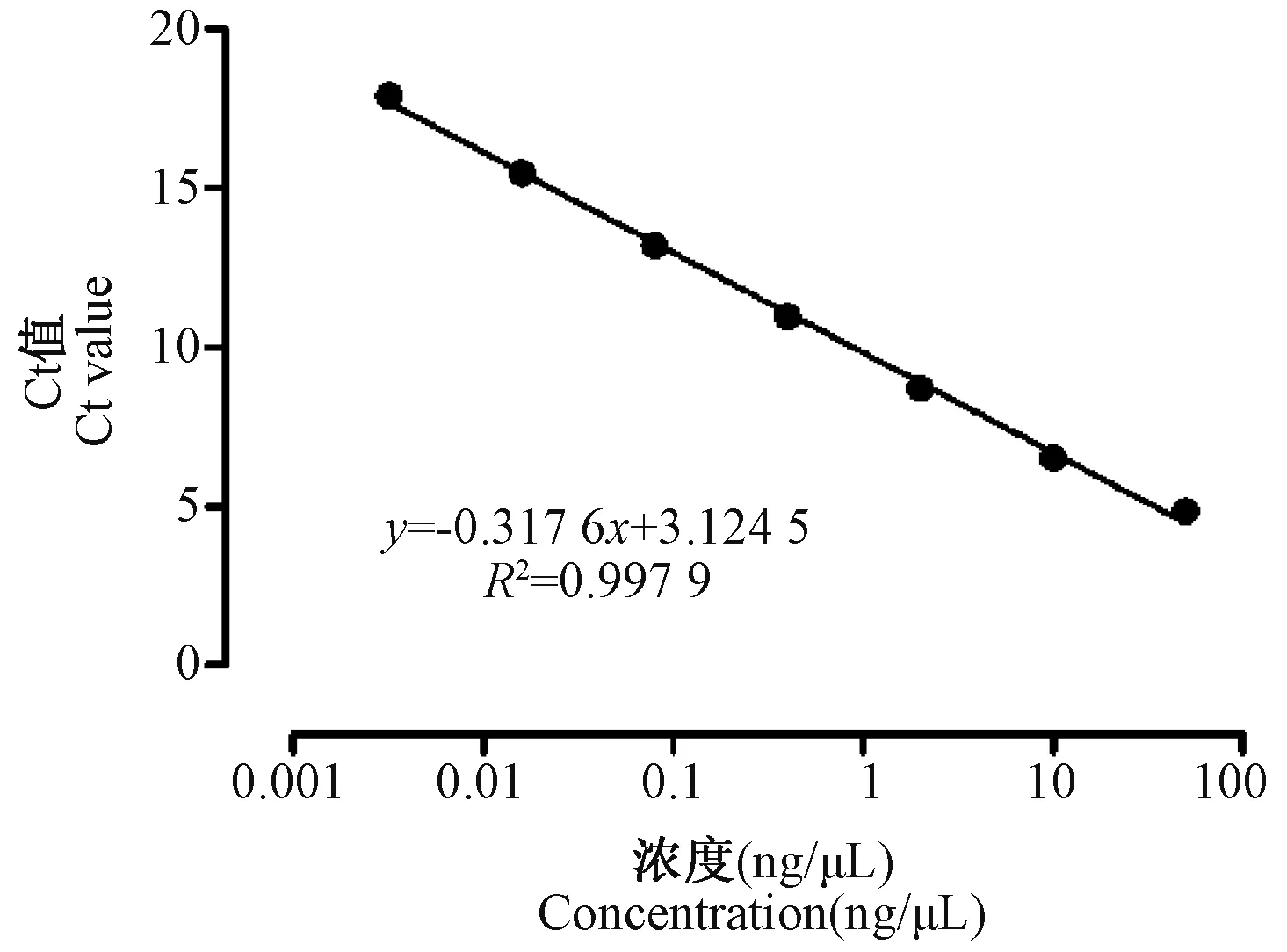
图2 Alu基因标准曲线Figure 2 Standard curve of Alu
2.3 不同比例胃癌细胞(SGC-7901)中Alu基因的检测
梯度调整小鼠成纤维细胞(L929)悬液中胃癌细胞(SGC-7901)的百分比,测定每组人Alu基因的表达情况并绘制标准曲线。结果显示(图3,表3)Alu基因的Ct值与胃癌细胞(SGC-7901)的百分比呈负相关(R2=0.9239),即细胞混合液中胃癌细胞含量越低,Alu基因的拷贝数越低,Alu基因的Ct值越高。
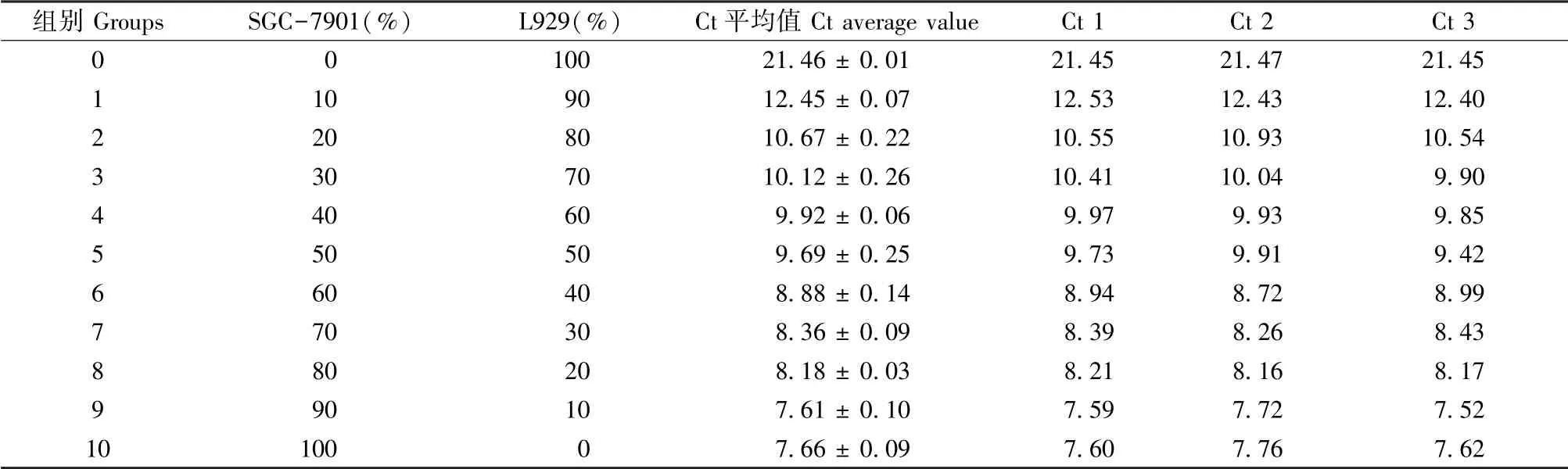
表3 不同浓度SGC-7901细胞中Alu基因的表达Table 3 Expression of Alu in different concentrations of SGC-7901
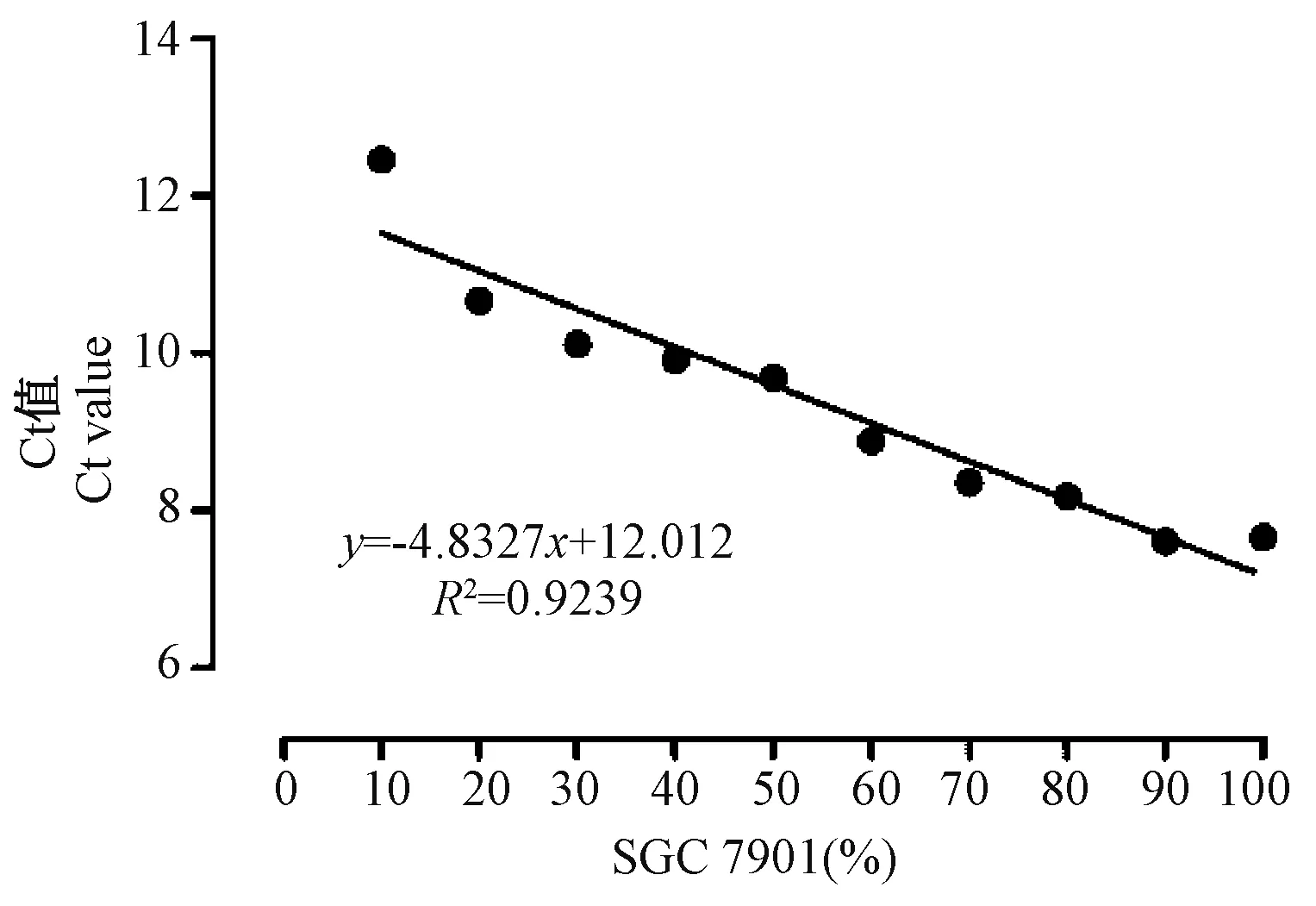
图3 SGC-7901细胞Alu基因表达标准曲线Figure 3 Standard curve of Alu in SGC-7901
2.4 人胃癌异种移植转移模型的构建及Alu基因的检测
将胃癌细胞(SGC-7901和MKN45)构建的CDX模型鼠安乐死并解剖观察,结果发现荷瘤鼠除皮下形成明显的肿瘤外,肉眼可看到部分裸鼠在肝、肺部有肿瘤转移灶(图4 MKN45和SGC-7901细胞模型组左侧图)。用临床获得的新鲜胃癌手术标本构建的PDX模型(C26284、C72448和C61262)也发现了肺和肝部转移灶(图4 C26284、C72448和C61262病人肿瘤模型组左侧图)。HE染色观察(图4各模型组右侧图)可见肺和肝组织中有明显的肿瘤侵入形态结构,肿瘤组织腺体生长丰富,肿瘤细胞处于增殖旺盛阶段,符合胃腺癌的特征。病理结果均显示裸鼠组织中出现的转移灶与原发肿瘤保持了相同的组织结构。
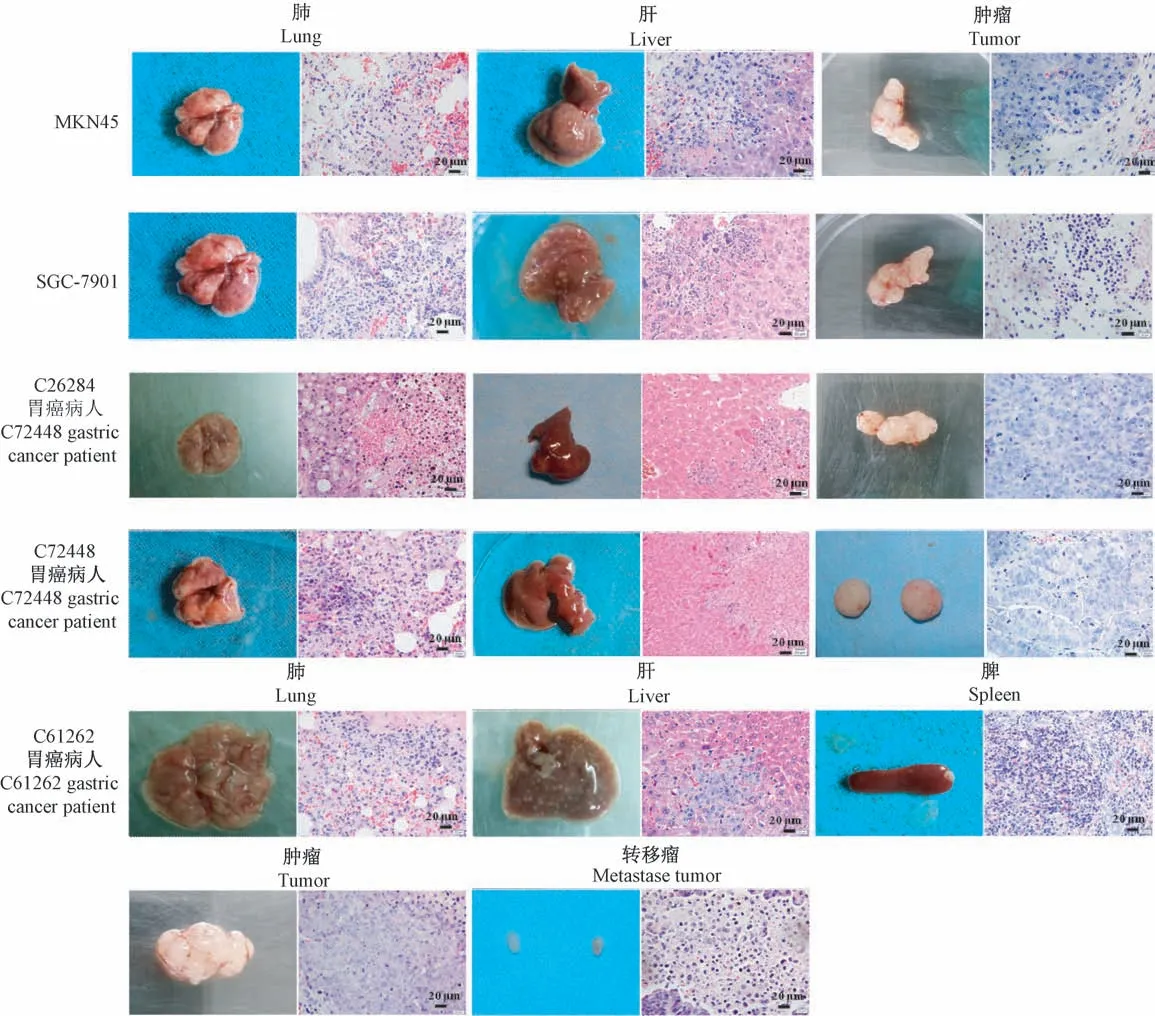
图4 胃癌小鼠模型转移瘤的形态和组织结构Note.Left side of each group is the metastatic tumor morphology,right side is the HE staining result of metastatic organ tissue.Figure 4 Morphology and tissue structure of metastatic tumor
进一步检测胃癌细胞(SGC-7901和MKN45)构建的CDX模型鼠肝、脾、肺、肾及皮下肿瘤组织中的人Alu基因表达,正常未接种肿瘤的裸鼠作为阴性对照(表4)。结果显示SGC-7901组人Alu基因高表达主要发生在肺(Ct值13.88);MKN45组则主要发生在肝(Ct值13.21)和肺(Ct值16.61),而其他组织脏器人Alu基因Ct值均大于17(脾,Ct值17.86;肾,Ct值17.93),这与组织学检查和解剖观察的脏器转移结果相符。

表4 不同小鼠器官人Alu基因的表达Table 4 Expression of Alu gene in different mice organs
将各样本按器官来源重新分组,结果显示(图5):胃癌细胞Alu基因的Ct值为4.56~8.50;皮下肿瘤为7.21~9.92;肺转移瘤为13.88~17.93;肝转移瘤为12.61~17.86;裸鼠各脏器组织Ct值为20.67~23.66;阴性对照为26.66~27.66。说明人Alu基因的表达在胃癌细胞和肿瘤细胞丰富的皮下肿瘤中处于较高水平;在正常裸鼠各脏器组织中表达最低;发生肿瘤转移的肺和肝中人Alu基因的表达则介于正常裸鼠与皮下肿瘤之间,这也与组织病理学检查结果相符。
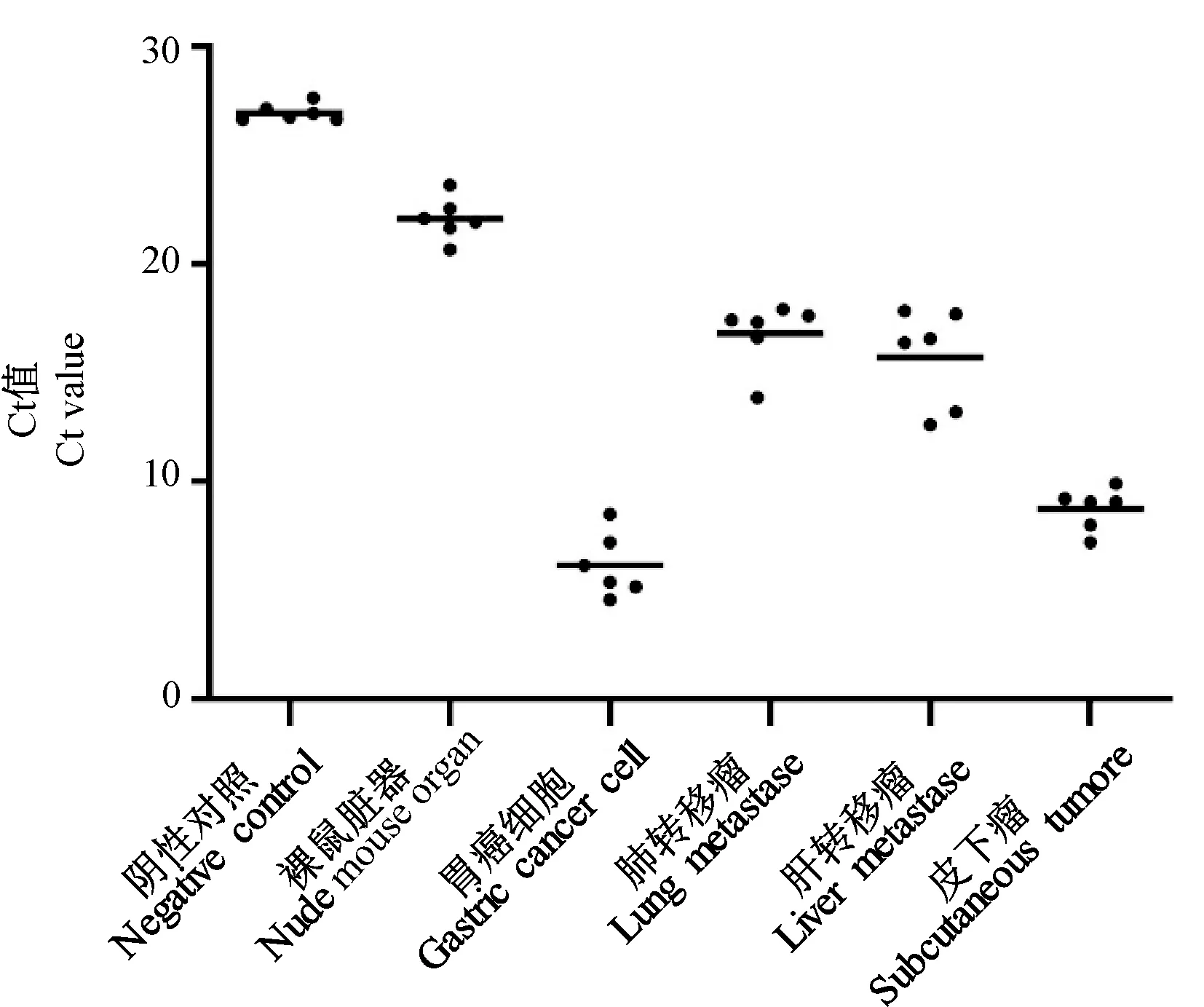
图5 不同组织样本人Alu基因的表达Figure 5 Expression of Alu gene in different sources tissues
2.5 人Alu基因检测评估胃癌病人异种移植模型转移趋势
收集胃癌病人异种移植模型鼠的肝、脾、肺、肾及皮下肿瘤组织并检测人Alu基因的表达,结果显示(表5、图6):SGC-7901组转移主要发生在肺(Ct值11.85);C61262组转移主要发生在肝(Ct值13.88)和肺(Ct值14.28);C26284组转移主要发生在肺(Ct值15.74);C72448组转移主要发生在肝(Ct值13.02)和肾(Ct值13.69),这与组织学检查和解剖观察发现肿瘤转移主要发生在肝和肺部结果相符。
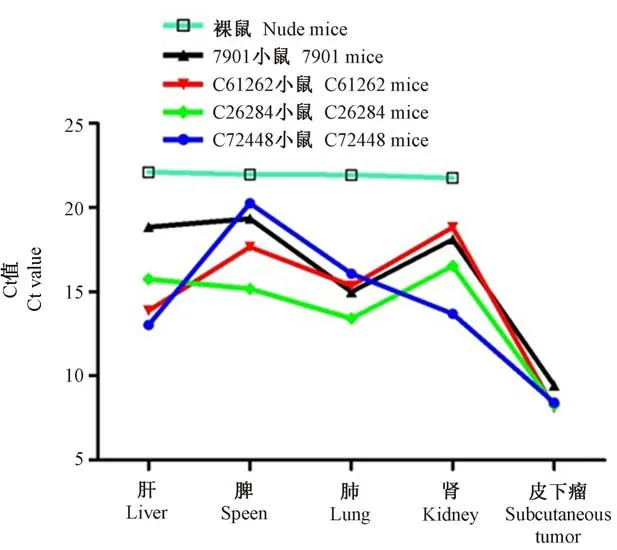
图6 不同胃癌转移模型小鼠组织中人Alu基因的表达Figure 6 Expression of Alu gene in gastric cancer metastatic mice organs
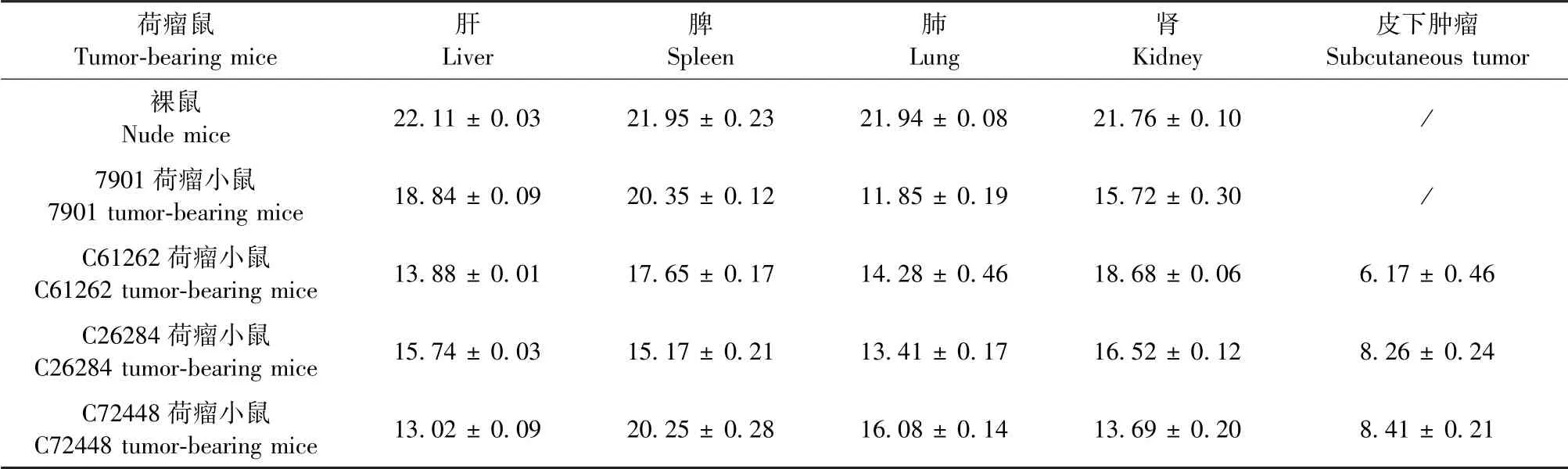
表5 胃癌转移小鼠各器官人Alu基因的表达Table 5 Expression of Alu gene in gastric cancer metastatic mice organs
选取组织学检查中已经明确发现胃癌转移细胞的组织样本(HE染色和胃癌肿瘤相关标志物CEA、CA19-9均为阳性),按照解剖中能否发现转移灶重新分组,结果显示(见图7):相比于皮下肿瘤组织(Ct值9.29),未形成转移灶的组织(Ct值17.86)与健康裸鼠组织(Ct值22.18)差异显著(P<0.05),而形成转移灶的组织(Ct值14.29)差异极显著(P<0.01)。进一步说明了人Alu基因的表达与胃癌转移模型各组织胃癌转移程度呈正相关,Alu基因表达越高(Ct值越低),该组织中转移的肿瘤细胞就越多,形成的肿瘤转移灶越明显。

图7 不同转移程度组织样本Alu基因的表达Figure 7 Expression of Alu gene in different metastasis tissues
3 讨论
本课题组先后用人胃癌细胞SGC-7901和MKN45建立了细胞系移植(CDX)模型,用胃癌临床手术标本获得的3例PDX模型(C26284、C72448和C61262),经过多次传代筛选后该模型发生了肺部和肝部转移,转移灶病理切片的HE染色确定符合胃腺癌的特征。
Funakoshi等[15]开发了一种基于Alu的高灵敏度和特异性的实时PCR方法,用于区分人类细胞和啮齿动物细胞,可以从100 ng的人类和啮齿动物混合基因组DNA中检测到1个fg的人Alu基因,相当于1亿个啮齿动物细胞中有1个人类细胞。而Schneider等[5]也发现在人类异种移植的106个小鼠血细胞中可以很容易地检测到一个人类癌细胞。Nehmann等[16]在比较了Alu实时定量聚合酶链式反应(qRT-PCR)和激光扫描细胞术(LSC)两种方法检测小鼠外周血中人HT29结肠癌细胞的有效性时发现,无论加入多少癌细胞,使用qRT-PCR在所有样本中都能正确地检测出小鼠血液中几乎100%的人类癌细胞数量,也进一步确认了通过PCR检测人Alu基因的表达来直接监测转移部位的肿瘤负荷的可行性。
本研究就是在Schneider等[5]方法的基础上,重新设计人Alu基因特异性引物序列,通过实时定量PCR特异性检测胃癌裸鼠转移模型各组织中人Alu基因的表达。为了确定精确测定Alu基因的拷贝数,以人胃癌细胞基因组DNA为模板构建了Alu基因标准质粒,RT-PCR检测后发现Alu基因的拷贝数随着各组中标准质粒浓度的增加而增加(R2=0.99),即Alu基因的Ct值越低,其拷贝数则越高。同时,随着小鼠成纤维细胞(L929)中胃癌肿瘤细胞(SGC-7901)含量的增加人Alu基因的表达也呈逐步上升的现象(R2=0.92),这与Zubair等[17]在小鼠的脾、肺和肝中检测到注射的人淋巴瘤细胞的研究结果相符。也说明了细胞混合液中胃癌细胞含量越低,人Alu基因的拷贝数也越低。
在建立的人胃癌细胞异种移植转移模型鼠(SGC-7901和MKN45)各个脏器中,人Alu基因在胃癌细胞(Ct值为4.56~8.50)和肿瘤细胞丰富的皮下肿瘤(Ct值为7.21~9.92)均处于较高的表达水平,在正常裸鼠各脏器组织中表达最低;而在肺转移瘤(Ct值为13.88~17.93)和肝转移瘤(Ct值为12.61~17.86)中人Alu基因表达则处于正常裸鼠和皮下肿瘤两者之间,不仅与组织学检查(HE染色)结果相符,而且与Schneider等[5]发现“在携带肿瘤的小鼠中,Alu信号随着时间的推移在转移器官中逐步增加,且在高转移的肿瘤细胞中,这种增加更为明显”的结果相一致。
通过PDX模型进一步确认了上述规律,而且发现病理学分析已明确发生转移的组织样本中,虽然未形成肉眼可见转移灶,但其Ct值(17.86)与正常裸鼠组织Ct值(22.18)具有显著差异性(P<0.05),而肉眼可见的转移灶中Ct值(均值为14.29),则差异极具显著性(P<0.01)。这说明在准确判定转移的前提下(与组织学检查结果一致),该方法不仅能够检测肿瘤细胞丰富的组织样本(皮下肿瘤组织,肉眼可见转移灶的组织),也能够有效的从发生转移的组织中区分早期转移的肿瘤细胞,进一步验证了该方法具有极高的灵敏度,也证明了人Alu基因的表达与转移部位的肿瘤负荷呈线性相关。这也与Lange等[18]在PDX肿瘤传代中发现随着时间的推移,检测到小鼠血液、肺和肝中肿瘤细胞的数量与转移进展直接相关,但在骨髓或脑中观察不到这种相关性的结果相一致。当然,由于目前基于临床胃癌病人的PDX转移模数量型有限,还不能精确确定胃癌转移模型鼠发生肿瘤转移的组织与未发生转移组织人Alu基因的Ct值界限,本实验室将会深入细致研究人Alu基因检测在胃癌转移模型转移程度预测中的应用。
综上所述,通过荧光定量PCR检测了人胃癌裸鼠转移模型中各组织人Alu基因的表达,结果发现人Alu基因表达越高,组织中转移的胃癌肿瘤细胞越多,转移灶越明显。本研究为评估胃癌转移模型中各组织胃癌转移瘤的转移程度,以及胃癌转移动物模型的评估提供可靠的分子生物学参考方法。