持续高血压状态自发性高血压大鼠血清代谢组学研究
吴佳芸,李玲玲,乔佳君,朱春临,李瑞菡,景瑞青,黄力
(1.北京中医药大学,北京 100029;2.中日友好医院,北京 100029)
高血压病是多基因与多因素共同作用、影响机体正常代谢的异质性疾病。据预计,到2025年,全球高血压患者人数将增至15.6亿[1]。高血压是导致心血管病、慢性肾病、糖尿病等疾病的重要危险因素。2010年,高血压导致的人口死亡已超过全球人口总死亡的40%[2]。高血压俨然已位列危及人类健康的疾病榜首,深入剖析其发病机理以便于寻找有效控压、阻止其进展的关键法门是亟待解决的重要问题。近些年来,尽管学者们对高血压发病的原因展开了大量的研究,但具体的发生和发展机制尚未完全明确。代谢组学是通过高通量分析手段如1H核磁共振、液相色谱质谱等研究机体体内代谢特征的一种系统方法。与其他组学方法不同,代谢组学中代谢物及其浓度能全面表征分子表型,直接反映疾病状态、细胞或组织的状态与生化活性或对所施加刺激或干扰作出的反应[3-4]。因此,其有望成为发现与高血压发病相关的代谢物表型及进一步挖掘其分子发病机制的有效方法。自发性高血压大鼠(spontaneously hypertensive rats,SHR)是高血压研究中使用最广泛、病理生理过程最接近于人类发病的动物模型,通过对比其与血压正常的魏-凯二氏大鼠(Wistar-Kyoto rats,WKY)可以识别出与高血压病有关的变化[5]。
然而,目前以SHR为对象的代谢组学研究观察时间大多为4周左右且多以比较药物干预效果的研究为主[6-9],缺乏对于长期高血压状态下SHR血清代谢组变化及特点的探索和研究。事实上,临床中长期处于高血压状态(血压未控制或控制不达标)的患者常占据多数[10],且由于早期无症状,多数患者往往无法及时确诊。而碍于伦理及诸多客观因素限制,观察持续高血压状态对人体血清代谢组学的改变与特点存在一定难度,因此本研究拟利用SHR模型,通过超高效液相色谱-质谱联用(ultrahigh performance liquid mass spectrometry and tandem mass spectrometry,UPLC-MS)的方法探究长期高血压状态下血清代谢物变化,从小分子代谢层面阐释持续血压升高对SHR的影响,寻找高血压病的潜在生物标志物,挖掘高血压致病的作用点,为临床诊断和治疗高血压提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
随机获取SPF级8周龄雄性SHR和同周龄雄性WKY大鼠各6只,SHR体重约180~200 g,设为模型组,WKY大鼠体重约185~205 g,设为对照组。所有大鼠均购自北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】。以标准饲料将所全部大鼠分笼饲养于中日友好医院临研所动物实验中心SPF级实验室【SYXK(京)2016-0043】,每笼3只,环境适宜,温度在(25±3)℃左右,湿度波动于45%~55%之间,通风良好,光照时间12 h按时交替,无异常噪音刺激,可自由获取水和食物。动物饲养全程均严格按照中日友好医院伦理委员会要求(审批号:No.180209)。
1.1.2 主要试剂与仪器
冷冻生理盐水(0.9%NaCl);4%甲醛溶液;伊红-苏木素(hematoxylin-eosin,HE)染料;Masson三色染色液;标准品(色谱纯,昆明BioBioPha公司/德国Sigma-Aldrich公司);甲醇(色谱纯,美国Merck公司,货号I1014107923);乙腈(色谱纯,美国Merck公司,货号JB0886630)。
BP 2000小动物无创血压分析系统(美国Visitech Systems公司);石蜡切片机(日本SAKURA公司);台式高速冷冻离心机(德国Eppendorf公司);正置光学显微镜(日本Olympus公司);QTRAP 6500+三重四级杆质谱(美国SCIEX公司);超高效液相色谱(日本SHIMADZU公司);色谱柱(美国Waters公司)。
1.2 方法
1.2.1 一般特征
各组大鼠毛发颜色、营养和精神状态、体重、进食饮水、打斗以及大便情况。
1.2.2 血压
在大鼠清醒、环境安静的前提下,每周于同一时间、同一通道将其置于39℃鼠BP2000平台固定器中,放置约10 min(使大鼠适应、尾动脉充分扩张),再测量其尾动脉SBP。取第0、30、60、90、120天的血压结果用于分析,其中每个时间点每组大鼠连续检测20组收缩压(systolic blood pressure,SBP)值,最终选取波形更理想的6组数据的均值作为计算值。
1.2.3 HE染色和Masson染色
3%戊巴比妥(1 mL/kg)腹腔注射使大鼠麻醉,腹主动脉采血后用10 mL注射器抽取冷冻生理盐水于左心房注入,灌注至主动脉管腔接近呈于蛋白透明,迅速解离心脏,用冰盐水再次清洗,其后垂直于心脏左室中轴约上中1/3处切取横断组织约1 cm,放入4%甲醛溶液中,固定24~72 h后进行脱水、石蜡包埋、切片(3 mm),完成HE染色和Masson染色,封片后镜下观察。
1.2.4 血清采集及代谢组学检测
禁食24 h,3%戊巴比妥(1 mL/kg)腹腔注射麻醉后经腹主动脉采血,室温静置2 h,3000 r/min离心10 min后取上清液,分装后冻于-80℃。取出时先置于冰上解冻并混匀。取50 μL样本并按照1∶3比例加入预冷的冰甲醇(含内标)。涡旋3 min,12 000 r/min、4℃离心10 min后取上清液,同样条件再离心5 min,得到上清液用于分析。
液相条件:HSST3 C18 1.8μm(2.1 mm×100 mm)色谱柱;柱温40℃;流速0.4 mL/min;进样量2μL样。流动相A为水(0.04%乙酸):B为乙腈(0.04%乙酸);洗脱顺序为0 min,95∶5 V/V;11 min,5∶95 V/V;12 min,5∶95 V/V;12.1 min,95∶5 V/V和14 min,95∶5 V/V。同时为保证检测的稳定性和可重复性,每10个检测分析样本中插入1个由所有样本提取液混合而成的质控样本。质谱条件:电喷雾离子源(electrospray ionization,ESI)温度为500℃,离子源检测分为正负离子模式,离子喷雾电压分别为+5.5 kV和-4.5 kV,离子源气体I设为55 psi,气体II为60 psi,气帘气为25.0 psi。另,设置碰撞诱导电离参数为高。
1.3 统计学分析
数据经预处理后使用R包(www.r-project.org)完成主成分分析(principle component analysis,PCA)、聚类热图、Pearson相关性热图等,并利用MetaboAnalyst R完成正交偏最小二乘判别分析(orthogonal partial least square discriminant analysis,OPLS-DA)。在变量重要性投影(variable importance in projection,VIP)>1的筛选标准基础上用SPSS 22对上述差异性代谢标志物进行单变量统计分析,最终取VIP>1且P<0.05的代谢物作为标志性差异代谢物。通过迈维代谢数据库(Metware database,MWDB)数据库和京东基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)(http://www.genome.jp/kegg/)数据库对其进行注释和通路富集分析。统计分析时,符合正态分布的计量资料平均值±标准差(±s)表示。两组比较采用t检验,非正态计量资料采用非参数检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 各组大鼠一般情况
模型组大鼠体重与对照组相比,饲养120 d后体重增加较少,两组大鼠体重存在显著差异(P<0.05)(见图1);模型组大鼠毛发偏黄、粗糙欠光泽,精神较对照组亢奋,反应迅速,对光、声音等刺激敏感,情绪较为急躁,经常打斗,部分皮肤可见抓痕或血痂且有咬人倾向,进食多而饮水较少,大便成形且偏硬;对照组大鼠毛发较白且有光泽、精神平和、反应适中、情绪温和稳定、打斗较少、饮水进食均适中、大便较正常。

图1 饲养120 d前后两组大鼠体重比较Note.Compared with control group,*P<0.05.Figure 1 Comparison of rats weight before and after 120 d standard feeding
2.2 不同时间点两组大鼠SBP比较
模型组大鼠SBP在第0、30、60、90、120天5个时间点均高于对照组(P<0.001),差异具有显著性(见表1)。8~12周龄期间,对照组与模型组大鼠SBP均呈逐步升高趋势;对照组大鼠自12周龄开始SBP即趋于稳定,至24周龄SBP变化很小;而模型组大鼠SBP则在经历12~16周龄的短暂稳定期后,于20周龄时再次达到新高峰,后又趋于新的稳定。
表1 各组大鼠各不同时间点SBP比较(±s,mmHg)Table 1 SBP of rats in each group at different time periods(±s,mmHg)

表1 各组大鼠各不同时间点SBP比较(±s,mmHg)Table 1 SBP of rats in each group at different time periods(±s,mmHg)
注:与对照组比较,***P<0.001。Note.Compared with the control group,***P<0.001.
组别Groups 0 d 30 d 60 d 90 d 120 d对照组Control group 166.33±5.47 181.00±13.08 179.67±12.47 179.83±6.31 178.67±6.86模型组Model group 212.33±10.65*** 220.50±6.25*** 221.83±10.96*** 229.33±6.74*** 230.17±7.86***P值P value <0.001 <0.001 <0.001 <0.001 <0.001
2.3 血管HE染色与心肌组织Masson染色结果
与对照组相比,模型组大鼠HE染色结果可见心肌组织排列紊乱,部分已失去正常形态,肌间散布均质粉染物质,提示心肌出现纤维化;肌间血管管壁增厚,管腔变窄,管腔周围可见均质粉染物质,提示血管周围存在纤维化;同时,心肌组织Masson染色结果显示:模型组心肌组织较对照组而言,出现广泛而大量的胶原纤维沉积(呈蓝色)(见图2)。
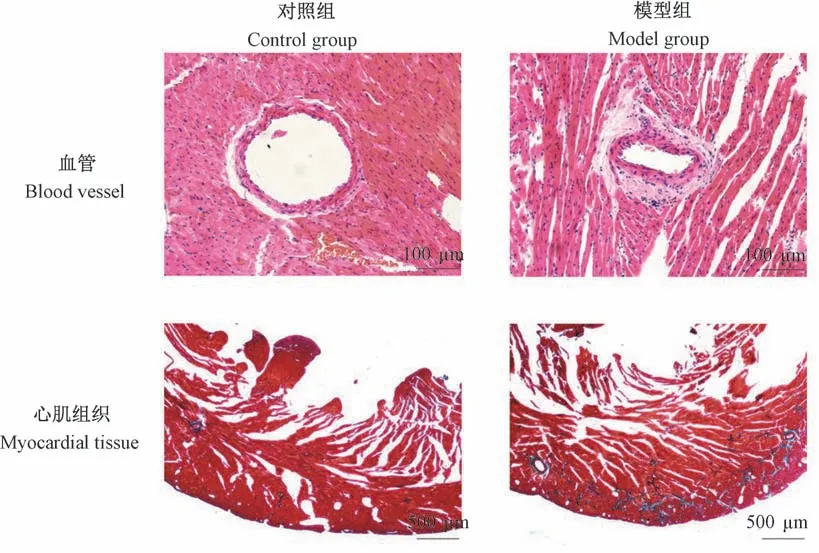
图2 血管、心肌组织病理染色结果Figure 2 Pathological staining results of vessels and myocardium
2.4 血清UPLC-MS代谢轮廓谱
如图3所示,正负离子模式下代谢轮廓谱比较,负离子模式下对照组和模型组之间差异较为明显,而总离子流图(total ions chromatography,TIC)也有较大区别,这提示两组大鼠血清的代谢模式和代谢产物之间存在差异。

图3 正负离子模式下对照组、模型组大鼠血清TIC图Figure 3 Serum TIC of the control group and the model group under both negativeion and possitiveion modes
2.5 血清代谢物多元统计分析结果
三维PCA结果显示,两组大鼠血清代谢谱之间存在显著差异(见图4)。OPLS-DA得分图结果更提示,模型组与对照组两者的代谢模式也有明显分离;而在OPLS-DA S-plot图中,横坐标表示主成分与代谢物的协相关系数,纵坐标表示主成分与代谢物的相关系数,越靠近右上角和左下角的代谢物表示其差异越显著,红色的点表明这些代谢物的VIP值≥1,绿色的点表示这些代谢物的VIP值<1,其中VIP值≥1且远离坐标轴原点的点为优先考虑的潜在生物标志物(见图5A,5B)。

图4 三维PCA图Figure 4 Three-dimentional PCA diagram
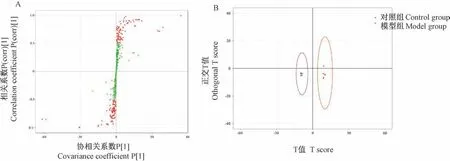
图5 两组OPLS-DA得分图和S-plot图Figure 5 OPLS-DA score plot and S-plot of the two groups
2.6 差异代谢物鉴定
最终共鉴定出组间潜在标志性代谢差异物44个,其中14个下调,30个上调(见表2)。通过Z值图可直观地观察到每个差异代谢物在不同组间的分布情况(绿色为对照组,橙黄为模型组)(见图6A)。各个差异代谢物在两组大鼠中血清中的相对含量如小提琴图所示(图6B)。差异代谢物聚类热图如图6C所示,每行代表每个代谢物在不同组大鼠血清中的表达量,每列代表每个样本中所有代谢物的表达量,树状图表示的是不同血清样本的各代谢产物之间的聚类关系(图中红色为上调,绿色为下调),结果反映模型组较对照组有显著差异。就有显著差异的代谢物绘制Pearson相关性热图如图6D,红色表示正相关性较强,绿色表示负相关性较强。

图6 差异代谢物分析Note.A.Z value plot of significant metabolites.B.Violin graph of significant metabolites.C.Heatmap of significant metabolites’hierarchical clustering analysis.D.Heatmap of correlation significant metabolites.Figure 6 Analysis of significant metabolites
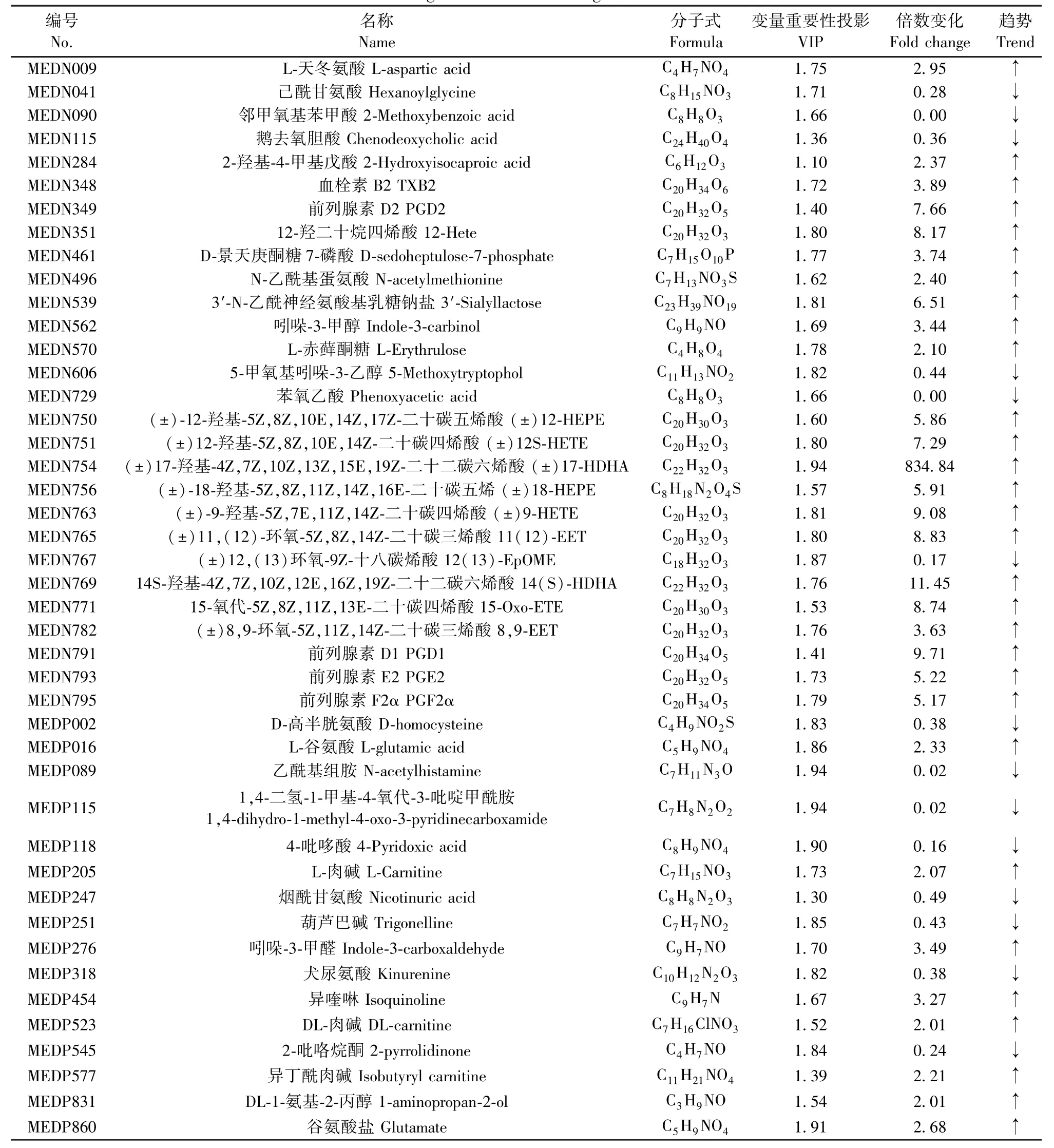
表2 差异性生物标志物信息Table 2 Biological information of significant biomarkers



2.7 KEGG通路分析
通过KEGG对所有标志性差异代谢物进行功能注释和通路富集分析,最终取P<0.05排名前20的信号通路绘制成气泡图,发现:SHR的体内代谢通路途径主要涉及神经活性受体配体相互作用、5-羟色胺(5-hydroxytryptamine,5-HT)突触传导通路、花生四烯酸(arachidonic acid,AA)代谢、烟酸和烟酰胺代谢、组氨酸代谢等代谢途径(见图7)。结合本研究结果和KEGG参考数据库分析发现,通路主要具体变化如下:(1)在神经活性受体配体作用途径中,前列腺素E2(prostaglandin E2,PGE2)、前列腺素D2(prostaglandin D2,PGD2)、代谢型谷氨酸受体(glutamate metabotropic receptors,GRMs)出现上调;(2)在5-HT突触传导通路中环氧二十碳三烯酸(epoxyeicosatrienoic acid,EETs)、前列腺素(prostaglandins,PGs)、血栓素(thromboxanes,TXs)出现上调,共同影响下游的信号传导、神经内分泌活动、铁离子调节、突触前抑制和AA代谢过程;(3)在AA代谢途径中则主要出现了PGE2、PGD2、血栓烷素B2(thromboxane B2,TXB2)、15-氧化二十碳四烯酸(15-oxo-Eicosatetraenoic acid,15-oxo-ETE)、8,9-环氧二十碳三烯酸(8,9-epoxyeicosatrienoic acid,8,9-EET)的表达升高。

图7 差异代谢物KEGG富集Figure 7 KEGG enrichment of significant metabolites
3 讨论
高血压病是遗传与环境相互作用所致的疾病,目前其发病机制尚未完全阐明。2015中国高血压调查报告显示,中国≥18岁居民高血压患病粗率为27.9%,而控制率仅16.8%[11];持续的高血压状态会造成血管损伤致使动脉斑块形成或出现狭窄、心脏负荷变大引起左室肥厚、肾小球内囊压力增高导致肾纤维化,最终造成患者死亡。代谢组学是能够直接反映机体疾病状态与代谢物表型变化的系统方法,通过它寻找持续高血压状态下机体产生的变化和特点或许可以为高血压的诊治提供新的思考角度。本研究着眼于血清代谢组学对比发现,持续性高血压状态SHR与对照组比较,除体重轻,血压高,血管和心肌组织出现纤维化外,血清代谢组的最大改变是PGs、TXs、EETs、15-oxoETE、GRM的上调,而这些物质主要参与了神经活性受体配体相互作用、5-HT突触传导通路、AA代谢等代谢途径。
游离的AA经环氧合酶(cyclooxygenase,COX)作用可生成PGs、前列环素和血栓素A2(thromboxane A2,TXA2)。TXA2不稳定,在水溶液中可迅速降解为TXB2;此外,AA还可在不同亚型细胞色素P450单氧酶(cytochromes P450,CYPs)作用下产生多种环氧化物,如氧化EETs和羟基二十碳四烯酸(hydroxyeicosatetraenoic acids,HETEs),而HETEs经特殊脱氢酶作用后可生成oxo-ETEs[12]。这些衍生物联同AA均具有很强的生物活性,参与心血管系统的复杂调节过程。本研究中发现升高的PGs、TXs、EETs、15-oxo-ETE既是AA途径过程的代谢产物,又分别影响神经活性受体的激活和5-HT突触信号的传导,在高血压发生发展中具有重要作用。首先,PGE2能够介导血管舒缩,主要是通过与1-4型不同PGE2受体(E-Prostanoid receptors,EPs)的结合参与全身血压的双向调节,若调节失衡则可能导致高血压。既往研究显示,PGE2可通过抑制具有血管收缩性的EP1引起的钙离子内流以及EP3介导的cAMP激活致使血管张力升高,发挥升压作用;相反,其可通过结合血管松弛性EP2和EP4促进胞内合成cAMP激活腺苷酸环化酶途径产生降压效应[13]。PGD2是在大鼠、人和其他哺乳动物脑中发现的最为丰富的PGs,其参与体温、睡眠和激素调节,并具有抗血小板凝集、诱导血管舒张与调控炎症的作用[14]。研究发现,抑制PGD2合成和其信号传导对Krabbe’s病小鼠的神经炎症具有抑制作用[15];而PGD2又能通过增加局部的血流促进炎症的发展[14]。不仅如此,PGE2和PGD2在血管炎症引起的动脉粥样硬化过程中呈反向调节,二者的平衡决定了COX的活性以及最终的结果是促炎还是抑炎[16]。TXs具有缩血管、升血压及促血小板激活的作用。研究发现,AA和TXB2浓度在高血压患者中明显升高且随病情加重,二者的水平与血压呈正相关[17-18];而TXA2可促进血小板释放5-HT和ADP引起血小板剧集,同时增强白细胞与内皮之间的黏附加重血管炎症。此外动物实验证明,过表达CYP表氧化酶基因可升高EETs并有效降压,而使用药物抑制该酶活性则可回升血压[19];通过抑制EETs水解酶活性升高EETs同样可以使血压下降[20]。研究发现,oxo-ETEs是过氧化物增殖酶体受体 (peroxisome proliferator-activated receptors,PPARs)的内源性配体[12],而PPARs的激活对SHR血压升高和靶器官损害均有抑制作用[21]。单核和巨噬细胞的激活可引起15-oxo-ETE的产生[22],且15-oxo-ETE被发现可抑制内皮细胞的增殖,可能具有抑制血管生成的作用[12]。除此之外,CYPs的氧化代谢产物可抑制血小板COX活性,降低TXs水平,抑制血小板聚集,降低血压;而PGD2可在维持与ADP、5-HT等促血小板凝集因子的平衡中与CYPs系统发挥协同作用。由此可见,AA代谢途径在高血压发病中具有复杂的多面效应,本研究中SHR血压的升高是AA代谢途径中诸多活性物质综合作用的共同结果。
GRM的上调是本研究中的血清代谢组的另一重要改变。GRM是G蛋白偶联受体超家族的一员,其可与兴奋性神经递质谷氨酸结合并参与调节神经突触活动与交感信号输出继而影响血管的舒缩和压力。研究发现,下丘脑室旁核(paraventricular nucleus,PVN)中升高的谷氨酸会刺激引起SHR交感神经信号外流的增加,并且PVN中I型GRM的活性增强可直接促进SHR交感性血管收缩激活,使血压升高[23];而PVN中II型GRM的激活则可通过减少谷氨酸能信号传入抑制交感活性[24]。下丘脑中的AT1受体可经由内源性配体激活后参与维持GRM活性,并通过升高蛋白激酶C水平增强高血压动物模型的交感信号输出,抑制内源性AT1受体和蛋白激酶C活性进而降低高血压动物的血压和减少交感神经放电[25]。此外,本研究也进一步证实了5-HT信号传导通路在高血压中的作用。研究显示,中枢与外周的5-HT活性和水平与整个脉管系统密切相关,也与高血压联系紧密;而其发挥作用的关键在于其与血管上各种5-HT受体的亲和力,不同的受体介导的作用不同[26]。如5-HT 2A具有很强的缩血管作用,而5-HT 1B/1D受体可以通过介导抑制交感神经末端释放去甲肾上腺素(norepinephrine,NE)减弱血管收缩[27]。脑内5-HT参与调节血压很可能是通过改变传出神经的交感活性来实现的,其过程十分复杂且根据实验条件和研究对象不同而不同,甚至双向矛盾。如静脉注射5-HT水平可引起大鼠外周交感活性信号减低进而出现血压下降[28],而向大鼠脑室内注射5-HT可引发高血压[29]。位于中线延髓的5-HT神经元激活会引起血压下降和交感神经放电减少[30];而位于前海马区的孤立束状核或中缝核群的5-HT信号会升高血压[31]。外周5-HT主要通过调节交感神经系统调控血管和血压。交感神经末梢可释放NE等引起血管平滑肌收缩,而NE的释放受含5-HT在内的负反馈系统的调节[32]。此外,5-HT还参与调节谷氨酸能神经元活动调节心血管系统,但具体的生理作用过程尚未完全清楚[33]。
综上所述,AA代谢、GRM以及5-HT介导的神经传导效应在持续高血压状态SHR的血压升高与高血压病的发生发展中均发挥了多重效应,这3条途径中产生的代谢物之间存在复杂的网络交互作用,共同影响高血压病的进展。然而,本实验中代谢产物发生变化调动的多维网络调控机理仍需全面系统地设计实验加以阐明,5-HT调节剂或COX抑制剂用于调控血压的可行性和效果也有待进一步研究验证与观察。