氯化钙处理对鲜切苹果功能成分变化的影响研究
◎ 赵临强,李宁炜,武 瑜,程 昊,张荣星,武晋海,朱志强
(1.钛和检测认证集团山西中谱安信质检技术服务有限公司,山西 临汾 041000;2.山西师范大学 食品科学学院,山西 临汾 041000;3.国家农产品保鲜工程技术研究中心(天津),农业农村部农产品贮藏保鲜重点实验室,天津 300384)
受季节和地域的局限,大多数果蔬产品往往集中在某一地区、某一时令大量上市,且目前中国果蔬类产品的采后保鲜系统尚不完善,常常会因处理不当而导致大量果蔬采摘腐烂变质。根据联合国粮食及农业组织数据统计,我国作为苹果生产第一大国,2020年 苹果年产量达到了4 300万t,接近世界总产量的50%。晋南地区是中国苹果的主要产区之一,采后贮藏保鲜也是该地区苹果产业的一项重要研究课题。山西省晋南地区自然条件优越,生产的苹果以果大色鲜、口感脆甜、汁水饱满、品质上乘而驰名中外。晋南地区地处西北黄土高原苹果优势产业带,境内光照强,海拔高,昼夜温差大,土层深厚,达到国家农业农村部所颁布的《全国优势农产品区域布局规划(2008—2015)》中的“苹果生态适宜指标”。这些条件利于果实良好着色以及营养成分累积[1]。自20世纪90年代以来,红富士苹果品种因其优异的品质和良好的贮运性,种植面积在我国北部地区迅速增长,目前已成为主要的晚熟品种,并在晋南地区广泛种植,种植面积超过60%。
在晋南,苹果的主要食用方式是鲜食,但因其成熟期较为集中,含糖量较高,贮藏后期易发生果肉褐变现象,进而失去食用性和商品价值。为解决这一问题,商家选择鲜切苹果,经过分级、整理、清洗、去皮、切分、修整和包装等一系列的加工处理,最大化保持苹果的新鲜状态,为消费者食用提供了极大的便利。鲜切苹果因其即食、方便、健康的独特优势,改变了苹果传统的食用方式,缓解了集中上市的销售压力,近年来受到了广大消费者的认可和喜爱。但在处理时,鲜切苹果受到机械损伤,因酶促褐变、组织软化和微生物生长等原因导致其保质期较短,制约了其规模化发展[2]。
作为品质保护剂之一,钙盐能够应用于果蔬采后保鲜,研究表明,钙盐的有效利用可减缓果实在贮藏过程中品质的下降速率,这对于延长果实的贮藏时间有积极的作用。在钙盐中无毒、无臭味、味微苦的CaCl2常用作采后果实钙处理[3]。对骏枣、猕猴桃、梨等用CaCl2保鲜的研究结果表明[4-6],CaCl2处理能够长时间将果实质地维持在一个良好的水平,并使果实保持较高的总酚含量、可溶性固形物(TSS)含量等,减缓腐烂和生理失调的程度,从而延缓衰老,提高果实的贮藏品质。相较于气调处理[7],在采后低温贮藏条件下,用CaCl2处理鲜切苹果,能使操作运输成本以及困难程度大幅度下降。而与纳他霉素、山梨酸钾等[8]其他保鲜剂处理的方法相比较,CaCl2在保持处理成本低廉的同时,可以更有效地维持果实贮藏品质。因此,在本试验中,试验材料为采后的鲜切苹果,研究在不同质量浓度的CaCl2处理下,对鲜切苹果低温贮藏过程中品质的影响,以期为苹果的贮藏保鲜提供参考。
1 材料与方法
1.1 材料与试剂
苹果购于山西省临汾市兵站路农贸市场;CaCl2(食品级)、酚酞、0.1 mol·L-1氢氧化钠溶液、芦丁标准品、没食子酸标准品、三氯化铝、福林酚试剂、无水乙醇、碳酸钠、邻苯二酚、磷酸二氢钾、愈创木酚及1 mol·L-1过氧化氢。
1.2 仪器与设备
752N型紫外可见分光光度计(扬州均瑞机械设备有限公司);CP214电子天平(奥豪斯仪器有限公司硬度计);SR62高精度色差仪(宁波乐迪仪器有限公司);TDL-60B离心机(湖南湘仪试验室仪器有限开发公司);79-1磁力搅拌器(北京中兴伟业试剂仪器有限公司)。
1.3 CaCl2处理
实验共分为6组,分别采用浓度为1%、2%、3%、4%和5%的CaCl2溶液对苹果果实进行浸泡5 min处理,空白组用蒸馏水浸泡处理,每组皆为1.5 cm× 1.5 cm×1.5 cm的小立方体,共(1 500±10)g。将处理过的果实在实验台上静置5 min后用干净无菌的纸巾吸干其表面水分,放于0 ℃中低温贮藏。在贮藏期间连续6 d每天进行各项指标的测定。
1.4 指标测定方法
1.4.1 总酚含量的测定
总酚含量采用福林酚比色法测定[9]。
(1)标准曲线的绘制。准确称取0.011 0 g没食子酸,用50 mL蒸馏水溶解、定容至100 mL,得到质量浓度为0.11 mg·L-1的没食子酸标准储备液,分别准确吸取标准储备液0 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL、1.4 mL和1.6 mL于25 mL容量瓶中,加蒸馏水至6.0 mL,分别加入FC(福林酚)试剂 0.5 mL,混匀,在5 min时加入1.5 mL 20%的Na2CO3溶液,充分混合后定容,30 °C避光放置0.5 h,以不加标准液的6.0 mL蒸馏水为空白对照,760 nm下测定吸光值,每个样品平行测定3次。
(2)样品处理。称取5 g样品,加入10 mL 80%乙醇研磨。以5 000 r·min-1转速离心10 min后,取上清液备用。
(3)测定与计算。取1 mL样品液于25 mL的比色管中定容至6 mL,分别加入FC显色剂0.5 mL及20% Na2CO31.5 mL,混匀,定容至25 mL,于30 ℃水浴反应30 min。在765 nm波长下测定吸光度。每个浓度做3个平行试验,取平均值,绘制标准曲线,得到吸光度值A与没食子酸标准溶液浓度之间的回归方程,计算总酚含量。
1.4.2 总黄酮含量测定
总黄酮含量采用在碱性介质中加铝盐显色的分光光度法测定[10]。
(1)标准曲线的绘制。精确称取芦丁标准品 50.0 mg,加乙醇溶解定容至50 mL,配成1 mg·mL-1的芦丁标准溶液。精密吸取芦丁标准品溶液0 mL, 0.4 mL,0.8 mL,1.2 mL,1.6 mL和2.0 mL分别置于10 mL比色管中。加乙醇至总体积为2 mL,加入5%亚硝酸钠溶液0.5 mL,放置6 min后加入10%硝酸铝溶液0.5 mL再放置6 min,加入4.5 mL的4%氢氧化钠溶液,乙醇定容至10 mL,摇匀,于波长510 nm处以30%乙醇溶液为空白,测定吸光度,绘制标准曲线。
(2)试样制备。称取苹果样品5 g,切成小碎块,在研钵中加入10 mL 80%的乙醇,研磨充分,以 5 000 r·min-1转速离心10 min后,取上清液备用。
(3)测定。精密吸取待测试液1 mL置于10 mL比色管中,加乙醇至总体积为2 mL,加入5%亚硝酸钠溶液0.5 mL,放置6 min后加入10%硝酸铝溶液 0.5 mL再放置6 min,加入4.5 mL的4%氢氧化钠溶液,最后用乙醇定容至10 mL,摇匀,以空白试液作参比,在波长510 nm处测定试液的吸光度。查标准曲线或通过回归方程计算求出试料溶液中的黄酮类化合物含 量(mg·g-1)。
1.4.3 POD活性测定
采用愈创木酚法测定苹果组织中POD活性[11]。
(1)反应混合液配制。取磷酸缓冲液(pH=6.5)25 mL于烧杯中,加入愈创木酚140 μL,于磁力搅拌器上搅拌至完全溶解,待溶液冷却后加入30%过氧化氢95 μL,混合均匀,保存于冰箱中
(2)酶液制备。称取苹果5 g,加入20 mmo1·L-1KH2PO4溶液30 mL,于研钵中研磨成匀浆,在 5 000 r·min-1下离心10 min,上清液转入100 mL容量瓶中,定容,混匀,贮于低温处备用。
(3)测定与计算。取光径1 cm比色皿,加入混匀的反应混合液3 mL,磷酸缓冲溶液1 mL作为参比液;另一个比色皿加入反应混合液3 mL,磷酸缓冲液0.5 mL,酶液0.5 mL(如酶活性过高可稀释),立即记时并置于分光光度计中。在470 nm下测定光密度,每隔0.5 min读数1次,测6组数据。
1.4.4 多酚氧化酶活性测定
(1)酶液制备。称取5.0 g苹果样品置于研钵中,加入10.0 mL磷酸缓冲液,研磨成匀浆,在4 ℃、 5 000 r·min-1条件下离心10 min,收集上清液作为酶提取液,低温保存备用。
(2)活性测定。取试管加入2.0 mL pH=6.5的磷酸缓冲液和1.0 mL的邻苯二酚溶液作为空白参比。试验组为1.0 mL的酶液和1.0 mL的磷酸缓冲液,其余试剂不变,同时立即开始计时。将反应混合液倒入比色皿后置于分光光度计样品室。反应1 min后记录反应体系在420 nm波长处的吸光度值作为初始值。每 1 min记录1次吸光度值,连续测量至少6个点的数据,重复3次。
1.4.5 可滴定酸的测定
(1)样品的处理与制备。将苹果适度粉碎,混匀,称量5 g,用蒸馏水溶解到25 mL容量瓶中,80 ℃水浴加热0.5 h,冷却、定容,纱布过滤,弃去初液,收集滤液备用。
(2)样品滴定。准确吸取制备的滤液25 mL,加入酚酞指示剂2~3滴,用0.1 mol·L-1标准碱液滴定至微红色,30 s不褪色,记录用量,同时做空白实验。
1.4.6 可溶性固形物含量、失重率、色差值、硬度的测定
可溶性固形物采用阿贝折光仪TSS测定[12]。果实质量损失率[13]采用称质量法测定。硬度则用手持硬度计进行测定。色差值采用色差仪测量,按式(1)计算:

式(1)中:a-红绿值(+表示偏红,-表示偏绿);a0-空白对照的红绿值;b-黄蓝值(+表示偏黄,-表示偏蓝);b0-空白对照的黄蓝值;L-亮暗值(+表示偏亮,-表示偏暗);L0-空白对照的亮暗值。
1.5 数据分析
每个指标重复测定3次,数据分析采用Excel 2017,差异分析采用SPSS软件,绘图采用Excel 2017软件。
2 结果与分析
2.1 对苹果果实总酚含量的影响
由图1可知,苹果果实中的总酚含量随着贮藏时间的延长而下降。CaCl2处理能减缓总酚的下降速度,在贮藏前期下降速率较快,后期下降较慢。其中以3%浓度的CaCl2处理对总酚含量下降抑制效果最明显,第5 d时,3%CaCl2浸泡的果实总酚含量比对照组高66.67%。具有显著性差异(P<0.05)。因此3%CaCl2处理可有效延缓果实中总酚含量的降低。
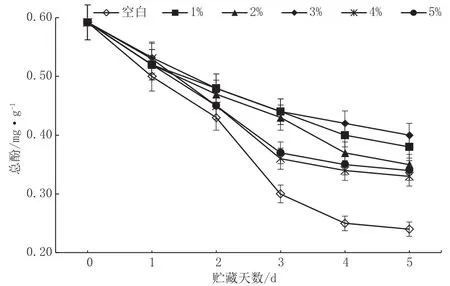
图1 CaCl2处理对苹果果实总酚含量的影响图
2.2 对苹果果实总黄酮含量的影响
由图2所示,CaCl2处理均可减缓总黄酮下降的速率。在整个贮藏期内3%CaCl2浸泡的黄酮由0.32 mg·g-1降至0.24 mg·g-1,保留率高达75%。表明3%CaCl2处理有利于总黄酮的保留。

图2 CaCl2对采后苹果总黄酮含量的影响图
2.3 对采后苹果POD活性的影响
由图3可知,过氧化物酶活性在整个贮藏期内逐渐降低,CaCl2处理的POD活性显著高于空白组 (P<0.05),3%CaCl2处理的POD活性一直保持在较高水平,贮藏前期POD活性较高,可能是由于机械伤导致的膜系统破坏,POD游离较多。

图3 CaCl2对采后苹果POD活性的影响图
2.4 对采后苹果多酚氧化酶活性的影响
在果实后熟衰老、采后贮藏和受到机械损伤过程中,PPO与底物接触,含量迅速增加,使果肉组织发生褐变[14]。从图4中可以看出,各处理苹果果实的PPO活性均呈先升高后降低的趋势。在整个贮藏期间,3%CaCl2处理的果实PPO活性显著低于空白组 (P<0.05),贮藏第2 d各浓度处理的果实PPO活性达到高峰,其中3%CaCl2处理的果实PPO活性低于空白组。可见,3%浓度的CaCl2浸泡处理能够抑制果实PPO活性的升高。

图4 CaCl2对采后苹果多酚氧化酶酶活性的影响图
2.5 对采后苹果可滴定酸含量的影响
可滴定酸含量是影响苹果口感的重要因素。图5显示,在贮藏第5 d时,3%CaCl2处理鲜切苹果的可滴定酸含量为0.32%,比1%CaCl2、5%CaCl2处理的可滴定酸含量高出17.86%、22.22%。
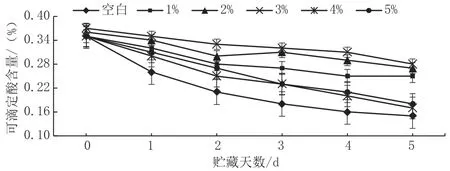
图5 CaCl2对采后可滴定酸含量的影响图
2.6 对采后苹果可溶性固形物含量、失重率、色差值、硬度的影响
可溶性固形物(TSS)含量可直接反映果实的成熟度及贮藏品质[15]。从图6中可以看出,各组TSS含量均呈现下降趋势。第5 d时,3%CaCl2浸泡处理的果实的TSS含量比空白组高4.55%,两组果实有显著性差异(P<0.05)。可见,适宜浓度的CaCl2处理减缓了TSS含量的下降速率,其中以3%CaCl2处理效果最佳。
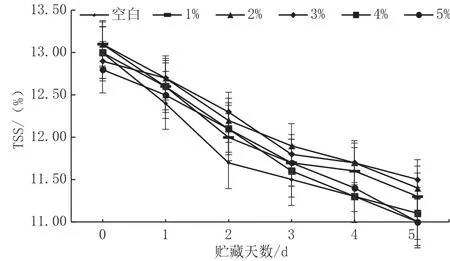
图6 CaCl2对采后苹果TSS含量的影响图
贮藏过程中的水分蒸腾和呼吸消耗使苹果果实的质量损失率呈上升趋势,见图7,3%CaCl2处理组质量损失率均低于其他5组,且3%CaCl2处理后的鲜切苹果质量损失的速率变慢。CaCl2处理可保持贮藏期间鲜切苹果的含水量,抑制鲜切苹果水分的流失。这可能是由于钙离子能够结合细胞膜上的磷脂分子,使细胞液渗透压增加,一定程度上减缓了鲜切苹果的蒸腾速率,降低了水分的流失。
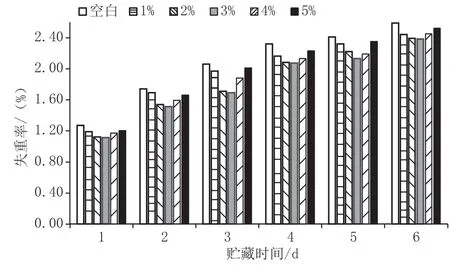
图7 CaCl2对采后苹果失重率的影响图
果皮的颜色不仅影响果实感官品质,也进一步体现了果实的生理状态[16]。由图8可知,各组别果实ΔE值呈现不断上升的趋势,表明贮藏过程中鲜切苹果褐变度不断增加。相较于其他组的贮藏,3%CaCl2贮藏能明显地减缓苹果色差值的增大,表明3%CaCl2对褐变反应有抑制作用。

图8 CaCl2对采后苹果色差值的影响图
如图9所示,低温贮藏过程中,苹果硬度下降速率先快后慢。处理组和空白组相比,硬度间无显著性差异(P>0.05)。表明在短期常温贮藏过程中,CaCl2处理对硬度并无显著影响。
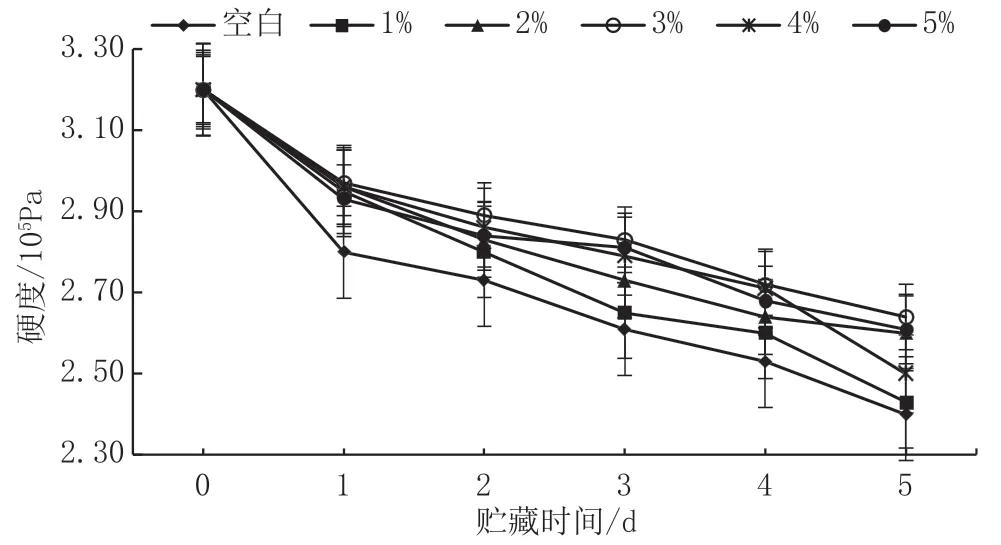
图9 CaCl2对采后苹果硬度的影响图
3 结论
本研究中3%CaCl2处理后的苹果果实具有较好的贮藏品质。综合各项生理指标来看,在实际应用中,推荐采用3%CaCl2处理对苹果果实进行低温贮藏或运输。本研究发现适宜浓度的钙处理能有效延缓果实软化,提高抗氧化活性,延缓果实成熟衰老进程,抑制过氧化物酶活性,延缓多酚氧化酶活性下降,但其生理机理及分子机制尚不清楚,还需深入研究。另外,还可进一步研究CaCl2复合其他保鲜剂或物理处理对苹果果实贮藏保鲜的影响,以期找到苹果果实的最佳保鲜方法。

