PON1、CD39/ATP轴对急性百草枯中毒预后的预测价值
张晓波 吕晓丹 周琴 林媛珍 李喆 刘达 吕立文★
百草枯可经消化道、呼吸道、皮肤等吸收引起急性百草枯中毒(Acute paraquat poisoning,APP)[1]。APP 通过在生物体内产生超氧阴离子导致机体氧化还原状态失衡,最终引起细胞发生氧化损伤而死亡,严重威胁患者生命健康,需及时给予有效救治[2]。新近报道[3]显示,早期评估患者病情、预测预后,可为临床决策和治疗提供指导。对氧磷脂酶1(Paraoxonase-1,PON1)是一种能水解有机磷农药对氧磷的A-酯酶,相关研究证实通过检测其活性有助于判断有机磷中毒患者的疾病严重程度和预后[4]。此外,CD39/三磷酸腺苷(Adenosine triphosphate,ATP)轴被证实与有机磷中毒病情及预后密切相关[5]。但上述指标是否与APP 患者预后有关,目前少有研究报道。基于此,本研究尝试探究PON1、CD39/ATP 轴在APP 患者中的水平变化,并采用ROC 曲线分析其预测预后价值。
1 资料与方法
1.1 一般资料
选取本院2016年6月至2020年6月APP 患者82 例,入院时均积极采取洗胃、导泄、中和毒素、保护脏器功能、利尿、杂合式血液净化等急救措施,根据中毒90 d 预后分为生存组(64 例)与死亡组(18 例)。两组性别、年龄、体质量指数(Body mass index,BMI)比较,差异无统计学意义(P>0.05),死亡组中毒至就诊时间长于生存组,中毒剂量、中毒程度均高于生存组,差异有统计学意义(P<0.05)。见表1。
表1 两组一般资料比较[n(%),(±s)]Table 1 Comparison of general information between the two groups[n(%),(±s)]

表1 两组一般资料比较[n(%),(±s)]Table 1 Comparison of general information between the two groups[n(%),(±s)]
组别生存组死亡组χ2/t 值P 值例数64 18性别(男/女)29/35 7/11 0.235 0.628年龄(岁)43.65±8.17 46.17±6.91 1.193 0.237 BMI(kg/m2)23.71±2.49 24.26±2.37 0.836 0.406中毒至就诊时间(h)8.85±2.90 11.34±2.71 3.263 0.002中毒剂量(mL)8.52±3.57 12.37±4.25 3.874<0.001中毒程度轻度23(35.94)2(11.11)2.480 0.013中度25(29.06)6(33.33)重度16(25.00)10(55.56)
纳入标准:①均为口服百草枯中毒,服用剂量<20 mL;②尿液百草枯点滴实验检查为阳性;③首次中毒服用剂量<20 mL;④年龄18~60 岁;⑤患者家属知晓本研究,已签署同意书。排除标准:①入院时已无生命体征者;②精神疾病患者;③恶性肿瘤患者;④自身免疫性疾病、感染性疾病患者;⑤中毒前有严重心脑血管疾病、肝肾功能障碍者;⑥血液系统疾病患者;⑦妊娠或哺乳期女性。
1.2 方法
实验室指标检测:所有患者均于入院后立即采集外周静脉血6 mL,取2 mL 血液标本,离心处理取血浆,采用速率法测定血浆PON1 活性,试剂盒购自武汉博欧特生物科技有限公司,仪器为日立7170S 自动生化分析仪。取2 mL 血液标本,采用艾森生物(杭州)有限公司生产的NovoCyte D2061R型流式细胞仪检测CD39 细胞比例。取2 mL 血液标本,离心处理取血清,采用酶联免疫吸附法测定血清ATP 水平,试剂盒购自北京百奥莱博科技有限公司。中毒程度评估[6]:轻度、中度、重度。
1.3 统计学方法
数据处理采用SPSS 22.0 软件;计数资料以n(%)描述,采用χ2检验;计量资料以()描述,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验;相关性分析采用Spearman 相关系数模型,预后的影响因素采用COX 回归分析,预测效能分析采用受试者工作特征(ROC)曲线,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组血浆PON1 活性、CD39 细胞比例、血清ATP 水平比较
死亡组血浆PON1 活性、血清ATP 水平较生存组低,CD39 细胞比例较生存组高,差异有统计学意义(P<0.05)。见表2。
表2 两组血浆PON1 活性、CD39 细胞比例、血清ATP水平比较(±s)Table 2 Comparison of plasma PON1 activity,CD39 cell ratio,and serum ATP level between 2 groups(±s)

表2 两组血浆PON1 活性、CD39 细胞比例、血清ATP水平比较(±s)Table 2 Comparison of plasma PON1 activity,CD39 cell ratio,and serum ATP level between 2 groups(±s)
组别死亡组生存组t 值P 值n 18 64血浆PON1 活性(U/mL)54.39±18.06 82.52±27.31 4.115<0.001 CD39 细胞比例(%)36.13±12.02 23.67±7.85 5.247<0.001血清ATP(ng/L)10.37±3.41 17.55±5.82 4.985<0.001
2.2 不同病情患者血浆PON1 活性、CD39 细胞比例、血清ATP 水平
中毒剂量>50 mL 患者血浆PON1 活性、血清ATP 水平低于中毒剂量≤50 mL 患者,CD39 细胞比例高于中毒剂量≤50 mL 患者,差异有统计学意义(P<0.05);血浆PON1 活性、血清ATP 水平随中毒程度增加呈降低趋势,CD39 细胞比例呈升高趋势,差异有统计学意义(P<0.05)。见表3。
表3 不同病情患者血浆PON1 活性、CD39 细胞比例、血清ATP 水平比较(±s)Table 3 Comparison of plasma PON1 activity,CD39 cell ratio,and serum ATP level in patients with different conditions(±s)

表3 不同病情患者血浆PON1 活性、CD39 细胞比例、血清ATP 水平比较(±s)Table 3 Comparison of plasma PON1 activity,CD39 cell ratio,and serum ATP level in patients with different conditions(±s)
病情中毒剂量中毒程度组别≤10>10 t 值P 值轻度中度重度F 值P 值n 50 32 25 31 26血浆PON1活性(U/mL)86.47±20.51 60.54±26.09 5.016<0.001 92.16±15.06 78.13±12.79 59.03±20.13 27.283<0.001 CD39 细胞比例(%)23.14±6.26 31.52±10.20 4.616<0.001 20.06±4.17 24.78±6.08 34.46±8.29 33.788<0.001血清ATP(ng/L)18.77±5.18 11.60±3.63 6.824<0.001 23.93±8.72 15.04±5.38 9.43±4.29 34.108<0.001
2.3 血浆PON1 活性、CD39 细胞比例、血清ATP水平与中毒剂量、中毒程度的关系
相关性分析,血浆PON1 活性、血清ATP 水平与中毒剂量、中毒程度呈负相关,CD39 细胞比例与中毒剂量、中毒程度呈正相关(P<0.05)。见表4。
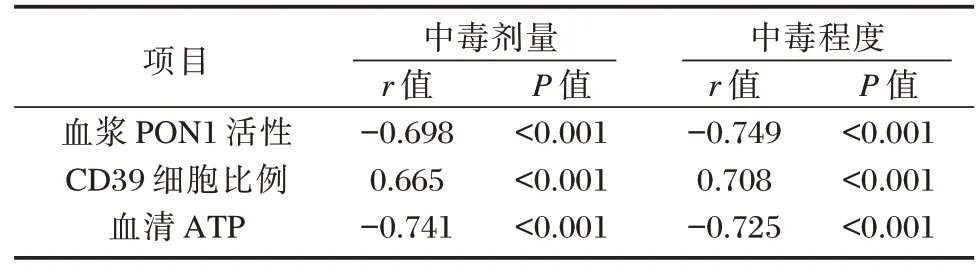
表4 血浆PON1 活性、CD39 细胞比例、血清ATP 水平与中毒剂量、中毒程度的关系Table 4 The relationship between plasma PON1 activity,CD39 cell ratio,serum ATP level and poisoning dose and degree of poisoning
2.4 APP 预后的影响因素
以APP 预后作为因变量(生存=0,死亡=1),在控制中毒至就诊时间、中毒剂量、中毒程度等其他因素后,以入院时血浆PON1 活性、CD39 细胞比例、血清ATP 水平作为因变量(以所有患者平均值为界:≤平均值=1,>平均值=2),COX 回归分析,入院时血浆PON1 活性、CD39 细胞比例、血清ATP 水平是APP 预后的重要影响因素(P<0.05)。见表5。

表5 APP 预后的影响因素Table 5 Factors affecting the prognosis of APP
2.5 血浆PON1 活性、CD39 细胞比例、血清ATP水平对预后预测价值
以生存组为阴性样本,死亡组为阳性样本,绘制ROC 曲线,结果显示,血浆PON1 活性、CD39 细胞比例、血清ATP 三者联合预测预后的AUC 为0.920,最佳预测敏感度为94.44%,特异度为78.12%。见图1、表6。

图1 ROC 曲线Figure 1 ROC curve
3 讨论
APP 具有进展快、死亡率高的特点,临床多采取抗氧化剂、免疫抑制剂、血液灌注等缓解病情,虽取得了一定的成效,但患者预后并不理想[7]。越来越多的研究[8-9]显示,APP 预后的相关因素较多,早期评价患者预后对辅助指导临床治疗具有重要意义。
APP 发生后可引起机体产生炎症、氧化应激、免疫平衡破坏等一系列变化。PON1 是一种抗氧化和抗炎物质,动物学研究[10]发现,PON1 具有抗氧化及解救有机磷中毒性质,对有机磷中毒大鼠大脑皮层和海马区均具有保护作用。国外相关报道[11]表明PON1 具有增强ChE 的活性和乙酰胆碱的水解的作用,可缓解有机磷中毒症状,或许能为临床救治有机磷中毒提供新途径。本研究发现,预后为死亡APP 患者入院时的血浆PON1 活性明显低于预后为生存患者,提示PON1 可能参与APP的病情进展。APP 患者入院时血浆PON1 活性越低,其增强ChE 的活性和乙酰胆碱的水解的作用随之减弱,抗氧化和抗炎作用也降低,致使毒性物质、炎性因子等对机体组织器官的损害加重,从而增加患者病死率。CD39/ATP 轴被证实与炎症反应的发生发展密切相关[12]。本研究还发现,预后为死亡APP 患者入院时的血清ATP 水平明显低于预后为生存患者,而CD39 细胞比例高于预后为生存患者,提示CD39/ATP 轴变化可能参与APP 预后转归。ATP 是一种内源性危险信号,可激活相关炎性小体,并大量释放白细胞介素1β、白细胞介素18 等促炎因子,加重炎症反应[13]。CD39 是表达于树突状细胞等细胞膜表面的胞外核苷酸水解酶,具有水解ATP 的作用,从而抑制危险信号ATP的促炎效应[14]。APP 发生后,机体内炎症反应明显增加,为抑制炎症反应,机体大量释放CD39 细胞,中毒症状越严重,CD39 细胞释放量越大,其对ATP 的水解作用越强。本研究通过相关性分析,发现血浆PON1 活性、血清ATP 水平与中毒剂量、中毒程度呈负相关,CD39 细胞比例与中毒剂量、中毒程度呈正相关,与上述分析相符,证实了PON1、CD39/ATP 轴与APP 病情程度密切相关。

表6 血浆PON1 活性、CD39 细胞比例、血清ATP 水平对预后预测价值Table 6 The prognostic value of plasma PON1 activity,CD39 cell ratio,and serum ATP level
此外,本研究发现入院时血浆PON1 活性、CD39细胞比例、血清ATP 水平仍是APP 预后的重要影响因素。因本实验中对口服患者采用积极的抢救措施,并服用的量均<20 mL,故本实验中死亡率较低。
综上可知,血浆PON1 活性、CD39 细胞比例、血清ATP 水平与APP 患者病情及预后密切相关,早期检测各指标可为临床预测APP 患者预后提供一定参考。但本研究存在样本量较少的不足,仍需通过多中心研究进一步验证。

