蔗糖转运蛋白OsSUT5在水稻花粉发育及结实中的作用
张雅文,包淑慧,唐振家,王小文,2,杨芳,张德春,胡一兵
蔗糖转运蛋白OsSUT5在水稻花粉发育及结实中的作用
张雅文1,包淑慧1,唐振家1,王小文1,2,杨芳3,张德春4,胡一兵
1南京农业大学资源与环境科学学院,南京 210095;2南京农业大学园艺学院,南京 210095;3武汉大学生命科学学院杂交水稻国家重点实验室,武汉 430072;4三峡大学生物技术研究中心,湖北宜昌 443002
【】蔗糖是植物体内光合产物运输的主要形式。蔗糖-质子同向运输蛋白(sucrose transporter/sucrose carrier,SUT/SUC)在植物细胞之间的蔗糖跨膜运输以及植物组织和器官之间的蔗糖分配中具有重要作用。水稻SUT家族共有5个成员。已有研究表明,敲除、、、对水稻的生长发育产生显著影响,说明这些基因不可替代。然而,OsSUT5的功能还未见报道。阐明OsSUT5在水稻生长发育中的作用,将为全面了解SUT蛋白在模式植物水稻中的生理功能提供新的依据。通过对水稻的时空表达特性进行实时荧光定量PCR分析,同时利用的推测启动子驱动在水稻体内表达,获得其基因编码蛋白的组织定位信息,以及在烟草叶片表皮细胞内进行OsSUT5-GFP融合蛋白瞬时表达,对蛋白进行亚细胞定位,比较基因编辑技术(CRISPR-Cas9)创制的不同纯合突变株系与野生型对照水稻的形态和生理特征,获得OsSUT5的功能信息。转录水平上,在水稻茎、叶、花序和颖果中均有表达,并且该基因编码蛋白在营养器官中的表达集中于维管组织。在生殖器官中,的表达主要位于花药及发育的颖果内。该基因编码蛋白在水稻发育的颖果特别是盾片和胚根鞘中高表达。烟草叶片表皮细胞内的瞬时表达显示OsSUT5-GFP融合蛋白定位于细胞质膜。与野生型水稻相比,3个纯合突变株系均表现为花粉活性以及离体萌发率明显降低。与此相吻合的是,突变株系未授粉的小穗比例相对于野生型显著增加,同时突变株系结实率显著下降。通过对突变株系颖果的观察和比较显示,突变体水稻颖果的垩白相对于野生型明显增多,其颖果长度相对于野生型对照也有一定程度的增加,但统计结果表明突变体水稻的千粒重与野生型无显著区别。OsSUT5在水稻花粉发育甚至受精过程中可能发挥重要作用;敲除对水稻的结实率、籽粒的形态和品质有明显影响。推断OsSUT5在水稻开花结实中的作用(包括对花粉活性和颖果内胚乳发育的影响)与其蔗糖运输功能密切相关。
水稻;OsSUT5;CRISPR-Cas9;花粉萌发;结实率;垩白
0 引言
【研究意义】籽粒是水稻的可食用部分,其中淀粉约占籽粒重量的90%。淀粉的合成源于植物绿色组织光合作用产生的葡萄糖。葡萄糖在细胞质中转化为蔗糖作为光合产物的主要形式运输到“库”器官[1-2]。植物体内合成碳水化合物等有机物的器官如叶片,称为“源”器官,而接受有机物的器官称为“库”器官,包括根、茎、花、果实和种子等[3-4]。在水稻生殖生长期间,籽粒是最重要的库器官。蔗糖在从源到库的运输以及分配中存在2种途径,即依赖胞间连丝的共质体途径和依赖跨膜载体运输的质外体途径[5]。蔗糖-质子同向运输蛋白(SUT(C))是质外体运输途径的重要成员。【前人研究进展】蔗糖-质子同向运输蛋白(sucrose transporters or sucrose carrier,SUTs/SUCs)属于主要易化子超家族(major facilitator superfamily,MFS)的成员[6]。它们存在于植物中,并且与细菌、真菌和动物的己糖转运蛋白亲缘关系较远[7]。自1992年从菠菜中鉴定出第一个SUT成员[8],此后很多植物的SUT基因陆续被发现和报道[9-14]。系统发育分析表明,植物SUT蛋白可分为3、4或5个亚族[5,10,15]。在5个亚族的分类体系中,SUT1亚族为双子叶植物特有;SUT2和SUT4亚族为单、双子叶植物所共有;SUT3和SUT5亚族则为单子叶植物所特有[15]。对SUT家族部分基因功能研究发现,它们不仅参与植物体内蔗糖的运输和分配,也与植物的生长发育密切相关,比如影响花粉、果实的发育,参与植株的生长和乙烯的生物合成等过程[16-19]。水稻SUT家族共有5个成员[10]。其中在水稻生长发育中所承担的功能已经引起了研究人员的广泛兴趣,而且针对这个基因生理功能的研究报道还在不断地扩展和深入[20-27]。敲除引起水稻的株高、分蘖数和千粒重显著降低[28]。最近,李孟珠等[29]通过CRISPR-Cas9敲除导致水稻株高降低,分蘖增加和产量降低等表型。岳萌萌[30]的研究也得到了类似的结果。对拟南芥和水稻SUT基因的结构和组成分析显示,它们都由多个外显子组成,部分SUT基因存在可变剪切。水稻由13个外显子构成。目前只发现它的一个转录本。2012年一项在非洲爪蟾卵母细胞中的研究显示,OsSUT5和OsSUT1一样具有蔗糖运输能力,并且显示OsSUT5较OsSUT1具有更高的底物亲和性(0.5=2.32 mmol·L-1,pH=5.6)、更低的底物特异性和低pH依赖的特点[31]。拟南芥中,编码一个胚乳特异表达的蔗糖运输蛋白,突变导致拟南芥胚发育轻微延迟[32],而且有研究显示AtSUC5除了运输蔗糖,还能运输生物素[33]。水稻中一些关于OsSUT5的研究表明,反义抑制表达导致籼稻品种明恢盾片膨大以及愈伤组织诱导率和增值率显著下降[34];同时还引起颖果直链淀粉含量变高,垩白度升高[35]。【本研究切入点】尽管上述工作为阐明OsSUT5的生理功能提供了重要线索,但有关该基因的系统研究还未见报道。【拟解决的关键问题】本研究旨在通过基因编辑技术获得突变体株系,比较它们与野生型水稻的表型,明确其生理功能,结合基因在转录水平的表达模式及其在蛋白水平的组织定位鉴定OsSUT5的功能,为阐明水稻体内蔗糖运输蛋白OsSUT5的生理功能及其作用机制提供新的依据。
1 材料与方法
1.1 材料
试验水稻品种为日本晴(L. ssp.cv. Nipponbare),2018—2020年种植于南京农业大学牌楼实验基地。采用15 cm×20 cm的株距、行距,自然条件下生长。大肠杆菌菌株DH5α、农杆菌菌株EHA105,以及试验所用亚细胞定位载体pSAT6A- EGFP-N1、pSAT6A-EGFP-C1、pRCS2和组织定位载体pCAMBIA1300(GUS)、pCAMBIA1300(GFP)均由南京农业大学资源与环境科学学院植物营养实验室保存。
1.2 OsSUT5的表达模式分析
1.2.1转录水平表达丰度的分析 采集水稻幼苗期的根系、叶片和成熟期的茎、叶鞘、孕穗期的花序以及开花后3、4、5、6、7和12 d的颖果,在液氮中冷冻、研磨,利用Trizol提取各部位的总RNA,反转录生成cDNA。根据()的mRNA序列设计qPCR-F/R引物(电子附表1),以为内参基因,通过qRT-PCR检测在水稻不同组织部位的表达水平,设3个生物学重复。用2-ΔΔCT法[36]计算的相对表达量。采用Microsoft Excel进行数据统计及显著性分析。
1.2.2 OsSUT5-GFP融合蛋白的亚细胞定位载体构建及其在烟草中的瞬时表达 根据的cDNA全长1 608 bp设计引物NF/R、CF/R(电子附表1)。以水稻颖花总RNA逆转录获得的cDNA为模板,使用高保真DNA聚合酶Prime STAR Max Premix(2×)进行PCR扩增反应。扩增产物分别与中间载体pSAT6A- EGFP-C1、pSAT6A-EGFP-N1通过Ⅰ和HⅠ线性化后进行无缝克隆连接。连接产物转化大肠杆菌,挑取阳性菌落培养、提取质粒,测序正确后命名为SUT5-C和SUT5-N。然后以SUT5-C和SUT5-N质粒为模板设计通用无缝克隆引物TYF/TYR(电子附表1)进行PCR扩增。扩增产物连接进入经Ⅰ线性化的目的载体pRCS2-ocs-nptⅡ。完成构建的表达质粒经电击转化根癌农杆菌EHA105。挑取农杆菌单克隆接种到含有相应抗生素的YFP液体培养基中,待菌液A260≈0.8时收集菌体。将上述菌体用Induce medium调整浓度至A260值为0.1—0.2,用不加针头的注射器将菌液注射到6—8周龄大小的本氏烟草()叶片中。暗培养2.5 d后,取其叶片在激光共聚焦显微镜(SP5,Leica)下观察荧光信号。同时以膜蛋白OsSWEET11-GFP融合表达载体[37]和空载体转化农杆菌侵染烟草叶片作为阳性对照和阴性对照。
1.2.3OsSUT5组织定位材料的构建 选取预测启动子序列(其ATG上游2 005 bp片段),根据此序列设计两端分别带有HⅠ和Ⅰ酶切位点的引物ProOsSUT5-F/ProOsSUT5-R(电子附表1),以水稻基因组DNA为模板,用KOD-Plus-Ver.2(Toyobo)高保真酶进行扩增反应。选择HⅠ和Ⅰ双酶切质粒pCAMBIA1300,酶切完成后凝胶电泳回收,与经同样双酶切的预测启动子扩增产物连接,转化大肠杆菌感受态细胞。然后挑取阳性单克隆培养,提取质粒,测序正确后将质粒命名为1300-ProSUT5。将该质粒电击转化农杆菌EHA105感受态细胞。农杆菌阳性克隆液体培养后按常规方法侵染水稻愈伤组织,通过筛选、分化培养、生根培养获得转基因组织定位材料的幼苗。幼苗经PCR扩增测序鉴定后在温室及水稻试验基地种植。
1.2.4突变体材料的构建 将登录号输入到Spacer数据库(瞿礼家教授实验室),按照Miao等[38]方法选择位于第1、4、7外显子上的序列为靶点(电子附表1)。分别在Spacer的正义链5′端加上GGCA,反义链5′端加上AAAC合成寡核苷酸链。3对Spacer寡核苷酸退火后分别与用Ⅰ单酶切pOs-sgRNA载体进行连接反应。连接产物转化大肠杆菌,挑取阳性克隆培养,提取质粒。测序正确的质粒分别命名为sgRNA-OsSUT5-Spacer1、sgRNA-OsSUT5-Spacer2和sgRNA-OsSUT5-Spacer3。然后将它们分别与pH-Ubi-Cas9-7目的载体通过LR Clonase™ II enzyme mix进行Gateway LR反应。反应产物转化大肠杆菌感受态细胞,然后挑取阳性菌落培养提取质粒。质粒测序正确后分别命名为pOsSUT5-/1/ 2/3-Cas9。最后,将这些质粒分别转化进入农杆菌,按常规程序侵染水稻愈伤组织获得CRISPR-Cas9编辑的突变体材料。
1.2.5纯合突变水稻株系的鉴定 通过CRISPR/ Cas9编辑获得转基因幼苗后,提取其基因组DNA。首先根据Cas9编码序列设计引物Cas9-F/Cas9-R进行第一轮筛选鉴别转基因阳性植株。然后分别在3个Spacer靶点序列两端设计第二轮扩增引物(电子附表1)对阳性转基因植株进行基因编辑效果的验证。
1.2.6纯合突变体水稻表型分析及数据处理 在奥林巴斯解剖镜(Olympus MVX10BX51)下观察OsSUT5组织定位材料的GUS染色结果。花粉染色以及萌发结果在奥林巴斯显微镜(BX51)下观察。日本晴野生型和纯合突变体水稻结实后统计结实率、千粒种以及种子萌发率。样品设3个生物学重复。采用Microsoft Excel进行数据统计及显著性分析,柱状图代表的数据为平均值±标准偏差(SD)。
1.2.7 SUT(C)的系统发育分析 根据已发表的文章[5,10, 15,39-44],通过NCBI收集SUT(C)基因编码蛋白序列153个。将这些蛋白序列用Clustal Omega进行在线序列比对,然后在BioEdit中对序列进行剪切。选取其中保守度高的252个氨基酸做建树分析。结果输入MEGA-X,用邻接法(NJ)构建系统发育。Bootstrap=1 000。
2 结果
2.1 OsSUT5的表达模式分析
2.1.1主要在水稻的茎、叶、花序和颖果中表达 对水稻根、叶、茎、叶鞘、花序以及开花后3、4、5、6、7和12 d的颖果进行qRT-PCR检测其表达丰度,从结果可以看出,在水稻的茎、叶、花序中表达较弱,而在颖果发育早期表达量较高(图1)。这个结果与水稻基因芯片分析结果吻合(https:// ricexpro.dna.affrc.go.jp/GGEP/graph-view.php?featurenum=24366)。
2.1.2 OsSUT5的亚细胞定位 将预测启动子启动报告基因的表达载体转入水稻愈伤组织,通过抗生素抗性筛选以及器官分化获得转基因幼苗。剪取幼苗的根、叶片以及在田间生长时期剪取茎、叶鞘、花器官和颖果部位进行GUS染色(图2)。结果显示,该基因表达蛋白在根、茎、叶、花和颖果的器官中均有表达。OsSUT5在水稻营养器官中的表达集中于维管束;生殖生长期间该蛋白在花药及发育早期颖果的盾片和胚根鞘中表达强烈。
2.2 OsSUT5-GFP融合蛋白定位于细胞质膜上
为验证OsSUT5的膜定位特征,构建OsSUT5-GFP融合蛋白表达载体并将该载体转入农杆菌。通过农杆菌侵染烟草叶片表皮细胞进行瞬时表达分析。激光共聚焦显微镜观察结果显示,与膜定位的阳性对照OsSWEET11-GFP融合蛋白一样[33],OsSUT5-GFP融合蛋白的荧光也定位在细胞质膜(图3)。与此形成对比的是,转化空载体的阴性对照烟草细胞中绿色荧光在细胞核和细胞膜都有分布。

图1 OsSUT5表达的qRT-PCR分析

A:萌发3 d的幼根;B:苗期幼茎横切面;C:孕穗期叶片;D:即将抽穗的小花;E:开花后9 d的颖果。F:开花后9 d颖果的胚。白色箭头指示维管组织;红色箭头指示盾片;黄色箭头指示胚根鞘。图中标尺为1 mm

图3 OsSUT5-GFP融合蛋白在烟草叶片表皮细胞中瞬时表达的亚细胞定位
2.3 OsSUT5突变体的表型分析
2.3.1 突变体材料的分子鉴定及田间表型分析 对CRISPR-Cas9编辑的水稻突变体材料进行基因组DNA提取、高保真DNA聚合酶扩增,测序鉴定后选取其中3个表型一致的株系、和作进一步分析。这3个株系的编辑位点以及在外显子上的位置如图4-C所示,株系Spacer1对应区域的第17位A和第18位G核苷酸之间,也就是PAM上游第3—4位核苷酸之间的Cas9核酸酶切割处,插入了一个腺嘌呤核苷酸A。株系Spacer2对应区域的第17位T和第18位C核苷酸之间插入1个胸腺嘧啶核苷酸T。株系Spacer3对应区域末端核苷酸下游第3位G和第4位C核苷酸之间插入1个腺嘌呤核苷酸A。这3个编辑位点的突变都造成OsSUT5翻译过程中肽链的提前终止。不过,突变体植株在营养生长期间外形和野生型材料没有明显差异。
然而,到了生殖生长期间,由于突变株系抽出的稻穗较轻,所以它们的弯曲度较野生型稻穗的弯曲度小(图4-A和图4-B)。对的3个突变株系结实率统计结果显示(图4-E),突变体植株空粒(即没有成功授粉引起子房膨大的小穗)的比例较野生型的明显增多。相对于野生型的7%,3个突变株系的空粒率分别约为20%、13%和13%。不过,瘪粒(授粉后子房膨大但没有灌浆的流产颖果)在野生型和突变株系之间无显著区别。比较突变体和野生型水稻的千粒重,显示它们之间无明显区别(图4-H)。值得注意的是,突变体的颖果垩白明显增加,而野生型水稻颖果的垩白较少(图4-D和图4-F);并且突变体颖果长度较野生型有一定程度的增加(图4-D和图4-G)。将突变株系与野生型对照水稻连续种植了3代,结果均一致表明突变株系与野生型水稻之间结实率以及颖果的垩白和长度方面存在明显差异。
2.3.2突变体的表型分析 为了探索敲除造成水稻结实率显著下降的原因,首先比较野生型与突变水稻株系的花器官。它们在形态结构上并无明显差异(结果未显示)。花粉的KI-I2染色显示突变体花粉比野生型花粉的活性有轻微的降低(图5-I)。相对于野生型约99%的碘染活性,3个突变株系花粉碘染活性分别为96%、96%和95%。为了进一步检验突变基因是否对花粉功能产生影响,对花粉的体外萌发进行了分析。通过将新鲜花粉抖落在淀粉培养基上培养,1 h后观察并统计它们萌发的比例(图5-J),3个突变株系花粉的体外萌发率分别为50%、43%和52%,平均约为48%;而野生型对照的花粉体外萌发率约为65%。说明敲除导致突变植株花粉体外萌发率显著降低。
2.3.3 SUT蛋白的系统发育分析 由于近年来不断有新的SUT(C)家族基因被克隆,因此,从已发表的文章中收集到153个SUT(C)基因,并对它们进行系统发育分析。运用Clustal Omega进行氨基酸序列比对,然后通过MEGA-X进行系统发育分析。结果显示,这些蛋白可分为4个大的亚族(图6)。其中OsSUT5和OsSUT1、OsSUT3属于同一亚族Ⅲ。而AtSUT5则属于亚族Ⅰ。这个结果与Sauer[5]的分类较为接近。不过,其系统中的OsSUT2和OsSUT4属于同一亚族,而图6结果显示它们分别属于Ⅱ和Ⅳ亚族。
3 讨论
光合产物蔗糖运输和分配对植物的生长发育有重要影响。蔗糖-质子主动运输蛋白SUT(C)家族成员在此过程中的作用也逐步得到证实。本研究通过对在水稻日本晴不同器官和生长时期的qRT-PCR检测,表明它在水稻茎、叶、花序以及发育早期的颖果中表达(图1)。这个结果与Aoki等[10]用半定量PCR分析结果基本一致,但AOkI等的研究结果显示该基因在叶片中表达更强,而本研究qRT-PCR结果表明,该基因在颖果中表达最强。蛋白水平上GUS示踪的组织定位结果显示在水稻的营养器官中,OsSUT5主要集中在维管束中表达;而在生殖生长期间,GUS染色结果显示OsSUT5在花药、特别是颖果的盾片和胚根鞘中有强烈的表达(图2),提示该蛋白在花序和颖果发育过程中可能有重要作用。
为验证OsSUT5的生理功能,本研究通过CRISPR-Cas9基因编辑系统构建了一系列的敲除纯合突变植株并从中选取3个独立株系进行表型分析。结果显示,突变植株与野生型在株高、分蘖、颖花外形和千粒重方面均无明显差异(图4-H)。然而,结实情况统计显示,3个突变株系中没有授粉的小穗形成的空粒较野生型对照明显增多(图4-B和图4-E)。突变株系的结实率也由野生型的90%左右下降到突变株系的80%左右。造成授粉失败产生空粒的原因可能来源于花粉的活性降低和/或花粉管的萌发以及雌、雄配子的结合过程,所以本研究首先对突变株系花粉活性及其萌发率进行了比较。KI-I2染色结果(图5)显示,突变株系的花粉活性相对于野生型只有微弱的降低。然而,突变体花粉的萌发率由野生型的65%左右降低至突变株系的48%左右。这些结果说明突变株系结实率降低的原因很可能是由花粉活性及其萌发率降低造成的。

WT:野生型。ossut5-1、ossut5-17、ossut5-25为基因编辑水稻的3个纯合突变株系。A:野生型水稻植株与OsSUT5突变植株对比;B:稻穗的形态比较;C:突变位点鉴定;D:颖果长度比较;E:结实率统计;F:颖果形态比较;G:颖果长度统计图。H:颖果千粒重统计图。E、G、H中不同小写字母代表显著差异(P<0.05)。下同
一个不容忽视的因素是,水稻授粉过程表现出一种群体效应,也就是一个小穗的柱头通常接受20个甚至更多的花粉,所以通常不止一个花粉在柱头上萌发并竞争与雌配子结合的机会,尽管绝大多数情况下最终只有一个花粉管中的精子进入子房完成双受精[45-46]。因此,在花粉量较多的情况下即使花粉活性的比例不高也可能不会影响水稻的结实率。所以,突变株系结实率降低是否由花粉活性及其萌发率降低所致还需进一步证实。特别是将来观察突变体水稻雌、雄配子结合过程才能够对此做出准确的判断。
与及其编码蛋白在花序及发育早期的颖果中强烈表达[9](图1和图2)相吻合的是,在粳稻日本晴中敲除显著降低结实率(图4-B和图4-E)。尽管突变植株的千粒重并未受到显著影响(图4-H),但它们的颖果长度增加(图4-D),而且垩白明显增多(图4-F和图4-G)。此前也有研究显示在籼稻品种明恢中转入的反义基因同样引起了颖果垩白增多[33]。由于垩白是水稻品质的重要指标[47],说明敲除不仅影响了颖果的形态,而且也影响了水稻颖果的品质。
比较和的表达特性、分子水平上的功能特点和敲除它们对植株的影响,可以发现,这两个蛋白都能够运输蔗糖。而且有研究显示,AtSUC5还能够运输生物素[31]。不过,OsSUT5是否同样能够运输生物素还有待验证。此外,在胚乳中表达,敲除该基因导致拟南芥胚发育轻微延迟。本研究结果显示敲除除了导致水稻结实率有显著下降、其原因可能是由于花粉活性和萌发率下降造成以外(图5),颖果的发育也受到了明显的影响(图4)。这些事实说明OsSUT5和AtSUT5的生理功能存在明显的区别。实际上,从系统发育的角度来看,无论是本研究的系统发育分析(图6。用最大似然法构建的ML树结果类似,未显示)还是此前已经报道的结果,在SUT(C)家族中,OsSUT5和AtSUC5都不属于同一个亚族[5,10]。
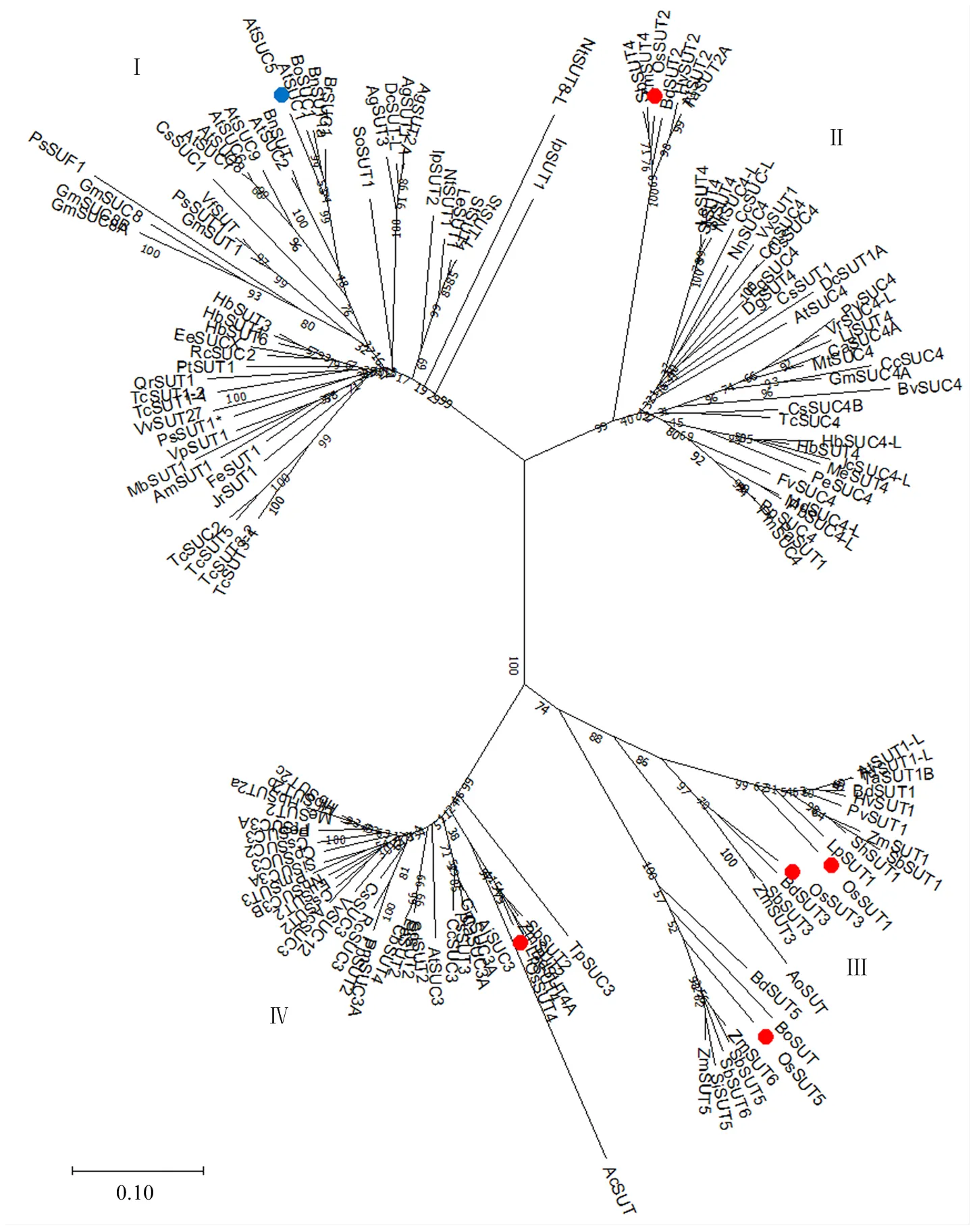
红色圆点标记表示水稻SUT蛋白。蓝色圆点表示拟南芥SUC5。图中153个蛋白及其Accession numbers见电子附表2
OsSUT5与已经报道的OsSUT1和OsSUT4在水稻颖果中都有较强的表达,而且敲除或降低这些基因的表达对水稻的结实率和产量都有明显的影响[26,29-30](图4),这些结果凸显了SUT作为蔗糖主动运输蛋白在水稻颖果灌浆过程中的重要作用。另一方面,已有研究和本研究结果都表明、、和在水稻花粉发育中也有不可替代的作用[22,29-30,48-49](图5)。不过,敲除导致水稻因颖果不能灌浆而完全不育(未发表结果),而敲除和造成的后果相对较轻[29-30](图4),说明它们的功能也存在明显的区别。
4 结论
OsSUT5不仅在花粉发育与萌发过程中有一定作用,而且敲除对水稻的结实率、颖果形态和品质也有明显影响。SUT蛋白在水稻生殖生长期间特别是灌浆过程中作用更为突出,这些作用很可能与蔗糖的运输和代谢相关。
[1] KHUSH G S. Green revolution: The way forward. Nature Review Genetics, 2001, 2(10): 815-822.
[2] LEMOINE R, LA CAMERA S, ATANASSOVA R, DÉDALDÉCHAMP F, ALLARIO T, POURTAU N, BONNEMAIN J L, LALOI M, COUTOS-THÉVENOT P, MAUROUSSET L, FAUCHER M, GIROUSSE C, LEMONNIER P, PARRILLA J, DURAND M. Source-to-sink transport of sugar and regulation by environmental factors. Frontiers in Plant Science, 2013, 4: 272.
[3] BIHMIDINE S, HUNTER C T 3RD, JOHNS C E, KOCH K E, BRAUN D M. Regulation of assimilate import into sink organs: update on molecular drivers of sink strength. Frontiers in Plant Science, 2013, 4: 177.
[4] YADAV U P, AYRE B G, BUSH D R. Transgenic approaches to altering carbon and nitrogen partitioning in whole plants: assessing the potential to improve crop yields and nutritional quality. Frontiers in Plant Science, 2015, 6: 275.
[5] SAUER N. Molecular physiology of higher plant sucrose transporters. FEBS Letters, 2007, 581(12): 2309-2317.
[6] LEMOINE R. Sucrose transporters in plants: Update on function and structure. Biochimica et Biophysica Acta, 2000, 1465(1/2): 246-262.
[7] ABRAMSON J, SMIRNOVA I, KASHO V, VERNER G, KABACK H R, IWATA S. Structure and mechanism of the lactose permease of. Science, 2003, 301(5633): 610-615.
[8] RIESMEIER J W, WILLMITZER L, FROMMER W B. Isolation and characterization of a sucrose carrier cDNA from spinach by functional expression in yeast. The EMBO Journal, 1992, 11(13): 4705-4713.
[9] HIROSE T, IMAIZUMI N, SCOFIELD G N, FURBANK R T, OHSUGI R. cDNA cloning and tissue-specific expression of a gene for sucrose transporter from rice (L.). Plant and Cell Physiology, 1997, 38(12): 1389-1396.
[10] AOKI N, HIROSE T, SCOFIELD G N, WHITFELD P R, FURBANK R T. The sucrose transporter gene family in rice. Plant and Cell Physiology, 2003, 44(3): 223-232.
[11] LALONDE S, WIPF D, FROMMER W B. Transport mechanisms for organic forms of carbon and nitrogen between source and sink. Annual Review of Plant Biology, 2004, 55: 341-372.
[12] AYRE B G. Membrane-transport systems for sucrose in relation to whole-plant carbon partitioning. Molecular Plant, 2011, 4(3): 377-394.
[13] DUO P, GU X, XUE L J, LEEBENS-MACK J H, TSAI C J. Bayesian phylogeny of sucrose transporters: ancient origins, differential expansion and convergent evolution in monocots and dicots. Frontiers in Plant Science, 2014, 5: 615.
[14] ZHANG C K, HAN L, SLEWINSKI T L, SUN J L, ZHANG J, WANG Z Y, TURGEON R. Symplastic phloem loading in poplar. Plant Physiology, 2014, 166(1): 306-313.
[15] KÜHN C, GROF C P. Sucrose transporters of higher plants. Current Opinion in Plant Biology, 2010, 13(3): 287-297.
[16] HACKEL A, SCHAUER N, CARRARI F, FERNIE A R, GRIMM B C, KÜHN C. Sucrose transporter LeSUT1 and LeSUT2 inhibition affects tomato fruit development in different ways. The Plant Journal, 2006, 45(2): 180-192.
[17] SIVITZ A B, REINDERS A, WARD J M.sucrose transporter AtSUC1 is important for pollen germination and sucrose-induced anthocyanin accumulation. Plant Physiology, 2008, 147(1): 92-100.
[18] PAYYAVULA R S, TAY K H C, TSAI C J, HARDING S A. The sucrose transporter family in Populus: the importance of a tonoplast PtaSUT4 to biomass and carbon partitioning. The Plant Journal, 2011, 65(5): 757-770.
[19] CHINCINKA I, GIER K, KRÜGEL U, LIESCHE J, HE H, GRIMM B, HARREN F J M, CRISTESCU S M, KÜHN C. Photoperiodic regulation of the sucrose transporter StSUT4 affects the expression of circadian-regulated genes and ethylene production. Frontiers in Plant Science, 2013, 4: 26.
[20] FURBANK R T, SCOFIELD G N, HIROSE T, WANG X D, PATRICK J, OFFLER C E. Cellular localization and function of a sucrose transporter OsSUT1 in developing rice seeds. Australian Journal of Plant Physiology, 2001, 28(12): 1187-1196.
[21] HIROSE T, TAKANO M, TERAO T. Cell wall invertase in developing rice caryopsis: molecular cloning of OsCIN1 and analysis of its expression in relation to its role in grain filling. Plant and Cell Physiology, 2002, 43(4): 452-459.
[22] HIROSE T, ZHANG Z, MIYAO A, HIROCHIKA H, OHSUGI R,TERAO T. Disruption of a gene for rice sucrose transporter, OsSUT1, impairs pollen function but pollen maturation is unaffected. Journal of Experimental Botany, 2010, 61(13): 3639-3646.
[23] ISHIMARU K, HIROSE T, AOKI N, TAKAHASHI S, ONO K, YAMAMOTO S, WU J, SAJI S, BABA T, UGAKI M, MATSUMOTO T, OHSUGI R. Antisense expression of a rice sucrose transporter OsSUT1 in rice (L.). Plant and Cell Physiology, 2001, 42(10): 1181-1185.
[24] ISHIBASHI Y, OKAMURA K, MIYAZAKI M, PHAN T, YUASA T, IWAYA-INOUE M. Expression of rice sucrose transporter gene OsSUT1 in sink and source organs shaded during grain filling may affect grain yield and quality. Environmental and Experimental Botany, 2014, 97: 49-54.
[25] SCOFIELD G N, HIROSE T, AOKI N, FURBANK R. Involvement of the sucrose transporter, OsSUT1, in the long- distance pathway for assimilate transport in rice. Journal of Experimental Botany, 2007, 58(12): 3155-3169.
[26] SCOFIELD G N, HIROSE T, GAUDRON J A, FURBANK R T. Antisense suppression of the rice transporter gene,, leads to impaired grain filling and germination but does not affect photosynthesis. Functional Plant Biology, 2002, 29(7): 815-826.
[27] Zhang J, Li D, Xu X, Ziska L H, Zhu J, Liu G, Zhu C. The potential role of sucrose transport gene expression in the photosynthetic and yield response of rice cultivars to future CO2concentration. Physiologia Plantarum, 2020, 168: 218-226.
[28] Eom J S, Cho J I, Reinders A, Lee S W, Yoo Y, Tuan P Q, Choi S B, Bang G, Park Y I, Cho M H, Bhoo S H, An G, Hahn T R, Ward J M, Jeon J S. Impaired function of the tonoplast-localized sucrose transporter in rice, OsSUT2, limits the transport of vacuolar reserve sucrose and affects plant growth. Plant Physiology, 2011, 157(1): 109-119.
[29] 李孟珠, 王高鹏, 巫月, 任怡, 李刚华, 刘正辉, 丁艳锋, 陈琳. 水稻蔗糖转运蛋白OsSUT4参与蔗糖转运的功能研究. 中国水稻科学, 2020, 34(6): 491-498.
LI M Z, WANG G P, WU Y, REN Y, LI G H, LIU Z H, DING Y F, CHEN L. Function analysis of sucrose transporter OsSUT4 in sucrose transport in rice. Chinese Journal of Rice Science, 2020, 34(6): 491-498. (in Chinese)
[30] 岳萌萌. 水稻蔗糖转运蛋白OsSUT4的功能分析[D]. 泰安: 山东农业大学, 2020.
Yue M M. Functional analysis of a rice sucrose transporter OsSUT4[D]. Taian: Shandong Agricultural University, 2020. (in Chinese)
[31] SUN Y, REINDERS A, LAFLEUR K R, MORI T, WARD J M. Transport activity of rice sucrose transporters OsSUT1 and OsSUT5. Plant and Cell Physiology, 2010, 51(1): 114-122.
[32] BAUD S, WUILLÈME S, LEMOINE R, KRONENBERGER J, CABOCHE M, LEPINIEC L, ROCHAT C. The AtSUC5 sucrose transporter specifically expressed in the endosperm is involved in early seed development in. The Plant Journal, 2005, 43(6): 824-836.
[33] LUDWIG A, STOLZ J, SAUER N. Plant sucrose-H+symporters mediate the transport of vitamin H. The Plant Journal, 2000, 24(4): 503-509.
[34] 张武君, 管其龙, 付艳萍, 苏军. 反义抑制水稻蔗糖转运蛋白基因()的表达降低其愈伤组织诱导和植株再生频率. 农业生物技术学报, 2014, 22: 825-831.
Zhang W J, Guan Q L, Fu Y P, Su J. Antisense suppression of rice sucrose transporter gene () expression reduces its callus induction and plant regeneration frequency. Journal of Agricultural Biotechnology, 2014, 22: 825-831. (in Chinese)
[35] 杜琳. OsSUT对水稻灌浆生理的分子调控[D]. 福州: 福建农林大学, 2010.
DU L. Molecular regulation of OsSUT on rice filling physiology[D]. Fuzhou: Fujian Agricultural & Forestry University, 2010. (in Chinese)
[36] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)). Methods, 2001, 25: 402-408.
[37] Ma L, Zhang D C, Miao Q, Yang J, Xuan Y H, Hu Y B. Essential role of sugar transporter OsSWEET11 during the early stage of rice grain filling. Plant and Cell Physiology, 2017, 58(5): 863-873.
[38] Miao J, Guo D, Zhang J, Huang Q, Qin G, Zhang X, Wan J, Gu H, Qu L J. Targeted mutagenesis in rice using CRISPR-Cas system. Cell Research, 2013, 23: 1233-1236.
[39] 戚继艳, 阳江华, 唐朝荣. 植物蔗糖转运蛋白的基因与功能. 植物学通报, 2007, 24: 532-543.
Qi J Y, Yang J H, Tang C R. Sucrose transporter genes and their functions in plants. Chinese Bulletin of Botany, 2007, 24: 532-543. (in Chinese)
[40] 陈钢, 母天燕, 曹光球, 林强, 郑宏, 曹世江. 杉木蔗糖转运蛋白SUT基因的克隆和功能分析. 西北林学院学报, 2020, 35(2): 8-14.
CHEN G, MU T Y, CAO G Q, LIN Q, ZHENG H, CAO S J. Cloning and functional analysis of Chinese Fir sucrose transporter SUT gene. Journal of Northwest Forestry University, 2020, 35(2): 8-14. (in Chinese)
[41] 康爽, 贺红霞, 王铭, 郭嘉, 薛晶. 杏蔗糖转运蛋白基因PaSUC4的获得及其生物信息学分析. 生物技术进展, 2016, 6: 105-112.
KANG S, HE H X, WANG M, GUO J, XUE J. The acquisition and bioinformatic analysis of sucrose transporter protein gene PasUC4 from apricot. Current Biotechnology, 2016, 6: 105-112. (in Chinese)
[42] 齐素坤, 侯夫云, 秦桢, 李爱贤, 王庆美, 张立明. 植物蔗糖转运蛋白研究进展. 山东农业科学, 2016, 48(2): 149-153.
Qi S K, Hou F Y, Qin Z, Li A X, Wang Q M, Zhang L M. Research progress of sucrose transporters in plant. Shandong Agricultural Science, 2016, 48(2): 149-153. (in Chinese)
[43] 张清, 胡伟长, 张积森. 植物蔗糖转运蛋白研究进展. 热带作物学报, 2016, 37(1): 193-202.
ZHANG Q, HU W C, ZHANG J S. Sucrose transporters in plants. Chinese Journal of Tropical Crops, 2016, 37(1): 193-202. (in Chinese)
[44] 张立军, 李晓宇, 阮燕晔. 双子叶与单子叶植物蔗糖转运蛋白的研究进展. 沈阳农业大学学报, 2008, 39(3): 259-264.
ZHANG L J, LI X Y, RUAN Y Y. Progress on sucrose transporters in dicotyledons and monocotyledons. Journal of Shenyang Agricultural University, 2008, 39(3): 259-264. (in Chinese)
[45] 王忠. 水稻的开花与结实. 北京: 科学出版社, 2014: 91-109.
Wang Z. The flowering and fruiting of rice. Beijing: Science Press, 2014: 91-109. (in Chinese)
[46] 杨宏远. 水稻生殖生物学. 杭州: 浙江大学出版社, 2005: 91-98.
Yang H Y. Rice Reproductive Biology. Hangzhou: Zhejiang University Press, 2005: 91-98. (in Chinese)
[47] 周立军, 江玲, 翟虎渠, 万建民. 水稻垩白的研究现状与改良策略. 遗传, 2009, 31(6): 563-572.
Zhou L J, Jiang L, Zhai H Q, Wan J M. Research status and improvement strategies of rice chalkiness. Heredity, 2009, 31(6): 563-572. (in Chinese)
[48] LI D, XU R, LV D, ZHANG C, YANG H, ZHANG J, WEN J, LI C, TAN X. Identification of the core pollen-specific regulation in the rice OsSUT3 promoter. International Journal of Molecular Sciences, 2020, 21(6): 1909.
[49] 李丹丹, 李娟, 栾一方, 张春龙, 徐汝聪, 吕东, 谭亚玲, 谭学林. 水稻OsSUT3基因启动子的克隆及表达分析. 分子植物育种, 2018, 16: 7225-7233.
LI D D, LI J, LUAN Y F, ZHANG C L, XU R C, Lü D, TAN Y L, TAN X L. Cloning and expression analysis of OsSUT3 gene promoter from. Molecular Plant Breeding. 2018, 16: 7225-7233. (in Chinese)
Function of Sucrose Transporter OsSUT5 in Rice Pollen Development and Seed Setting
ZHANG YaWen1, BAO ShuHui1, TANG ZhenJia1, WANG XiaoWen1,2, YANG Fang3, ZHANG DeChun4, HU YiBing1
1College of Resources & Environmental Sciences, Nanjing Agricultural University, Nanjing 210095;2College of Horticulture, Nanjing Agricultural University, Nanjing 210095;3State Key Laboratory of Hybrid Rice, College of Life Sciences, Wuhan University, Wuhan 430072;4Bio-technology Research Center, China Three Gorges University, Yichang 443002, Hubei
【】 Sucrose is the main form of photosynthates transported in the plant, and sucrose transporters (or sucrose carrier, SUT/SUC) play important roles in the transport of sucrose across the plasma membrane between cells and allocation of sucrose among different tissues and organs. The rice SUT family possesses 5 members. Knockout of the genes encoding,,orconfers significant effects on rice indicating that the functions of these genes are indispensable. However, the physiological role of OsSUT5 has not been systematically characterized. This study aims at elucidating the function of OsSUT5 in rice growth and development and provides new evidence for a comprehensive understanding of SUT’s role in model plant rice. 【】In this study, the temporal and spatial expression pattern ofwas analyzed via quantitative real-time PCR. The tissue localization of OsSUT5 in rice was tested via GUS represented expressions driven by the putative promoter ofand subcellular localization of transiently expressed OsSUT5-GFP fusion protein was observed in leaf cells of tobacco. In addition, CRISPR-Cas9 mediated gene editing was employed to create mutant lines of the gene for the characterization of. 【】Our results show thatwas expressed in culm, leaf, inflorescence, and caryopsis of rice but it was predominantly expressed in inflorescence and developing caryopsis at the transcriptional level. At the protein level, it was prominently expressed in the vascular bundles of rice vegetative organs. In reproductive organs, the protein was mainly expressed in the anther and developing caryopsis, particularly in the scutellum and coleorhiza. Transient expression of OsSUT5-GFP fusion protein in epidermis cells of tobacco leaf indicated that it was localized on the plasma membrane. Compared with the wild-type control, three homozygous mutant lines ofcreated via CRISPR-Cas9 gene-editing system consistently showed reduced pollen viability, a lower percentage of germination rates. Accordingly, the percentage of unpollinated florets and seed-setting rate decreased significantly. Comparison ofmutant lines and the wild-type control showed that more chalk was observed in the mutant caryopses than that of the wild type. In the mutant lines, caryopsis length increased but 1000 grain weight didn’t show a significant difference between the mutants and the wild-type control based on statistics. 【】These results indicate that OsSUT5 played an important role in pollen development and probably also in the fertilization process. Knockout of the gene affected the morphology and quality of rice caryopsis. Given the sucrose transport capacity of OsSUT5 and its plasma membrane localization, it can be deduced that function of OsSUT5 including its influence on rice pollen viability and endosperm development is related to its sucrose transport activity at the cellular level.
rice; OsSUT5; CRISPR-Cas9; pollen germination; seed setting rate; chalk

10.3864/j.issn.0578-1752.2021.16.001
2020-12-18;
2021-02-12
国家自然科学基金(31371596)、武汉大学杂交水稻国家重点实验室开放基金(KF202104)
张雅文,E-mail:zyw0615yaya@163.com。通信作者胡一兵,E-mail:huyb@njau.edu.cn。通信作者张德春,E-mail:zhangdc227@163.com
(责任编辑 李莉)

