唐古特白刺果实多糖提取工艺优化及其抗氧化活性研究
金建华,柳詹,秦世荣
(青海民族大学化学化工学院,青海 西宁810007)
白刺是蒺藜科白刺属的落叶小灌木,白刺果实有“沙漠樱桃”之称[1-2],含有多糖、黄酮、多酚、生物碱、花青素、脂肪酸、维生素及矿物元素等成分[3-4],有抗氧化、生津、养胃健脾、利肺、解郁、化食等功效[5],其中多糖具有增强机体免疫力、抗自由基[6]、预防心脑血管疾病[7]、促进机体分泌胰岛素[8]、保肝等重要的生物学功能[9-11].由此已被广泛运用到临床、保健品、餐饮界等领域.目前,多糖有水提法、酶提取法、超声波提取法等[12-15],但都存在工艺复杂、提取周期长、提取率低、多糖活性易被破坏等缺陷.快速溶剂萃取技术(Fully Automatic Rapid Solvent Extraction,APLE)是新分离方法[16-17],因其具有提取率高、快速和节省溶剂、活性成分不易被破坏等优点,已应用于食品、药品活性成分的提取和分离[18-19].
唐古特白刺在青海省柴达木盆地约23万hm2,年产量约10~15万t[20-21],自然资源丰富,由于产于海拔高、紫外线强、气候干燥等特殊生态环境,其矿物成分、营养成分、功效成分与其他地区的白刺有一定的差异[22-23].目前,利用快速溶剂萃取法提取唐古特白刺果实多糖的研究未见报道,抗氧化活性也鲜有探究,为了充分开发利用唐古特白刺这一资源,笔者研究了快速溶剂萃取法提取唐古特白刺果实多糖的最优工艺条件,并分析其抗氧化活性.
1 实验方法
1.1 材料、试剂与仪器
唐古特白刺果实采于青海省海西州柴达木盆地,经中国科学院西北高原生物研究所鉴定.
无水葡萄糖标准品、1,1-二苯基-2-苦肼基自由基(DPPH·)和羟自由基(·OH)等均为分析纯.
APLE-2000快速溶剂萃取仪,北京吉天有限公司.
1.2 实验方法
1.2.1 原料预处理 将新鲜的唐古特白刺果实清洗,于60℃进行干燥、粉碎,过40目的筛子备用.
脱脂:将唐古特白刺果实粉置回流装置中,在60℃下,用5倍体积石油醚回流2次.
脱单糖:加入8倍体积95%乙醇于滤渣中,75℃进行2次回流,过滤.
1.2.2 APLE多糖的提取 称取15 g唐古特白刺果实试样,以蒸馏水为溶剂,在一定的温度、提取次数、压力、时间下,提取多糖,过滤,加4倍体积的无水C2H5OH于滤液,20 h后,过滤,用Sevage法脱去多糖中蛋白,浓缩、用无水C2H5OH洗涤沉淀,干燥制得多糖.
1.2.3 标准曲线 将0.250 0 g无水葡萄糖定容于250 mL容量瓶中,配制成1 mg·mL-1的标准溶液.依次向0.10、0.20、0.30、0.40、0.50、0.60 mL葡萄糖标准溶液加入2.00 mL5%苯酚溶液,5.00 mL浓H2SO4,摇匀,40℃下恒温30 min后,在490 nm处测吸光度,以超纯水为空白对照,建立标准曲线,如图1所示,曲线方程为:A=1.943 6ρ-0.002 9(R2=0.999 2).
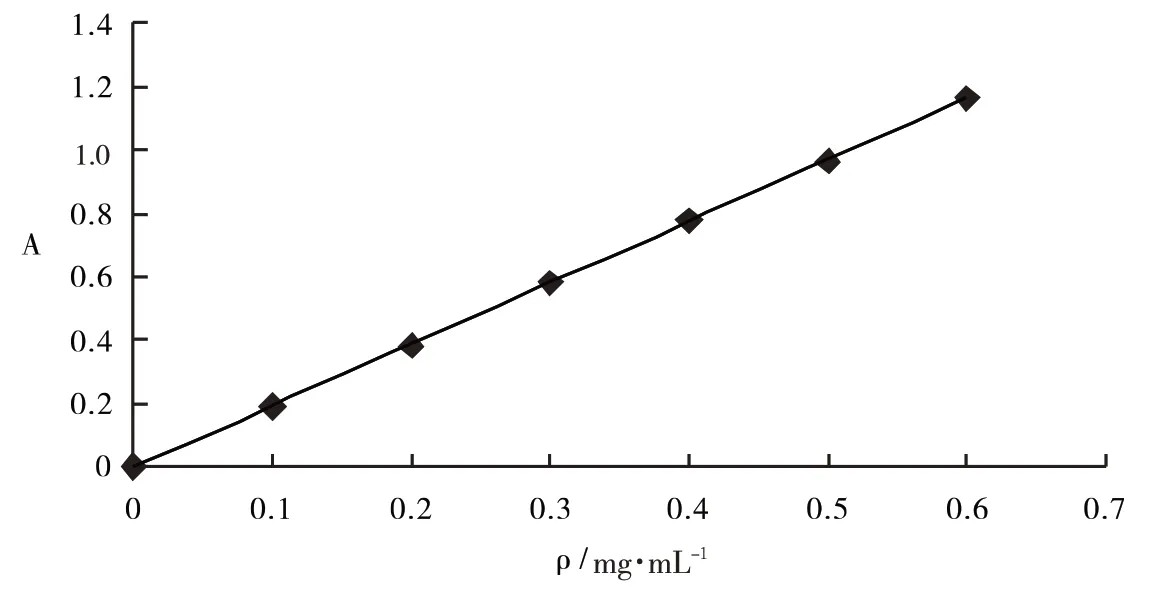
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
1.2.4 多糖测定 用苯酚-硫酸法测定多糖含量.用超纯水定容0.100 0 g唐古特白刺果实多糖于100 mL容量瓶,移取该溶液0.30 mL,按照1.2.3所示及曲线方程测定多糖含量.
1.2.5 APLE提取多糖单因素试验
1.2.5.1 提取温度 精确称取样品3.000 0g,置于萃取池中,设定APLE提取多糖时间为12 min、压力为10 MPa、重复提取2次,考察温度对多糖提取率的影响.
1.2.5.2 提取压力 精确称取样品3.000 0g,置于萃取池中,设定APLE提取多糖2次,在100℃下,考察压力对多糖提取率的影响.
1.2.5.3 提取时间 精确称取样品3.000 0g,置于萃取池中,设定APLE在10 MPa、100℃下,提取2次,考察时间对多糖提取率的影响.
1.2.5.4 提取次数 精确称取样品3.000 0g,置于萃取池中,设定APLE多糖提取压力为10 MPa,温度为100℃,时间为12 min,考察提取次数对多糖提取率的影响.
1.2.6 响应面法试验 本研究运用响应面优化法,设计了三因素三水平正交试验,见表1.

表1 试验因素水平Tab.1 Level of experimental factors
1.2.7 多糖抗氧化活性
1.2.7.1 清除DPPH·的试验[24-25].配制DPPH·样品浓度0.000 2 mol·L-1的C2H5OH溶液;配制0.05、0.10、0.20、0.40、0.60、0.80 mol·L-1多糖溶液.准确移取2.0 mL的DPPH·C2H5OH溶液分别与2.0 mL不同浓度的多糖溶液混合,避光40 min后,于517 nm处测吸光度A1,按照同样的方法测定2.0 mL 95% C2H5OH和2.0 mL不同浓度的样品液的吸光度A2,2.0 mL 95% C2H5OH和2.0 mL DPPH·C2H5OH溶液的吸光度A3.DPPH·清除率Y(%)=1-(A1-A2)/A3×100%
1.2.7.2 ·OH的清除试验[26].将2.0 mL 5 mmol·L-1硫酸亚铁溶液、2.0 mL 5 mmol·L-1过氧化氢溶液依次加入到2.0 mL 0.05、0.10、0.20、0.40、0.60、0.80 mg·mL-1的唐古特白刺果实多糖溶液中,反应12 min后,加入2.0 mL 5 mmol·L-1Vc-C2H5OH溶液,35 min后,于510 nm处测吸光度B1,按照同样的方法测定蒸馏水代替多糖和过氧化氢的吸光度B2,以蒸馏水为空白对照的吸光度B3.
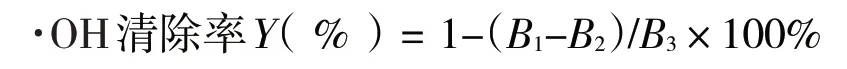
1.2.7.3 还原力试验[27-28].在1.0 mL不同浓度多糖溶液中依次加入3.0 mL 0.2 mol·L-1NaH2PO4-Na2HPO4缓冲溶液(pH为6.6)和1%K3[Fe(CN)6]溶液,混匀,50℃恒温30 min,冷却加入10%三氯醋酸3.0 mL,取混合液3.0 mL,加入0.5 mL 0.1% FeCl3溶液和3.0 mL蒸馏水,混匀,在700 nm处测吸光度.
2 结果与分析
2.1 APLE提取多糖单因素试验
2.1.1 提取压力快速溶剂萃取仪分别设计提取压力为6、8、10、12、14 MPa,结果见图2.
由图2知,在10 MPa前,增加提取压力有利用于多糖的提取,当增加到10 MPa时,达到最大提取率,随后降低,故选定9、10、11 MPa为响应面优化工艺因素水平.

图2 压力对多糖提取率的影响Fig.2 Effect of pressure on the extraction rate of polysaccharide
2.1.2 循环提取次数快速溶剂萃取仪设计循环次数为1、2、3、4、5次提取多糖,结果见图3.
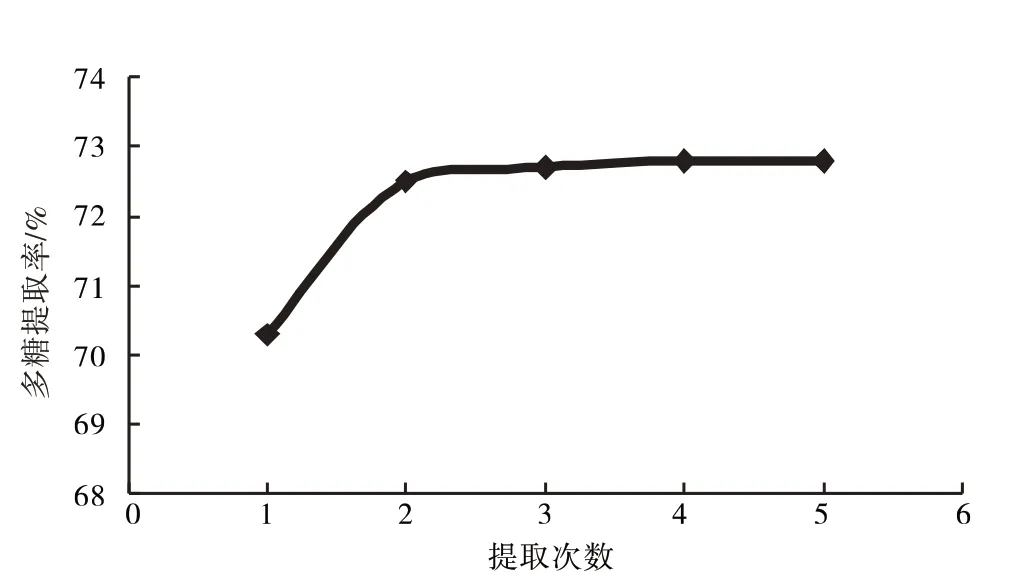
图3 提取次数对多糖提取率的影响Fig.3 Effect of extraction times on extraction rate of polysaccharide
由图3知,提取次数对多糖提取率影响不大,故选取提取次数为2次.
2.1.3 提取时间 快速溶剂萃取仪分别设计6、8、10、12、14 min提取多糖,结果见图4.
从图4知,随着提取时间的延长有利于多糖提取,在10 min后逐渐减缓,继续延长提取时间对多糖提取的影响不明显,故选取8、10、12 min为响应面优化工艺考察水平.
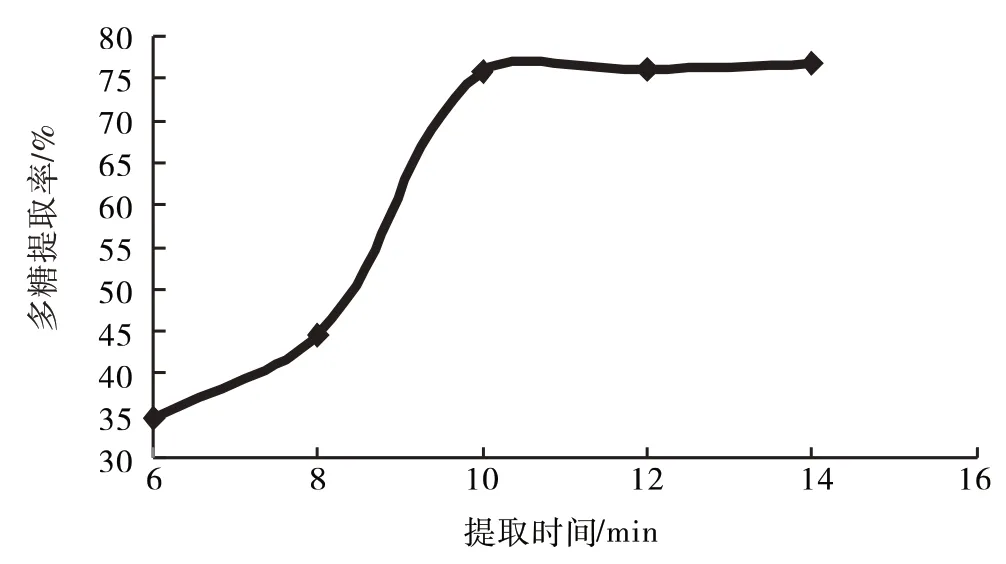
图4 提取时间对多糖提取率的影响Fig.4 Effect of extraction times on extraction rate of polysaccharide
2.1.4 提取温度 快速溶剂萃取仪分别设计70、80、90、100、110℃提取多糖,结果见图5.

图5 温度对多糖提取率的影响Fig.5 Effect of temperature on extraction rate of polysaccharide
由图5知,初始多糖提取率与温度成正比,100℃后变化不大,因此,选取90、100、110℃为响应面优化工艺考察水平.
2.2 响应面法试验
2.2.1 结果及方差分析以多糖提取率作为响应值,提取时间、温度、压力为影响因子,依据单因素试验,进行Box-Behnken响应面法试验设计,结果如表2所示.
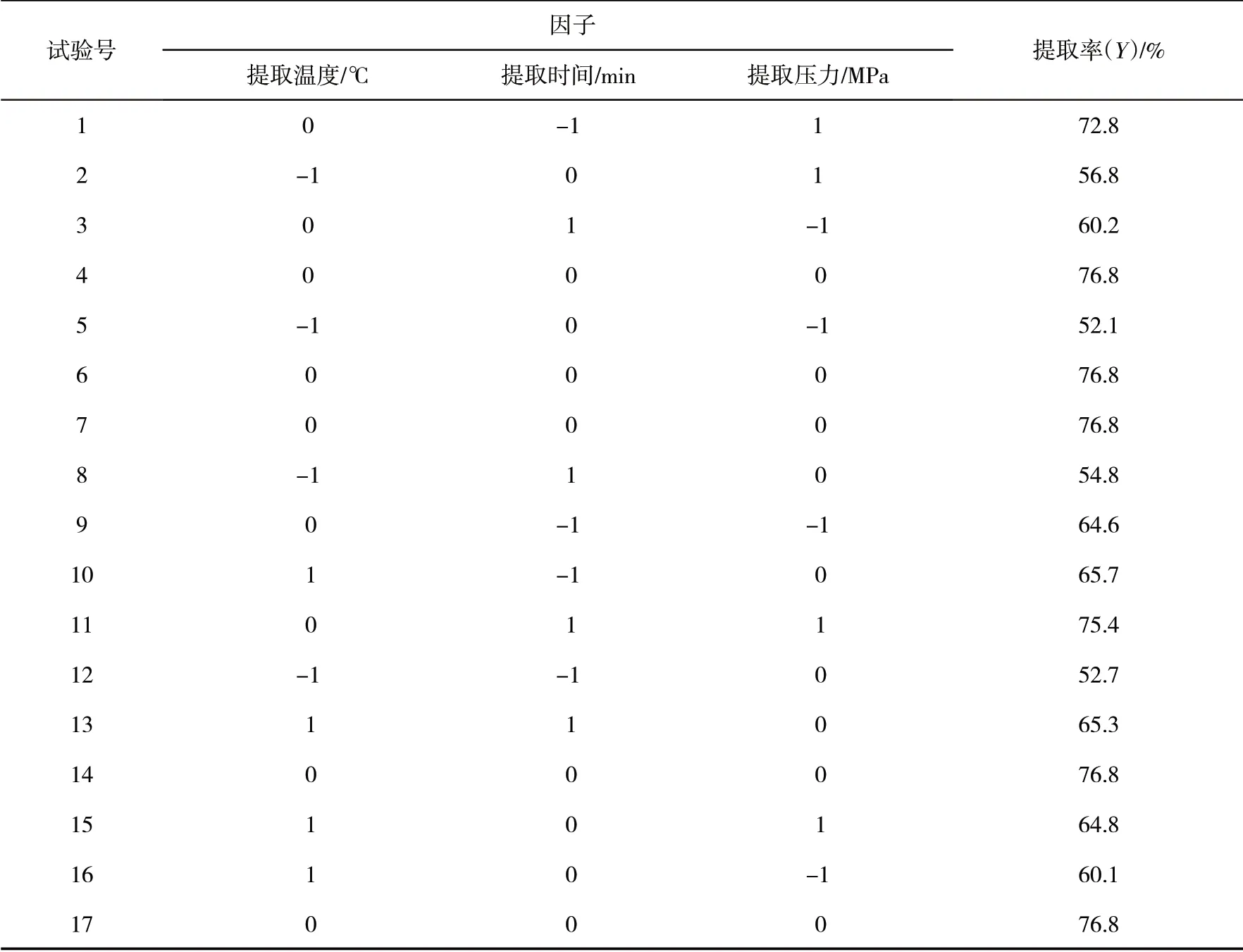
表2 试验设计Tab.2 Test design
利用Design-Expert12软件对表2数据进行分析,建立了影响因子与多糖提取率(Y)的二次回归模型:
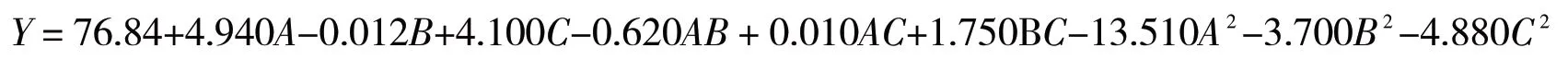
模型的方差分析结果见表3.
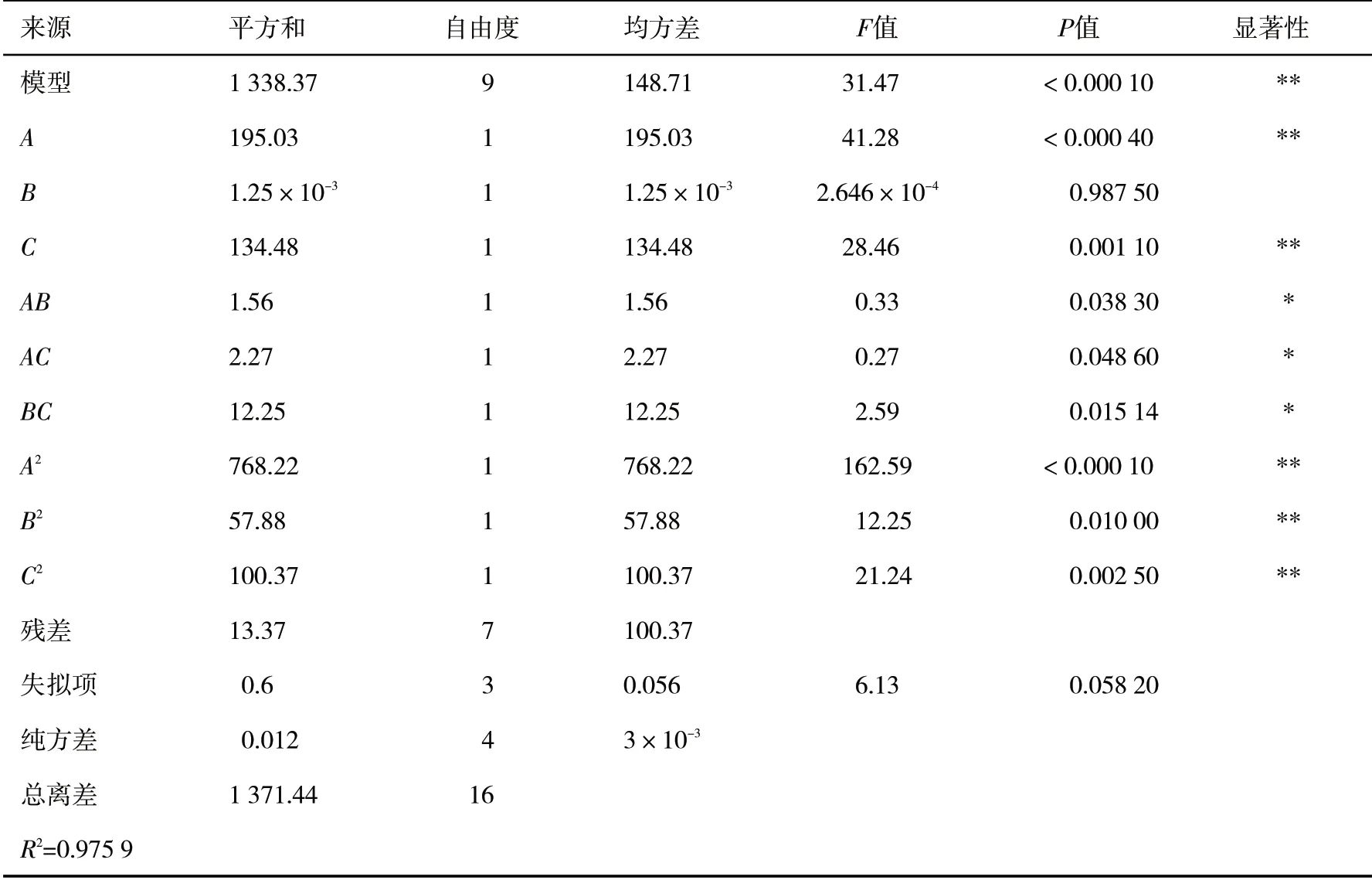
表3 模型分析Tab.3 Model analysis
由表3可知,通过方差分析,该二次多项式回归模型F值为31.47,P<0.000 1,表明该模型具有统计显著性,失拟项P>0.05,不显著,模型的相关系数R2=0.975 9,变异系数CV为1.27%<10%,表明该二次多项式回归模型可信度高,能较好地预测和分析多糖的提取率.提取温度、时间、压力、交互项(AB、AC、BC)及二次项(A2、B2、C2)的P值均小于0.05,说明3个影响因子对多糖的提取率影响显著,提取温度最大,影响最小的是提取时间.
2.2.3 因子交互作用分析 在提取多糖时,3个影响因子之间存在显著的交互作用,图6(a~c)为影响因子交互作用对多糖提取率影响的响应面和等高线图.
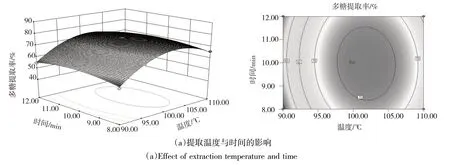
从图6(a~c)可以看到,3个因子两两之间交互作用的响应曲面坡度较陡峭,等高线呈椭圆形,说明3个因子交互作用强,对多糖提取影响大,这与方差分析结果相符.
2.2.4 工艺优化及结果 工艺优化为提取温度102℃、提取时间10 min、提取压力10 MPa,提取2次,在该优化条件下,重复进行3次试验,验证结果见表4.

表4 优化工艺条件下多糖的提取率Tab.4 Extraction rate of polysaccharides under optimized process conditions
由表4可知,3次重复性试验所得多糖提取率平均值为78.15%,标准偏差为0.03,相对标准偏差为0.038%,与模型预测值78.20%基本相符,优化工艺可靠.
2.3 多糖的抗氧化活性
2.3.1 对DPPH·的清除 试验结果见图7.
从图7可以看出,DPPH·清除率随着多糖浓度的增加而增大,浓度为0.2 mg·mL-1,DPPH·清除率达到79.10%,半抑制浓度IC50为0.088 54 mg·mL-1,清除力为VC的0.037倍,对DPPH·有较好的清除力.
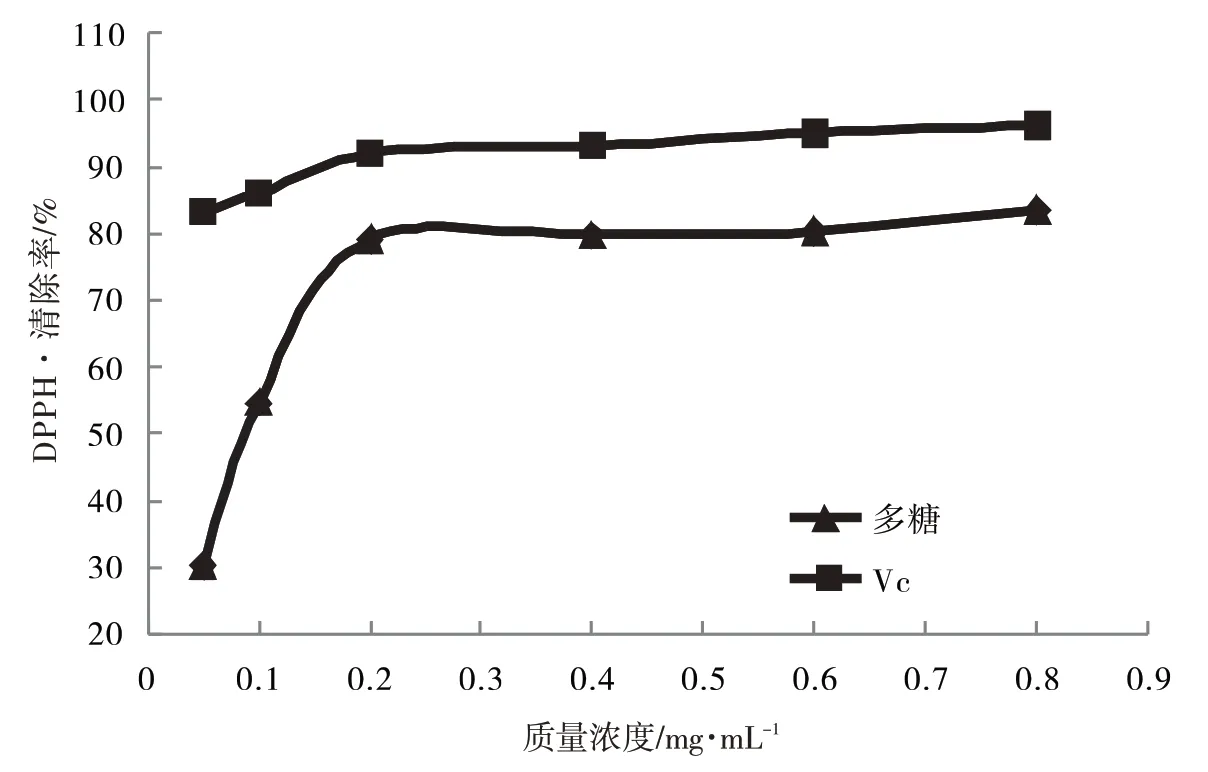
图7 唐古特果实多糖质量浓度对DPPH·的清除率影响Fig.7 Effect of polysaccharide quality concentration of Nitraria tangutorun Bobr.fruit on DPPH·clearance rate
2.3.2 对·OH的清除 试验结果见图8.
由图8知,多糖浓度的升高,对·OH的清除能力增强,其最大清除率为35.31%,VC为99.56%,多糖清除·OH的半抑制浓度IC50为2.549 2 mg·mL-1,VC的IC50为0.107 55 mg·mL-1,VC对·OH的清除力强于唐古特白刺果实多糖.
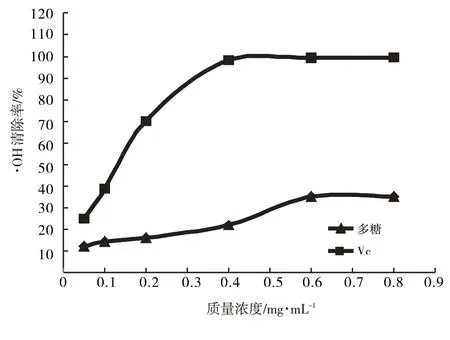
图8 唐古特白刺果实多糖质量浓度对·OH清除率的影响Fig.8 Effect of polysaccharide quality concentration of Nitraria tangutorum Bobr.on·OH clearance rate
2.3.3 还原力 试验结果见图9.
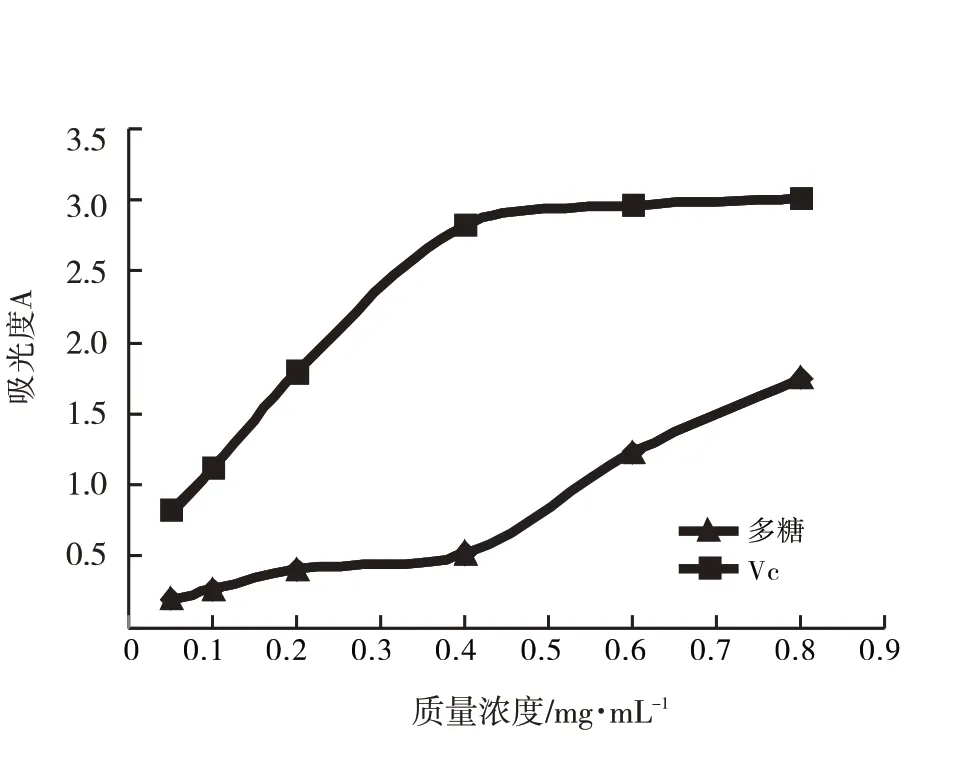
图9 多糖还原力Fig.9 Reducing power of polysaccharide
由图9知,多糖与Vc的还原力均随质量浓度的增大而提高,当Vc浓度为0.8 mg·mL-1时,吸光度达3.01,多糖的吸光度为1.75,二者相比,Vc还原力更强.
3 结论
采用快速溶剂萃取法和响应面法确定:温度102℃、时间10 min、压力10 MPa,循环提取2次,为提取唐古特白刺果实多糖优化工艺,此工艺下,多糖提取率可达(78.15±0.038)%,提取率高、快速、节省溶剂.提取的多糖对DPPH·和·OH半抑制浓度IC50分别为0.088 54 mg·mL-1、2.549 2 mg·mL-1,清除力强,有较好的还原力和抗氧化活性.

