土鳖虫不同部位水提液对MC3T3-E1、HUVEC细胞活力及对H2O2损伤保护的影响
王慧慧,位雪,谢雪晴,邓玉莹,王晶,王春梅(北京中医药大学生命科学学院,北京 100029)
土鳖虫又称土元、地鳖虫等,为鳖蠊科昆虫地鳖(Eupolyphaga sinensisWalker)或冀地鳖 [Steleophaga plancyi(Boleny)]的雌虫干燥体[1]。中药土鳖虫药性咸寒、归肝经,有小毒,有破血逐瘀、续筋接骨之功效,用于跌打损伤、筋伤骨折、症瘕痞块、血瘀经闭、产后瘀阻腹痛等[2]。其促进骨折愈合的功效明确而效果显著,临床应用较广。2015年版《中国药典》中含有土鳖虫的处方共 29 份,其中 14 份用于治疗跌打损伤,可见土鳖虫的促骨折愈合活性值得重视。
中药药效不仅受药材品种、产地、采收期、炮制等因素的影响,入药部位的选择也非常重要。体型较大的动物药多以部位入药(如鹿茸、鳖甲,水牛角等),如鹿茸还根据不同部位又进一步分为蜡片、粉片、血片、骨片,不同部位药材功效不同[3-5]。对于体型较小的昆虫类因采集的复杂性多以全体入药,但随着技术的进步,分部位入药已经不难实现。对于昆虫不同部位活性的差异也已有相关研究。如全蝎中,古人认为蝎子之毒乃至药力主要集中在尾,近代根据这一特点采用一次性剪尾提取,人工刺激、电刺激提取等提取工艺也逐渐成熟[6],获得了临床疗效的更好产品。因此,深入研究虫类药的用药部位对于精准用药及中药精制有重要价值。
研究证明土鳖虫在体内外均具有促进骨折愈合的作用,并发现体外细胞模型实验和大鼠体内促骨折愈合实验的结果具有很好的一致性[7-9]。但关于土鳖虫的活性物质主要集中于什么部位未见报道,限制了对其深入开发和应用。因此本研究以前期实验室建立的成骨细胞和血管内皮细胞模型对全体、背壳、腹壳、肉体的活性进行分析,为土鳖虫的深入开发应用提供参考依据。
1 材料
1.1 药材
鲜品土鳖虫购自安徽亳州药材市场,经北京中医药大学中药鉴定系杨瑶君教授鉴定为鳖蠊科昆虫地鳖Eupolyphaga sinensis雌虫。
1.2 细胞
小鼠胚胎成骨前体细胞(MC3T3-E1),由中国科学院过程工程研究所生化实验室张贵峰教授馈赠,培养于含10%胎牛血清的MEM 培养基中;人脐静脉内皮细胞(HUVEC)(存于北京中医药大学生物制药系)培养于含有 15%胎牛血清的 DMEM 培养基中。
1.3 仪器与试药
噻唑蓝(MTT)、二甲基亚砜(DMSO)(美国 Sigma 公司);HyClone 胎牛血清、DMEM 和MEM 培养基(赛默飞世尔生物化学制品有限公司);胰酶(美国Amresco 公司);过氧化氢溶液(广东恒健制药有限公司);冷冻干燥机(北京博医康实验仪器有限公司);Bio TEK Epoch 全波长酶标仪(美国Biotek 公司);TE2000-U 倒置显微镜(Nikon 公司);无水乙醇、氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾(北京化工厂)。
2 方法
2.1 土鳖虫各部位水提物的制备
将活体土鳖虫于-80℃冰箱处死即得鲜土鳖虫,取一部分用作全土鳖虫,其余用水洗净,弃掉头足,分成背壳、腹壳、肉体三部分。分别取背壳、腹壳、肉体及全土鳖虫适量,剪碎并研磨,按料液比1∶20(W/V,g/mL,下同)加入蒸馏水,浸泡1 h,煎煮40 min,过滤收集第一次滤液,滤渣1∶15 加入蒸馏水继续煎煮 40 min,过滤收集第二次滤液,合并两次滤液,4℃、8000 r·min-1离心20 min,上清液过0.45 μm 的滤膜后用真空冷冻干燥机冻干,分别称重。并根据公式计算产物得率(%)=土鳖虫各部位冻干粉干重/土鳖虫各部位用量×100%。
2.2 土鳖虫各部位对MC3T3-E1、HUVEC 细胞增殖的影响
按照文献方法[10],取对数生长期的细胞(单位体积细胞个数为2×104个·mL-1,每孔100 μL)接种到96 孔板中,孵育24 h 后,将实验设置为正常对照组(control),土鳖虫背壳、腹壳、肉体和全体不同浓度加药组,对应加入150 μL培养基和各浓度稀释样品,每组重复6 次。置于37 ℃、5%CO2培养箱孵育24 h。用倒置显微镜观察并拍照监测形态变化。每孔加入100 μL 含0.5 mg·mL-1MTT 的PBS 再孵育4 h,除去上清液,加入150 μL DMSO 并摇动10 min。使用酶标仪测量570 nm 处吸光度。细胞增殖率(%)=(加药组A570-对照组A570)/ 对照组A570×100%。以上实验重复3 次。
2.3 土鳖虫各部位对H2O2 损伤MC3T3-E1、HUVEC 细胞的保护作用[7]
采用先损伤再保护的方法。将对数生长期的细胞(单位体积细胞个数为4×104个·mL-1,每孔100 μL)接种到96 孔板中,孵育24 h 后分组。正常对照组:完全培养基培养(MEM 或DMEM培养基);损伤模型组:含300 μmol·L-1H2O2的基础培养基处理细胞(MC3T3-E1 损伤8 h、HUVEC 损伤7 h);土鳖虫背壳、腹壳、肉体及全体水提液加药组:先构建损伤模型,然后加入不同浓度的药液进行干预,每组重复6 次。置于37℃、5%CO2培养箱孵育24 h,MTT 法检测细胞活力。
2.4 统计学分析
采用Graphpad Prism 进行数据处理,结果以均数±标准差(±s)表示,组间比较采用单因素方差分析(One-way ANOVA),P<0.05 为差异具有统计学意义。
3 结果
3.1 土鳖虫不同部位占比及水提物得率
土鳖虫背壳、腹壳、肉体各部位在全体中所占的比重及各部位水提物得率见表1,背壳、腹壳、肉体的物质得率差异不大,全体土鳖虫可能因为头和腿的可溶性物质溶出少,得率略低。
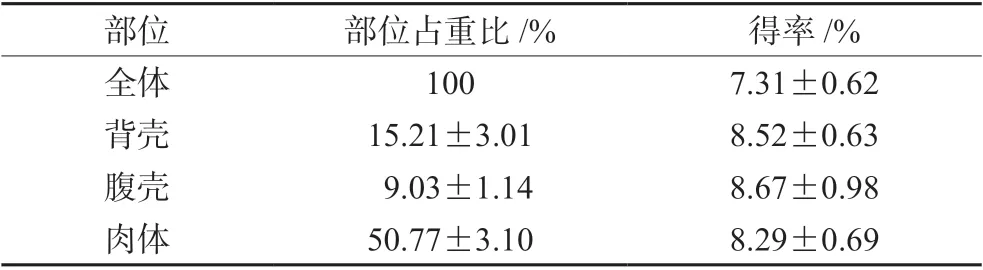
表1 土鳖虫不同部位占比及物质得率Tab 1 Proportion and material yield of different parts of ESWE
3.2 土鳖虫各部位对MC3T3-E1、HUVEC 细胞活力的影响
3.2.1 土鳖虫各部位对MC3T3-E1 细胞活力的影响 土鳖虫各部位不同浓度水提物均能增强 MC3T3-E1 细胞的活力(见图1),细胞活力随剂量的提高而增强(P<0.01)。其中,对MC3T3-E1 细胞的作用土鳖虫全体、背壳、腹壳各质量浓度组均高于土鳖虫肉体组。高浓度(1.5、2 mg·mL-1)时土鳖虫全体组的细胞活力最高,当质量浓度≤1 mg·mL-1时各部位增强细胞活力的效果为:背壳>全体>腹壳>肉体。

图1 土鳖虫各部位水提物对 MC3T3-E1 及HUVEC 细胞活力的影响(±s,n=6)Fig 1 Effect of different parts of ESWE on the viability of MC3T3-E1 and HUVEC cells(±s,n=6)
3.2.2 土鳖虫各部位对HUVEC 细胞活力的影响 土鳖虫各部位不同浓度水提物均能增强HUVEC 的细胞活力(见图2),细胞活力随剂量的提高而增强(P<0.05)。其中,对HUVEC 细胞的作用土鳖虫全体、背壳、腹壳组高于土鳖虫肉体组(P<0.05)。高浓度(1、2 mg·mL-1)时土鳖虫全体组的增强细胞活力的效果最好,背壳的效果次之,但两组之间差异无统计学意义;低浓度时的促增殖效果为:背壳>全体>腹壳>肉体,同MC3T3-E1 细胞的结果一致。
3.3 土鳖虫各部位对H2O2 损伤MC3T3-E1、HUVEC 细胞的保护作用
3.3.1 土鳖虫各部位对H2O2损伤MC3T3-E1 细胞的保护作用 设正常对照组细胞活力为100%,经H2O2损伤后MC3T3-E1 细胞的活力降为26.51%,表示造模成功。造模成功后加药保护,当土鳖虫各部位水提物质量浓度为 0.05 mg·mL-1时,细胞活力有所升高,但差异无统计学意义(P>0.05)。随着用药质量浓度的升高,对细胞的保护作用也越来越明显;当土鳖虫全体、背壳、腹壳、肉体的用药质量浓度为2 mg·mL-1时,MC3T3-E1 细胞的活力分别恢复至201.61%、204.36%、201.43%、192.92%(P均<0.01)。同一质量浓度比较时,肉体组的损伤保护作用较其他样品处理组弱(见图2)。
3.3.2 土鳖虫各部位对H2O2损伤HUVEC 细胞的保护作用 设正常对照组细胞活力为100%,经H2O2损伤后HUVEC 细胞的活力降为正常对照组的25.03%,表示造模成功。造模成功后加药保护,当土鳖虫各部位水提物用药质量浓度为 0.05 mg·mL-1时,细胞活力有所升高,但差异无统计学意义(P>0.05)。随着用药质量浓度的升高,对细胞的保护作用也越来越明显,当质量浓度大于0.5 mg·mL-1时,背壳的保护作用最好,肉体的保护作用最弱(见图2)。

图2 用药24 h 后土鳖虫各部位水提物对H2O2 损伤的MC3T3-E1及HUVEC 细胞的保护作用(±s,n=6)Fig 2 Effect of different parts of ESWE treated for 24 h on H2O2 damage protection of MC3T3-E1 and HUVEC cells
4 讨论
土鳖虫在临床上具有确切的促进骨折愈合的作用[11-12],现代研究发现,土鳖虫体外可以诱导大鼠骨髓间充质干细胞的成骨分化,体内可以促进兔下颌骨牵张成骨过程中的骨形成,其作用机制均可能是促进血管内皮生长因子的表达有关[13-14]。本文选择常用的成骨细胞MC3T3-E1 和人脐静脉内皮细胞HUVEC 对土鳖虫不同部位活性进行研究,以期找到有效成分密集的部位。结果发现土鳖虫全体、背壳、腹壳、肉体对体外培养的MC3T3-E1、HUVEC 细胞均有促进细胞增殖活力作用,背壳的效果最好。
氧化应激能够抑制成骨细胞前体细胞系向成骨细胞的分化,诱导其死亡[15-16]。本文用H2O2氧化损伤细胞模拟骨折过程中损伤的细胞,构建了MC3T3-E1、HUVEC 细胞H2O2氧化应激损伤模型来研究土鳖虫不同部位对细胞氧化损伤的修复作用,发现土鳖虫各部位均能使损伤的MC3T3-E1 细胞的增殖活力明显升高;背壳组对氧化损伤的HUVEC 细胞的保护作用最好。
以上实验结果说明土鳖虫中增强细胞活力和保护细胞氧化损伤的活性物质可能更多的集中于甲壳部分,这为土鳖虫的深加工以及活性成分的深入研究提供参考。

