一株秸秆纤维素降解菌株的筛选及其降解特性
吴 洁,杨 梅
(吉林化工学院 生物与食品工程学院,吉林 吉林 132022)
吉林省的玉米秸秆纤维素资源非常可观,然而很大一部分的秸秆没有得到合理化的利用,反而被大量的弃置、焚烧.进而引发很严重的高消耗、高污染、低产出的状况.如今,怎样实现可再生植物纤维资源的高效利用与转化,对于我国的能源、环境以及循环经济的实现是一个重大的机遇和转折点[1].因此将纤维素水解成葡萄糖等物质,继而应用到食品制造、饲料加工、酒精发酵等众多领域,使纤维素可以得到重复利用,对缓解人类能源紧缺以及环境污染等问题具有重要意义.
秸秆中的主要成分是纤维素、半纤维素和木质素,目前较为常见的纤维素降解方法为物理、化学、生物降解这3个方面.微生物降解处理纤维素是一种相对更为安全、无公害的方法,也是目前国内外的研究热点[2].利用微生物生产纤维素酶普遍存在活力低、成本高等问题,制约着纤维素资源利用的进一步发展.因此,开发纤维素酶高产菌种并加强菌株选育等基础研究,是纤维素资源高效利用的关键所在.本文从多年种植玉米地土壤中分离出1株高效纤维素降解菌,该菌命名为J-N3,并初步考察其酶学性质以及秸秆的降解效果.
1 实验部分
1.1 试剂与仪器
1.1.1 样品来源
土壤样品采集:吉林市郊区多年种植玉米田地,去除表层土5 cm,取距地表5~10 cm的土壤样品,置于无菌袋中.将样品带回实验室,后过40目筛,置于4 ℃冰箱保存.
1.1.2 培养基
PDA液体(固体)培养基:马铃薯200 g、葡萄糖 20 g,琼脂20 g,自来水1 000 mL,自然pH.
富集培养基:羧甲基纤维素钠(CMC-Na)5.0 g、秸秆粉 5.0 g、K2HPO41.0 g、MgSO40.5 g、(NH4)2SO42.0 g、NaCl 0.5 g、牛肉膏0.5 g、胰蛋白胨1.0 g、蒸馏水1 000 mL,pH自然.
羧甲基纤维素钠培养基:分别称取羧甲基纤维素钠15 g、NaCl 0.5 g、蛋白胨2 g、MgSO40.5 g、K2HPO41 g、酵母膏0.5 g、蒸馏水1 000 mL,pH 7.0.
赫奇逊(Hutchison)无机盐培养基(g·L-1) :KH2PO41.0 g、NaCl 0.1 g、MgSO4·7H2O 0.3 g、NaNO32.5、FeCl30.01、CaCl20.01、琼脂粉18 g,pH 7.2左右.
发酵培养基:KH2PO41.0 g、NaCl 0.1 g、MgSO4·7H2O 0.3 g、NaNO32.5 g、FeCl30.01 g、CaCl20.1 g、玉米秸秆粉20 g,pH 7.0.
1.1.3 主要仪器
灭菌锅灭菌锅(YXQ-LS上海博迅实业有限公司医疗设备厂);干燥箱(DHG-9240A上海一恒科技有限公司);无菌操作台(JHL-1500北京莱博特瑞科技有限公司);紫外可见分光光度计(UV2600贵州赛兰博科学仪器有限责任公司);恒温振荡器(HZQ-X300上海一恒科学仪器有限公司);生化培养箱LRH-70/70F上海一恒科学仪器有限公司).
1.2 方法
1.2.1 菌种的分离筛选
称取1 g土样置于含有100 mL富集培养基的三角瓶中,并放入玻璃珠充分打散混匀,在30 ℃、150 r/min条件下在恒温振荡培养箱中培养3 d,将纯化后的菌株,用接种环挑取单菌落,于羧甲基纤维素(CMC)固体培养基平板上点种3个点,放入恒温培养箱中30 ℃倒置培养3 d[3].等待菌落长出,此时用1 mg·mL-1刚果红染液对其进行染色30 min,之后弃掉所用刚果红染液,其次吸取1 mol·L-1NaCl溶液进行脱色30 min.稍后呈现出明显的透明圈,测其透明圈直径(D)与菌落直径(d)大小,选取D/d值较大(D/d值越大,产酶能力越强)的进行复筛.
1.2.2 滤纸降解实验
将上述实验所得菌株,置于液体培养基中以30 ℃,150 r/min于恒温震荡培养箱中培养制备菌液[4].在100 mL赫奇逊无机盐培养基中加入1 cm×6 cm的滤纸条,接入5 mL菌液之后进行恒温震荡,为避免震荡导致滤纸断裂,同时满足该菌株生长所需的有氧条件,本实验采用的摇床转速为80 r/min,培养20 d,观察滤纸条的断裂情况判断降解效果[5-6].
1.2.3 纤维素酶活测定
粗酶液的制备:将初筛得到的单菌株制成菌悬液,以5%的接种量接种到液体产酶培养基中,35 ℃,150 r/min摇床中培养.在8 000 r/min条件下,将培养液离心10 min,取其上清液作为粗酶液.
CMCase活力的测定[7]:取0.5 mL 稀释的酶液和1.5 mL的1%CMC-Na溶液,放入50 ℃恒温水浴中反应30 min,加入3.0 mL的DNS 试剂,沸水浴10 min,冷却后定容至25.0 mL.在540 nm处测OD值,并根据葡萄糖标准曲线,求出酶解所得葡萄糖含量,换算成酶活力值.
滤纸酶活力的测定[8]:取新华滤纸50 mg放入试管中,加入 0.5 mL粗酶液和1.5 mL柠檬酸缓冲液,在 50 ℃恒温水浴中反应30 min,加入3.0 mL DNS溶液,沸水浴10 min,冷却后定容至25.0 mL.在540 nm处测OD值,根据葡萄糖标准曲线求出酶活力值.
1.2.4 秸秆降解率测定
接种筛选菌株到液体发酵培养基中制备菌液,按接种量5%制备好的菌液到含有秸秆的液体发酵培养基中,进行恒温震荡培养[9].秸秆降解过程中,于5、10、15、20 d 取各组秸秆并用自来水清洗干净后,置于 85 ℃烘箱中烘干至恒重,用减重法测定秸秆失重率,同时,每组分别取秸秆粉(将秸秆粉碎后过40目筛)1 g,按照Van Soest 法[10]测定秸秆降解过程中纤维素分解率.
1.2.5 菌株鉴定
观察菌落及菌体形态特征,参照《真菌鉴定手册》[11]和《中国真菌志》[12]对菌株进行形态学鉴定.
分子生物学鉴定提取细菌基因组总DNA,扩增16S rDNA和5.8S rDNA之间的保守序列,PCR引物为27F:(AGAGTTTGATCMTGGCTCAG),1492R:(TACGGYTACCTTGTTACGACTT).PCR反应体系为 25 μL,反应条件为94 ℃ 4 min,94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min;循环30次;72 ℃ 10 min.扩增产物测序,进行比较分析.
2 结果与讨论
2.1 菌株的分离筛选
将有分解纤维素能力的菌株和筛选到菌株点接于鉴别培养基培养,经0.1%刚果红染色和1 mol·L-1NaCl 溶液脱色后,有4个菌株形成的透明降解圈较大.随后,对这4个菌株进行滤纸降解实验,其结果如表1所示.最后对其进行液体发酵培养并测定其发酵上清液酶活,见表2.其中,菌株J-N3发酵上清液的羧甲基纤维素酶酶活为64.92±0.11 U·mL-1,FPA为39.75±0.10 U·mL-1,其中第3种酶活力较其他3个菌株高,故以此菌株为研究对象开展后续试验.
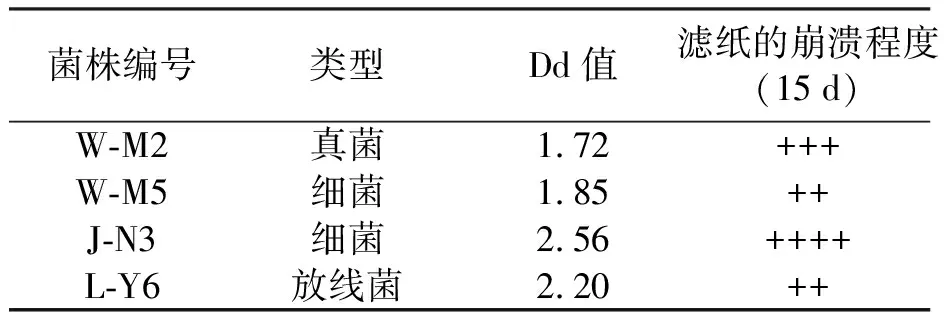
表1 刚果红染色实验结果
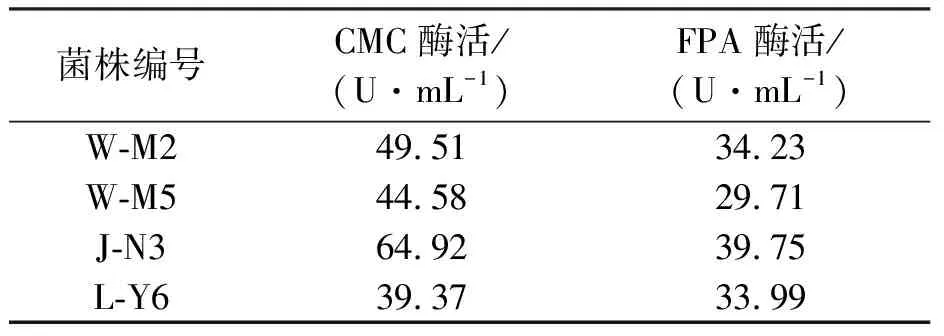
表2 各菌株发酵上清液纤维素酶酶活
2.2 菌株的鉴定
菌落较大,颜色呈现灰白且略带些黄色,其表面粗糙且无规则,并伴有隆起、皱褶等,如图1所示.

图1 菌株J-N3菌落形态特征
仅通过对菌落的形态观察尚不能确定菌株的具体种属,还需通过分子生物学方法进行进一步 鉴定.提取菌株J-N3的基因组DNA进行PCR扩增并测序,测得其ITS序列长度为531bp,于NCBI 数据库进行 BLAST 比对后发现,ITS 序列与J-N3相似性最高的菌株属于芽孢杆菌,如表3所示.

表3 纤维素降解菌株的相似菌种及相似度


2.3 菌株J-N3所产纤维素酶的测定结果
2.3.1 培养时间对酶活力的影响
取活化后的菌种,按5%接种量于250 mL液体产酶培养基,35 ℃、150 rmp震荡培养7 d,每培养24 h取样1次,连续测定纤维素酶活力,如图2研究培养时间对菌株发酵液酶活力的影响.
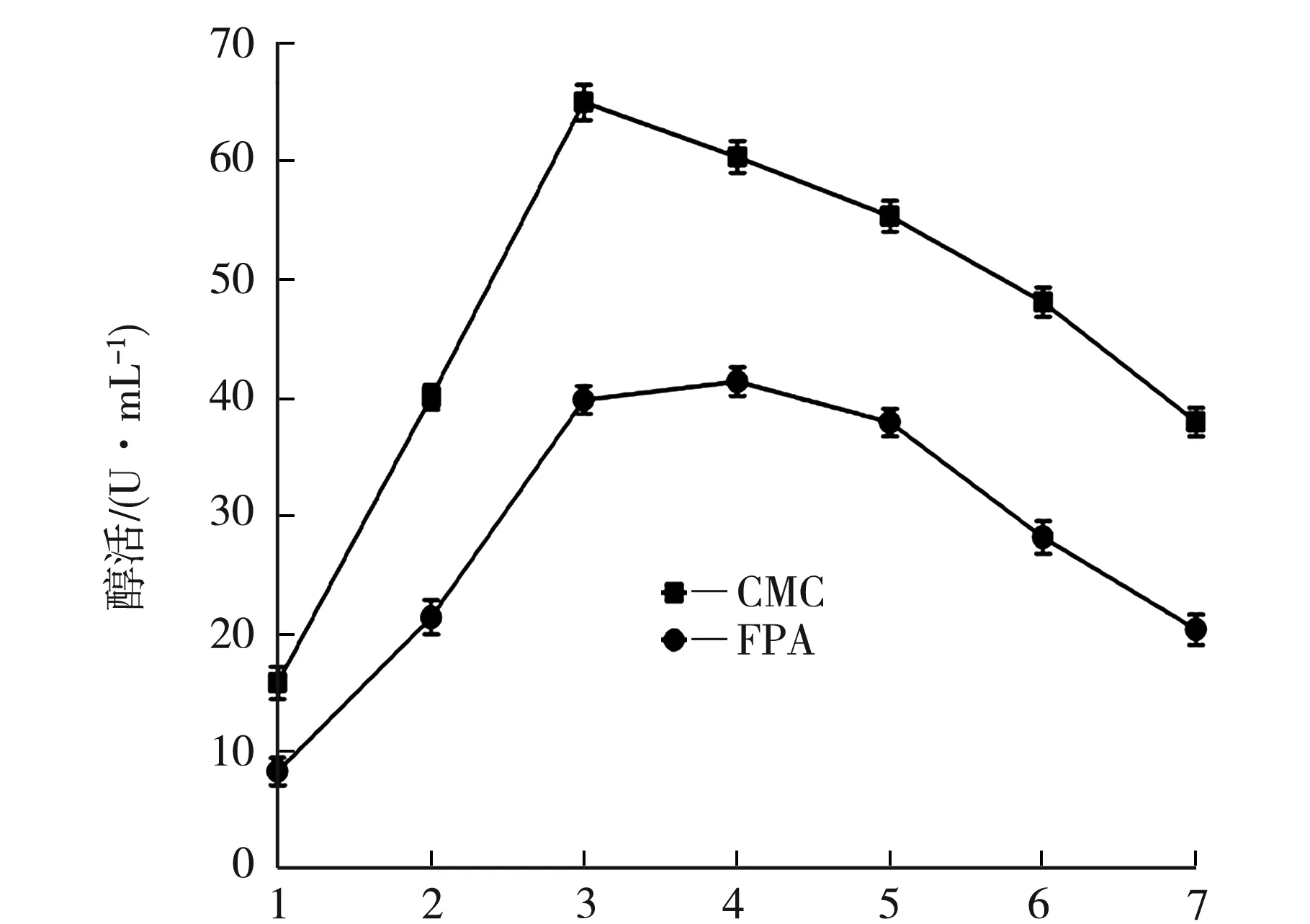
t/d图2 时间对酶活的影响
2.3.2 酶的最适反应pH
在50 ℃条件下,分别在pH为4.0、5.0、6.0、7.0、8.0、9.0的Na2HPO4-柠檬酸缓冲溶液体系中,测定该纤维素酶活力.由图3可知,该纤维素酶的最适反应pH为6.0.在pH 4.0~6.0之间,纤维素酶活力逐渐升高;在pH 6.0~8.0之间,纤维素酶活力有小幅降低.

pH图3 pH对酶活的影响
2.3.3 酶的最适反应温度
在pH 6.0体系中,分别在30、40、50、60、70、80 ℃下,测定该纤维素酶活力.由图4可知,该酶的最适反应温度为50 ℃;其对温度的适应性较强,在 30~50 ℃之间,酶活力都维持在较高增长水平;当温度高于 50 ℃ 时,纤维素酶活力迅速下降.
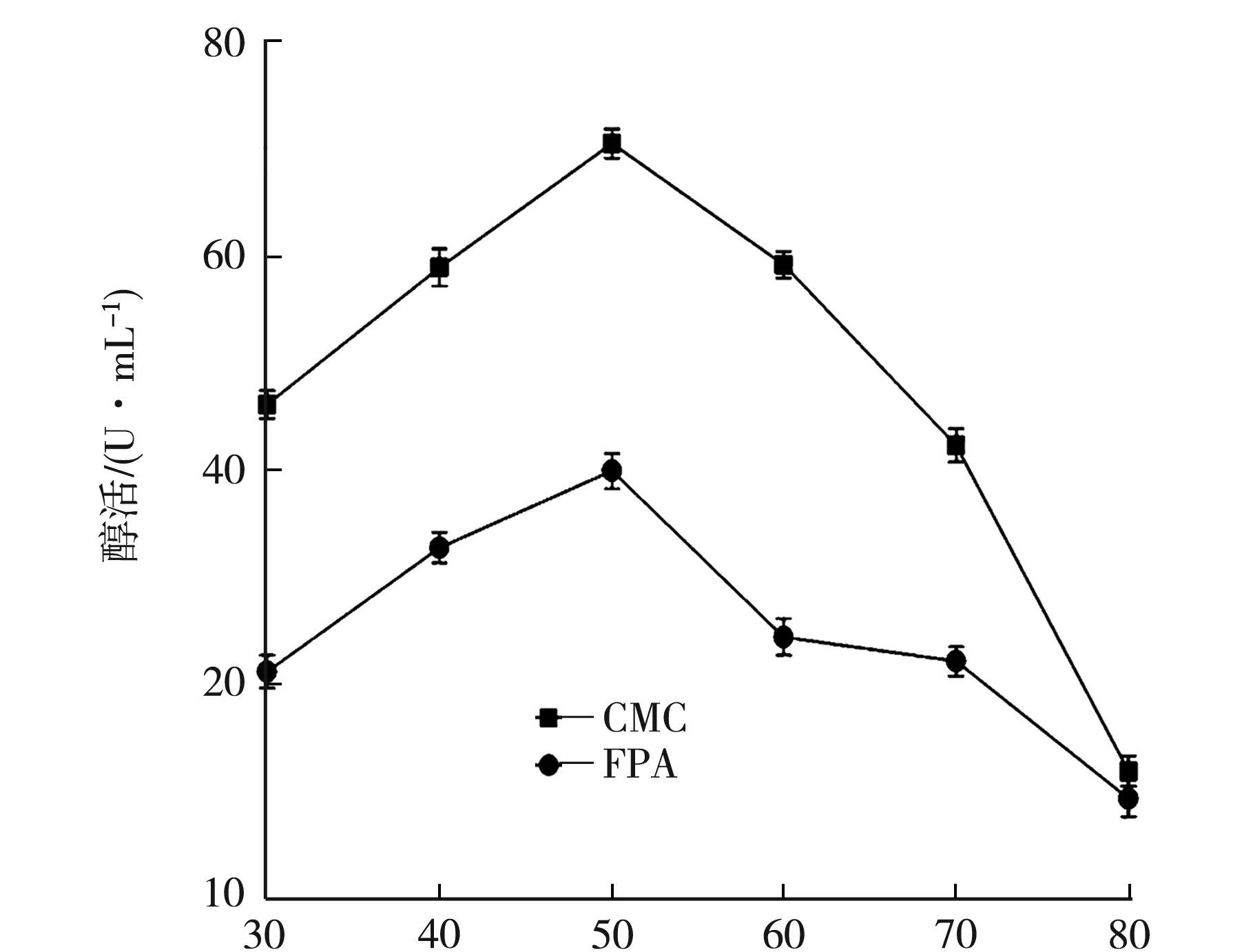
T/℃图4 温度对酶活的影响
2.4 菌株J-N3对玉米秸秆的降解效果
对同一取样时间段的数据进行分析,20 d 时,菌株J-N3处理组秸秆失重率为26.22%,每组取秸秆粉1 g,用于测定秸秆中的纤维素含量,并计算纤维素分解率,此时菌株处理组纤维素分解率达到31.01%.综合玉米秸秆失重率和纤维素分解率的测定结果,表明菌株对玉米秸秆具有良好的降解功能.
3 结 论
近年来对纤维素降解菌的研究越来越关注,农作物秸秆是自然界中最丰富的可再生资源,如何有效利用秸秆纤维素是普遍关注的研究热点.本研究筛选获得 1 株高产纤维素酶的菌株J-N3.结合形态学特征与分子生物学鉴定结果可知,菌株 J-N3为芽孢杆菌属.并对其所产纤维素酶的酶学性质进行了初步研究,该酶在发酵第3 d时CMC酶活最高,最适反应pH为 6.0,最适反应温度为50 ℃,并且菌株对玉米秸秆具有良好的降解功能.玉米秸秆经菌株 J-N3处理20d 时,秸秆失重率及纤维素分解率分别达到26.22%和31.01%.

