工业硫酸锰中碱金属元素脱除试验研究
赵 强
(1. 中冶长天国际工程有限责任公司,湖南 长沙 410205; 2. 烟气多污染物协同治理及资源化湖南省重点实验室,湖南 长沙 410205)
硫酸锰作为一种基础化工原料,在钢铁工业、有色冶金、电池、农业、建筑等领域有着广泛应用[1-3]。我国的硫酸锰主要以菱锰矿和软锰矿为原料,通过浸出、直接湿法还原浸出或火法还原后浸出得到硫酸锰溶液,经除杂质、浓缩结晶、离心脱水得到不同等级的硫酸锰产品[4]。锰资源在地理分布上极不平衡,80%以上分布在南非、乌克兰等国,其中南非锰矿储量最多,占世界总储量的42.8%[5-6]。中国有丰富的锰矿资源,储量近7亿t,占世界锰矿资源总量的6.98%,但矿石品位普遍不高(<22%),绝大多数为菱锰矿,伴生组分复杂,由此生产出来的硫酸锰及其衍生品中钠、钾、钙、镁及其他杂质含量偏高[7-8]。作为锰系动力电池正极材料最基础、最重要原料的高纯硫酸锰对杂质含量要求十分苛刻[9], 硫酸锰中的钠、钾、钙、镁对锂电池的高温形貌和循环性能有重要影响,尤其是K+、Na+的离子半径和性质与Li+比较接近,容易堵塞Li+迁移通道,放电过程难以进行,直接影响锂电池容量及循环性能[10]。
K+、Na+的去除方法有沉淀法、萃取法等[11]。沉淀法原理为在一定条件下溶液中Fe3+能与K+、Na+生成黄钠(钾)铁矾沉淀,从而除去K+、Na+。萃取法是利用萃取剂难以与K+、Na+形成稳定配合物而使K+、Na+留在萃余液中。采用Fe2(SO4)3做净化剂就工业硫酸锰中的碱金属杂质开展脱除试验研究,以期获得符合电池级高纯硫酸锰技术指标要求的产品。
1 试验方法
1.1 试验原料及方法
试验主要原料有:硫酸铁,分析纯,含量(以铁计)21.0%~23.0%;碳酸锰,分析纯,含量44.0%~48%;硫酸锰溶液,以固体工业硫酸锰配制而成。
以工业硫酸锰固体配制的硫酸锰溶液为原料,向溶液中加入Fe2(SO4)3,搅拌均匀,用MnCO3调节pH在1.0~1.5范围内,试验过程中控制温度在95~98 ℃之间。试验结束后停止搅拌,静置,真空过滤,滤液用电感耦合等离子体发射光谱仪(ICP-AES)对溶液进行分析。
1.2 试验原理
碱金属钾、钠能生成沉淀的物质相当少,六羟基锑酸钠Na[Sb(OH)6]、醋酸双氧铀酰锌钠NaAc·Zn(Ac)2·UO2(Ac)2·9H2O、钴亚硝酸钠钾K2Na[Co(NO2)6]、四苯硼酸钾K[B(C6H5)4]、黄钾铁矾KFe3[SO4(OH)3]2、黄钠铁矾NaFe3[SO4(OH)3]2等为少数钾、钠的化合物沉淀。前面4种沉淀在硫酸锰溶液体系的条件下无法生成,且试剂相当昂贵。钾、钠铁矾在一定条件下可以在硫酸锰溶液中形成,在硫酸锰溶液体系中加入硫酸铁,控制一定的pH和温度,钾、钠就可以以铁矾沉淀的形式除去。反应如下:
K2SO4+3Fe2(SO4)3+12H2O→
2KFe3[SO4(OH)3]2↓+6H2SO4
Na2SO4+3Fe2(SO4)3+12H2O→
2NaFe3[SO4(OH)3]2↓+6H2SO4
由于钾与铁形成矾的动力比钠要大,K+在硫酸锰溶液净化早期基本能全部除去,Na+净化耗时较长,因此主要对溶液中Na+含量进行检测。
2 结果与讨论
2.1 铁加入量的影响
铁加入量对Na+的去除效果进行不同的试验,三价铁加入量为理论量的1.1倍和2.0倍,Fe2(SO4)3加入量按(K+Na)∶Fe=1∶6(摩尔比)计算,1次全部加入,反应温度为95 ℃,试验结果见表1。

表1 不同铁加入量沉矾后溶液钠含量
通过表1可以看出:铁加入量由1.1倍增加至2.0倍时,反应终了溶液中的钠含量越低。试验过程中由于温度较高,溶液蒸发较大,体积有所波动,钠含量检测结果也有波动,但最终检测结果是比较准确的,能够反映实际情况。
2.2 铁加入方式的影响
控制Fe2(SO4)3加入量为理论量的2.0倍,将铁加入方式分为1次全部加入,加入时间为第0 h;分2次平均加入,加入时间为第0 h和第1 h;分3次平均加入,加入时间为第0,1,2 h,反应温度95 ℃。考察不同加入方式对最终结果的影响,试验结果见表2。

表2 不同铁加入方式沉矾后溶液钠含量
由表2可见:铁加入方式对除钠过程还是有一定影响,特别是溶液最终的钠含量,在铁分3次加入时最低。1次、2次和3次加铁除钠,溶液最终钠含量分别是165,162,100 mg/L。因此在后续的试验中,铁都采用3次加入。
2.3 温度的影响
铁加入量为理论量的2倍,分3次加入,考察温度对钠离子净化的影响,结果如表3所示。
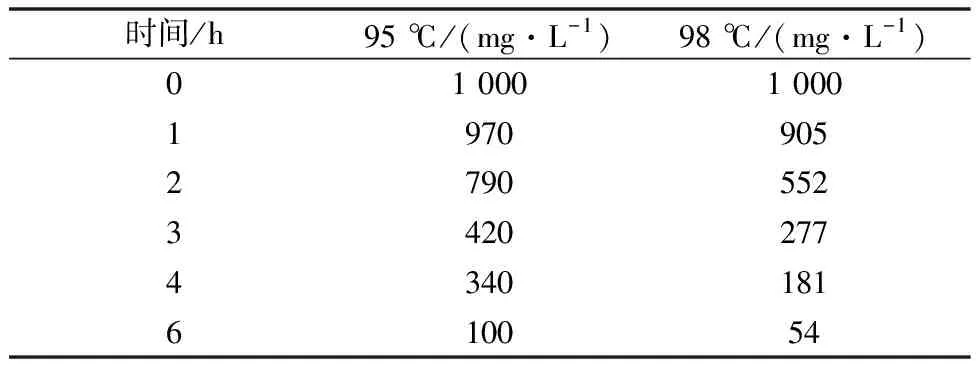
表3 不同温度沉矾后溶液钠含量
从表3可以看出:温度对反应速度和反应深度都有明显影响,6 h反应后,在95 ℃和98 ℃条件下,溶液中的钠分别降至100,54 mg/L,故温度98 ℃适宜。
2.4 晶种的影响
钾与铁形成矾的动力比钠要大,在溶液里加入适量的钾,其他条件不变,发现铁矾的生成很快,钠也有被去除,不管加多少钾(未超过1 000 mg/L),反应第1 h,钾就能降到3 mg/L甚至以下。这是钾和铁快速生成的矾起到了晶种的作用,减少了钠矾的形核阻力。后来又做了几个不同钾加入量的试验,结果类似。虽然钾可以起到晶种的作用,但需另外加入钾,同时还要加入试剂铁。因此考虑用已经生成的矾来做晶种加入到硫酸锰溶液中,考察能否达到和加钾时类似的效果。
试验1:加铁量为理论量的2倍,分3次加入,加入时间分别是第0,1,2 h,反应温度先控制在95 ℃,按理论生成铁矾的质量加入不同百分比的晶种。结果如表4所示。
由表4可知:晶种的加入量对钠矾的形成有显著影响,随着晶种加入量的减少,钠铁矾生成的反应速度越慢,溶液终点的钠含量也越高。但所有加晶种的反应沉矾深度都不如加钾1 000 mg/L效果好。表4终点溶液钠含量分别为100,182,258,345,402,641,700 mg/L。即使晶种的加量为预期生成矾的1倍时,终点溶液中钠含量仍然有182 mg/L,未达到试验预期,故又安排了试验2。

表4 95 ℃下不同晶种量沉矾后溶液钠含量
试验2:其他条件与试验1一致,将反应调整到98 ℃,试验结果见表5。
由表5可知:98 ℃下不同晶种不同时间段溶液钠含量均不及95 ℃效果好,晶种由多到少的终点溶液钠含量分别为241,247,505,625,736,755 mg/L。由此可知升温对晶种净化硫酸锰溶液效果较差。但温度升高对加钾沉钠矾有积极效果。
试验3:试验1结果证实在硫酸锰溶液中加入理论沉矾量的3%、6%、12%、25%、50%、100%能够起到深度净化效果,同时除碱金属工序若为连续作业,那么其中的晶种量是有可能超过理论成矾量的1倍的,因此试验3进行了晶种加入量大于理论成矾量1倍的试验,设置晶种加量为理论成矾量的2倍、3倍和4倍条件,其他试验条件不变,结果如表6所示。

表6 不同晶种量沉矾后溶液钠含量
由表6可知:在95 ℃和98 ℃下硫酸锰溶液终点钠离子含量与晶种倍数并无正向相关性,晶种倍数越大终点钠离子含量反而还越大,可见晶种并不是越多越好。外加晶种的效果不如加钾生成的新钾矾晶种除钠效果好。
3 结 论
1)以硫酸铁做净化剂脱除工业硫酸锰溶液中碱金属离子效果显著,在硫酸铁加入量为理论量的2.0倍,分3次在第0,1,2 h加入,反应温度控制在98 ℃时,工业硫酸锰溶液中的钠离子含量可以降到100 mg/L以下。
2)与加钾新生成的钾矾沉钠效果相比,外加不同数量晶种不能起到同等的除钠作用,并且升高温度与提高加入晶种倍数不能起到深度净化效果。

