利用CRISPR/Cas9系统构建猪PLIN1基因敲除载体及其效率检测
彭玥晗 , 徐 磊 , 许金蔓 , 王 昊 , 胡悦旻 , 鞠辉明,2
(1.扬州大学兽医学院 , 江苏 扬州 225009 ; 2. 江苏省动物重要疫病与人兽共患病防控协同创新中心 , 江苏 扬州 225009)
我国拥有丰富的地方猪种资源,近年来,在猪的肉质性状、生长性状、繁殖性状等方面与全基因组选择和全基因组关联分析方面取得了很多研究成果[1]。猪肉的生产效率及猪肉品质一直都是猪种选育的重点,在遗传上解析不同类型猪的肌肉生长发育差异,对猪种遗传差异的深入研究具有重要的指导意义[2]。围脂滴蛋白(Perilipin,PLIN)是最早由 Greenberg 等于小鼠的附睾脂肪细胞中发现的结构蛋白家族[3],其中PLIN1定位于脂肪细胞脂滴表面,调节脂肪甘油三酯的储存和水解[4]。越来越多研究表明,PLIN1基因对肌肉生长发育、能量代谢及线粒体功能有调控作用。CRISPR/Cas9可以编辑多种基因功能,是目前实现基因突变效率最高的系统,该系统包括系统元件 sgRNA 和 Cas9 蛋白,利用该系统可以实现基因敲入、基因敲除、基因沉默以及各种目的基因的编辑[5-6]。本课题组前期在研究巴马猪、大白猪肌肉发育差异的过程中,利用同位素标记相对和绝对定量(Isobaric tags for relative and absolute quantification,iTRAQ)技术比较出PLIN1蛋白在巴马猪、大白猪肌肉组织蛋白中表达量差异显著。本试验拟利用CRISPR/Cas9系统构建猪PLIN1敲除载体,转染猪PK15细胞,富集crispr-sgRNA靶向切割引起的PLIN1基因突变或者外源碱基序列插入的细胞群,为后续研究该基因功能提供基础数据。
1 材料与方法
1.1 材料与试剂 猪肾上皮细胞系(PK15 细胞系)、基因敲除载体pYSY-CMV-Cas9-U6-sgRNA-EF1a-Puromycin为本实验室保存。去内毒素质粒提取试剂盒,购自OmegaBio-Tek公司(美国);转染试剂Lipofectamine 3000 Transfection Kit、胎牛血清及细胞培养试剂,均购自Thermo Fisher Scientific公司(美国);PLIN1抗体(NB100-60554),购自Novus Biologicals公司(美国);GAPDH抗体,购自Santa Cruz Biotechnology公司(美国)。其他分子生物学试剂,均购自宝生物工程(大连)有限公司。序列合成及测序由生工生物工程(上海)股份有限公司合成。
1.2 基因与载体
1.2.1 载体选择 CRISPR 基因敲除质粒 pYSY-CMV-Cas9-U6-PLIN1-sgRNA-EF1a-Puromycin(简称PLIN1-KO质粒,图1)作为载体,在gRNA scafflod 位置加入目的 sgRNA 序列。将连接产物转化大肠杆菌DH5α感受态细胞,PCR验证并送往公司测序,构建PLIN1敲除载体。
1.2.3 相关引物序列 本试验中涉及的PLIN1 DNA区域PCR检测引物及mRNA定量检测引物见表1。

表1 引物序列Table 1 Primer sequence
1.3PLIN1突变细胞群获得 将猪PK15细胞分为4组,对照组转染空载体(简称CON组),其余3组为处理组,分别转染3种PLIN1-sgRNA,分别称为PLIN1-KO1、PLIN1-KO2组和PLIN1-KO3组。各组细胞转染36 h后利用5 μg/mL的嘌呤霉素筛选2 h, 10%胎牛血清DMEM培养富集基因突变后的细胞群,分别提取DNA、RNA和蛋白用于后续试验。
1.4PLIN1基因突变效率检测 提取各组细胞DNA 用PLIN1-KO引物(序列见表1)扩增,PCR产物纯化后连接至pGEM-T载体,转化DH5α后每组挑取50个菌落进行序列测定。提取各组细胞总mRNA并反转录为cDNA,用 pPLIN1和pGAPDH引物(序列见表1)进行qRT-PCR检测PLIN1表达水平。提取各组细胞群蛋白,用Western Blot检测各组细胞蛋白表达差异,利用Analysis软件测定杂交条带的灰度值,PLIN1蛋白灰度值和相应内参条带(GAPDH)的比值为各组PLIN1条带的相对表达量。PCR反应条件:95 ℃预变性5 min;95 ℃ 30 s,57 ℃ 25 s,72 ℃ 30 s,30个循环;72 ℃延伸8 min。qRT-PCR反应条件:95 ℃预变性 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,20 ℃ 15 s。具体试验方法见参考文献[7]。
2 结果
2.1PLIN1突变后DNA水平检测 处理组细胞PCR 产物连接pGEM-T载体,通过计算各组突变或缺失样本的比率计算各组DNA突变率,试验组PLIN1-KO1、PLIN1-KO2及PLIN1-KO3 DNA的突变率为8%、30%和18%,部分测序结果见封三彩版图2。
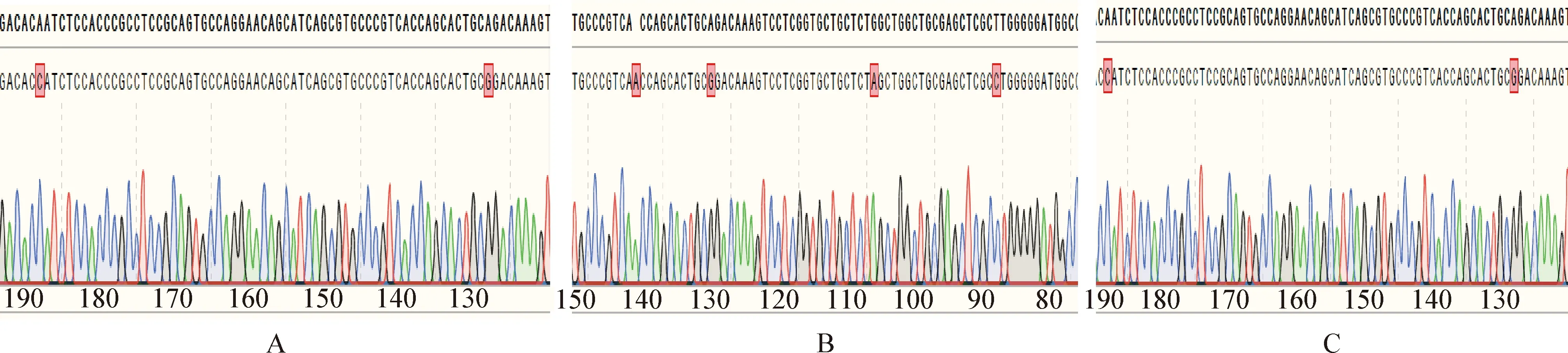
图2 细胞内DNA测序结果Fig.2 DNA sequencing results in cellsA:PLIN1-KO1细胞组突变; B:PLIN1-KO2细胞组突变; C:PLIN1-KO3细胞组突变A:Mutation of PLIN1-KO1 cell group; B:Mutation of PLIN1-KO2 cell group; C:Mutation of PLIN1-KO3 cell group
2.2PLIN1基因突变后mRNA表达变化检测 利用qRT-PCR测量各组mRNA 表达量,CON组PLIN1表达量为0.92±0.05,PLIN1-KO1、PLIN1-KO2、PLIN1-KO3组细胞中PLIN1表达量分别为0.31±0.07、0.20±0.01和0.66±0.04,处理组PLIN1表达分别比正常细胞下降66.30%、78.26%和28.26%。PLIN1-KO2组PLIN1表达水平显著低于CON组及其他各组(P<0.01),结果见图3。

图3 细胞内mRNA表达量Fig.3 Intracellular mRNA expression
2.3PLIN1突变后各组细胞PLIN1蛋白的表达 利用Western Blot检测各组细胞PLIN1蛋白表达,杂交条带通过灰度分析,CON组相对表达量为基准1.00,PLIN1-KO1、PLIN1-KO2和PLIN1-KO3三组蛋白相对表达量为0.45±0.03、0.26±0.07和0.37±0.05。处理组PLIN1表达量均显著下降(P<0.05),和CON组相比,处理组蛋白表达量分别下降55.00%、74.00%和63.00%。其中PLIN1-KO2组表达量下降极显著(P<0.01)。
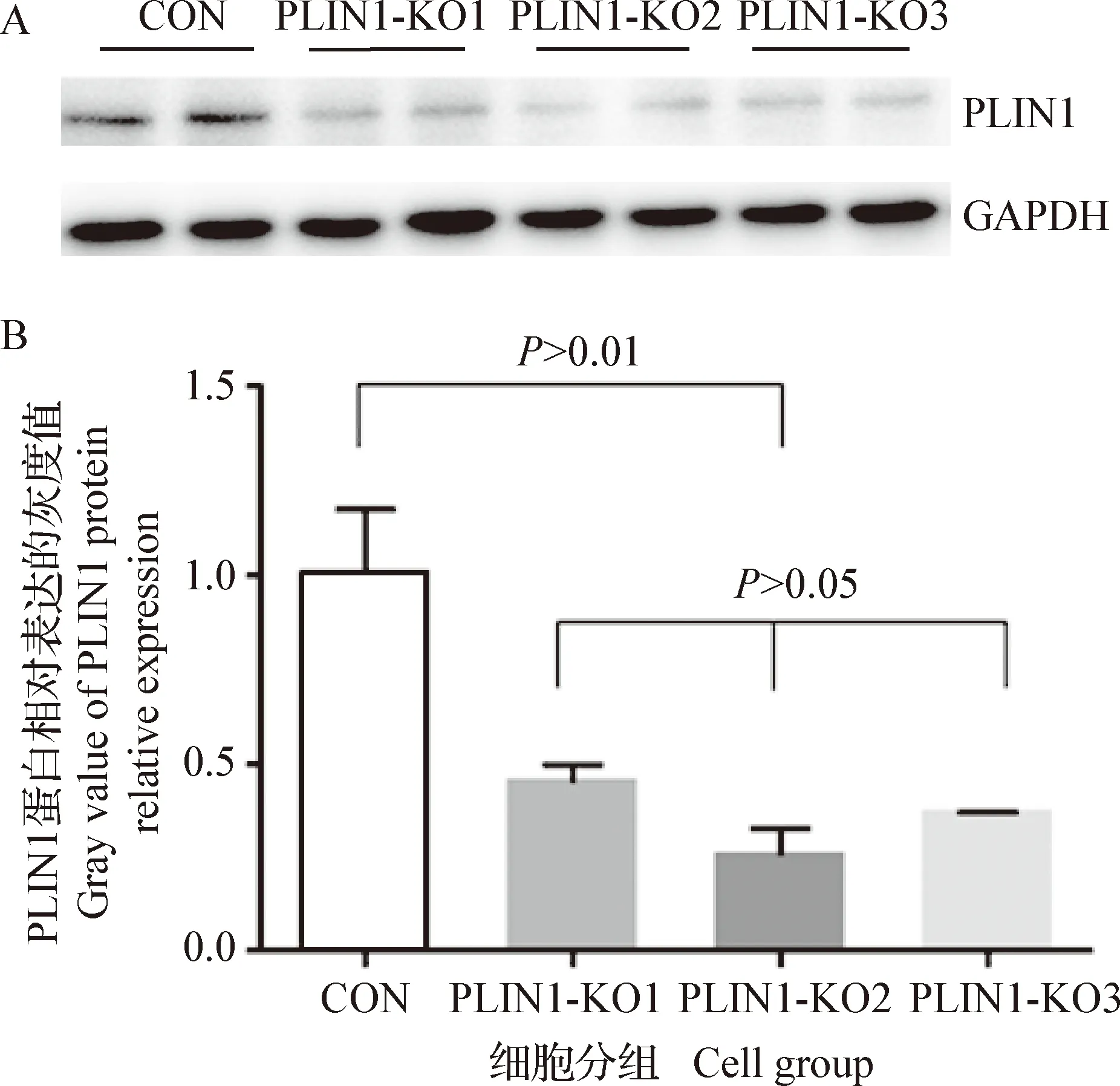
图4 细胞蛋白Western Blot检测及灰度分析Fig.4 Western Blot detection and gray scale analysis of cell proteinA:Western Blot显影图; B:PLIN1灰度分析图A:Developing figure of Western Blot; B:PLIN1 gray level analysis diagram
3 讨论
PLIN1基因在猪肌肉中广泛表达且能通过阻止脂肪酶水解甘油三酯的途径抑制基础脂解,进而促进脂滴的形成并能够改变线粒体功能[8],另外,PLIN1基因的表达水平和猪生长、胴体及肉质性状显著相关[9-10]。本课题小组在前期研究中,利用iTRAQ比较出PLIN1蛋白在巴马猪、大白猪肌肉组织蛋白中表达量差异显著,但PLIN1影响猪肉性状及线粒体功能的具体机制尚未明晰,所以我们拟通过突变PLIN1基因表达来开展相应功能研究。CRISPR/Cas9 基因编辑系统是近年来发现的一种能在多种动植物中实现基因突变的高效的工具[11],已有的研究表明切割位点设计在越靠前的外显子导致移码突变的概率越大[12],所以本试验选择在影响PLIN1重要蛋白功能结构域的第4外显子设计突变位点,为了提高突变成功率,设计3条CRISPR/Cas9突变的sgRNA,选择基因突变后能改变PLIN1基因表达效率最高的载体。在确定突变效率过程中,本试验从细胞群水平进行检测,由于突变载体上有嘌呤霉素抗性基因,本课题小组前期已经证明了PK15细胞的最小致死剂量是5 μg/mL嘌呤霉素筛选2 h, 本试验在此条件下对转染后的细胞进行筛选,在随后的细胞培养过程中大部分细胞会死亡,存活的细胞则是突变载体成功转染的细胞,以此富集的细胞群进行基因整体突变效率检测,大大减少后期细胞中阴性细胞的比例,在总体水平上可以更好的验证其切割活性。在检测突变效率过程中考虑到基因突变后,可能由于预测的突变位置不影响基因的表达,即存在PLIN1 RNA及蛋白表达没有变化的情况,或者蛋白水平的降低,本试验不仅从DNA层面通过PCR扩增、序列测定来鉴定PLIN1基因突变的效率,也进一步检测了PLIN1 RNA及蛋白水平的表达变化,检测结果可以互相验证,结果显示,PLIN1-KO2载体在DNA层面上基因突变率最高,该组细胞中PLIN1 RNA及蛋白表达降低幅度也最大。
本试验利用CRISPR/Cas9系统在猪PLIN1基因第4外显子设计了3条能够靶向切割PLIN1基因的sgRNA并构建相应的突变载体,转染入PK15细胞,富集crispr-sgRNA靶向切割引起的PLIN1基因突变或者外源碱基序列插入的细胞群。通过RNA及蛋白水平检测,3个PLIN1-KO敲除载体均能突变细胞中PLIN1基因,其中PLIN1-KO2载体突变效率最高,本试验为后续研究中突变猪细胞中PLIN1基因表达,研究该基因表达缺失后对细胞功能和线粒体功能的影响提供科学依据。

