巨鹿杏中β-胡萝卜素的HPLC分析及多地域杏果中含量比对
◎ 刘峥颢,庞艳苹,杨丽萍
(1.河北大学 质量技术监督学院,河北 保定 071002;2.保定市供水公司,河北 保定 071002)
类胡萝卜素广泛存在于植物性食品尤其是深色蔬菜水果中,其中最重要的是β-胡萝卜素。β-胡萝卜素属四萜类化合物,是维生素A的前体[1]。维生素A是人体必需的营养物质,对人的生长发育、新陈代谢都起着非常重要的作用[2]。亚洲人饮食中有65%~85%的维生素A来自β-胡萝卜素。与维生素A不同,摄入大剂量的β-胡萝卜素在体内不会蓄积中毒。研究表明,β-胡萝卜素具有预防多种肿瘤和心血管等疾病的作用,有利于提高机体免疫机能、抗衰老,尤其是对降低肿瘤发生率有显著效果,因此对一些食物中的β-胡萝卜素含量进行研究,有助于人们对食物进行选择,从而提高人们的健康水平。
从国内外研究结果分析,与其他食物相比,杏果肉含有丰富的β-胡萝卜素[3],因此可以将杏中β-胡萝卜素的含量作为杏营养价值的参考指标。
巨鹿县位于河北省南部,属温带半干旱、半湿润大陆季风区。平均日照时数2 767.4 h,四季分明,光热充沛,气温适中,雨热同季,适宜杏树的生长。巨鹿县杏产业自1986年起步以来,已成为巨鹿县最大的支柱产业[4]。
目前,对食品中β-胡萝卜素含量的测定方法主要有纸层析法[1]、薄层层析-分光光度法[5]、紫外分光光度法[6]、高效液相色谱法[7]等。其中,纸层析法比较烦琐,分析时间长;薄层层析法与紫外分光光度法分别以不同方法对样品中的β-胡萝卜素进行提取和分离,然后根据分光光度法对β-胡萝卜素进行定量测定,过程复杂;高效液相色谱法则以其快速、简便、灵活、准确等特点,逐步广泛的应用于胡萝卜素的研究分析中[8]。本文在国家标准的基础上,对β-胡萝卜素的提取与检测步骤进行了简化与改进,并对各产地的杏中β-胡萝卜素的含量进行比对,以确定巨鹿杏与其他杏中β-胡萝卜素含量的差异性,为巨鹿杏的质量特征因子分析和品质保证以及质量特征体系的建立提供理论依据,净化市场,维护消费者权益。
1 材料与方法
1.1 材料
1.1.1 样品
杏样品选用色泽橙黄、无腐蚀及病变的成熟果实,其中JL-ST-DHX的为大红杏,其余杏品种全部为串枝红杏。杏样品的产地、品种与代号见表1。
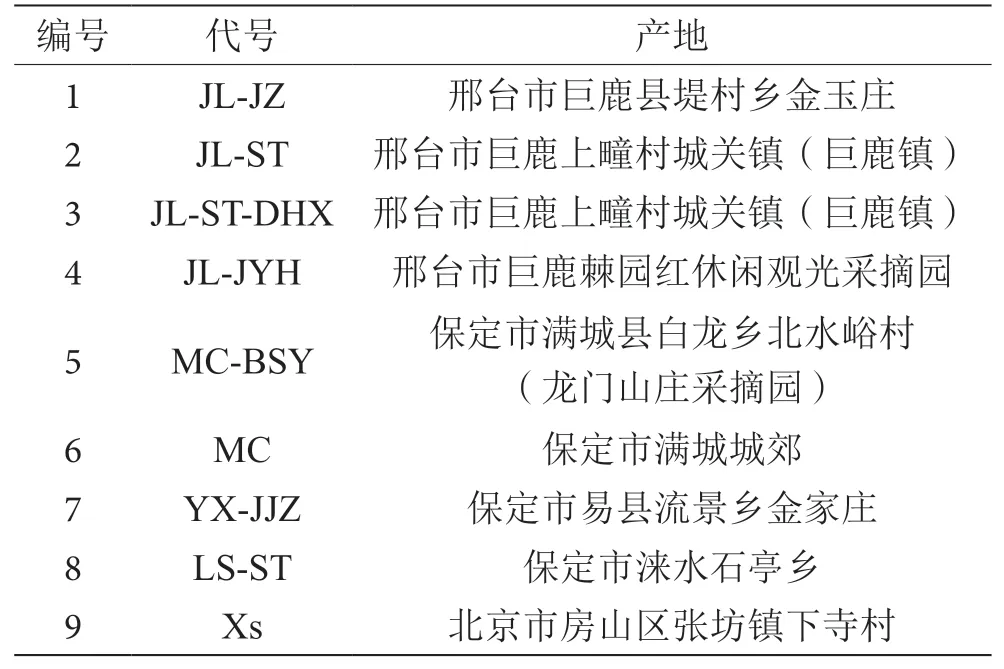
表1 杏的代号与产地表
1.1.2 试剂
β-胡萝卜素标准品(国家药品标准物质),甲醇(色谱纯)、乙酸乙酯(色谱纯)、石油醚(沸程30~60 ℃)、丙酮(分析纯)、NaCl(分析纯)均购自天津市科密欧化学试剂有限公司。
1.1.3 仪器和设备
岛津LC-10AT高效液相色谱仪;岛津SPD-15C紫外-可见检测器;色谱柱为Agilent XDB-C18(4.6 mm×250 mm,5 μm)不锈钢柱;KQ-500 DE型数控超声波清洗器(山东省昆山市超声仪器有限公司);TGL-16G飞鸽牌系列离心机(上海安亭科学仪器厂)。
1.2 实验方法
1.2.1 标准溶液的配制
准确称取5.00 mgβ-胡萝卜素,用少量氯仿溶解,石油醚定容至100 mL,再从中取1 mL定容至10 mL,所得到的β-胡萝卜素标准浓度为5.0 μg·mL-1。分别取标准溶液1 mL、2 mL、4 mL、6 mL和8 mL,定容至10 mL,分别得到浓度为0.5 μg·mL-1、1.0 μg·mL-1、2.0 μg·mL-1、3.0 μg·mL-1和4.0 μg·mL-1的标准溶液。
1.2.2 样品的前处理
选取同一产地的杏3个,在每个杏上均匀选取3个点切割称量,准确称量4.0 g。将称量好的样品移至研钵中,加入石油醚研磨。待研磨液呈黄色后,将提取液转入100 mL左右烧杯中,再向研钵中加入丙酮,按石油醚同样的方法研磨提取,并将提取液一并转入上述烧杯中。如此用石油醚、丙酮交替提取至杏肉无色,合并所有杏肉及提取液,转入离心管中,以12 000 r·min-1的转速离心20 min。离心停止后,将离心管中的上层液体转入加有饱和食盐水的分液漏斗中,并用丙酮清洗内壁附有无色果肉的离心管,确保上层清夜全部转入分液漏斗,与上述提取液合并。将分液漏斗中的液体摇匀,避光静置。待液体分层明显,将下层水溶液放入另一分液漏斗中再提取,上层液体转入25 mL容量瓶中,并用吸管吸取丙酮对上述分液漏斗进行清洗,如此反复直至提取液无色为止。合并所有提取液于上述25 mL容量瓶中,定容后,进行高效液相色谱分析(HPLC)。
1.2.3 高效液相色谱条件
流动相为甲醇-乙酸乙酯(50∶50,V/V);流速:1.0 mL·min-1;检测波长:448 nm;纸速:2 mm·min-1;柱温:室温;进样量为7.5 μL,这样可以实现待测组分的良好分离[9]。
2 结果与分析
2.1 标准曲线的绘制
将标准溶液经4.5 μm滤膜过滤,浓度由小到大依次进样,以7.5 μL为进样量进行高效液相色谱分析。以β-胡萝卜素含量X为横坐标,峰面积Y为纵坐标做标准曲线,得回归方程为Y=98 200X+8 373.8,r=0.999 8,线性范围为0.5~4.0 μg·mL-1。采用保留时间对照法和标准追加法确定β-胡萝卜素峰的位置,由此可实现β-胡萝卜素峰的分离与识别,具体见图1。
从图1中可以看出,β-胡萝卜素的出峰时间在6~7 min,峰结束时间为7~8 min。

图1 β-胡萝卜素液相色谱分离图
2.2 方法的回收率
准确称取某一产地的杏20.0 g,将其研磨碎并混合均匀;将此样品平均分成5份,每份质量相等。分别加入0 μg、20 μg、40 μg、80 μg和100 μg的β-胡萝卜素,按2.1.3进行提取、定容,测定β-胡萝卜素的回收率,实验结果见表2。
由表2可知,β-胡萝卜素的平均回收率为99.22%,变异系数为5.17%,表明该方法有较高的准确度,能够满足分析要求。
2.3 方法的精密度
准确称取某一产地的杏4.0 g,按1.2.2进行提取,定容。以7.5 μL的进样量进样5次,进行精密度分析,实验结果见表3。
由表3可知,5次β-胡萝卜素测定结果的平均值为63.22 μg,标准偏差为2.03%,变异系数为3.2%,表明仪器精密度良好。
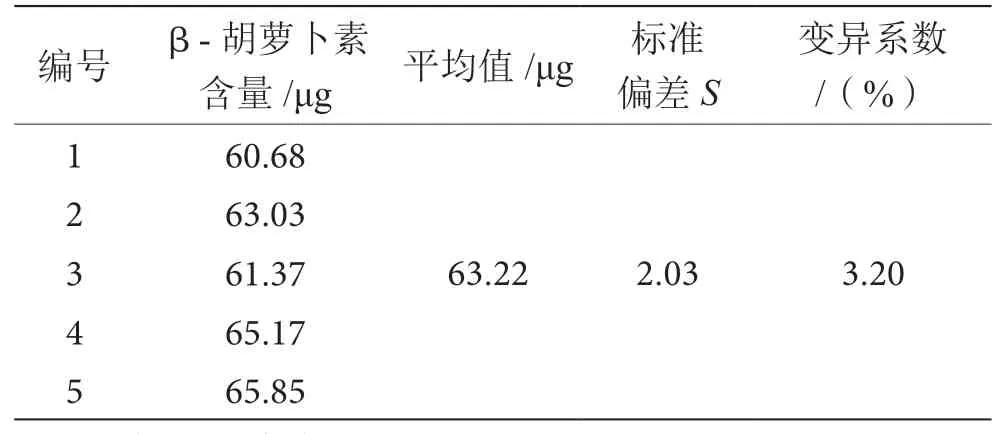
表3 精密度实验表
2.4 方法的稳定性
准确称取某一产地的杏4.0 g,按2.1.3进行提取,定容。分别以0.5 h、1 h、2 h、8 h、24 h、48 h的时间间隔进样7次,进行稳定性实验,实验结果见表4。
由表4可知,检测样品在48 h内β-胡萝卜素含量的标准偏差为0.33,表明检测样品在48 h内具有较好的稳定性。

表4 稳定性实验表
2.5 杏中β-胡萝卜素含量的测定结果与分析
分别准确称取9种不同型号的杏各4.0 g。按1.2.2进行提取,定容。以7.5 μL为进样量,对杏提取液进行高效液相色谱分析。根据所测定的β-胡萝卜素的峰面积,及标准品所得的回归方程计算出各个产地杏中β-胡萝卜素的含量,结果见表5。
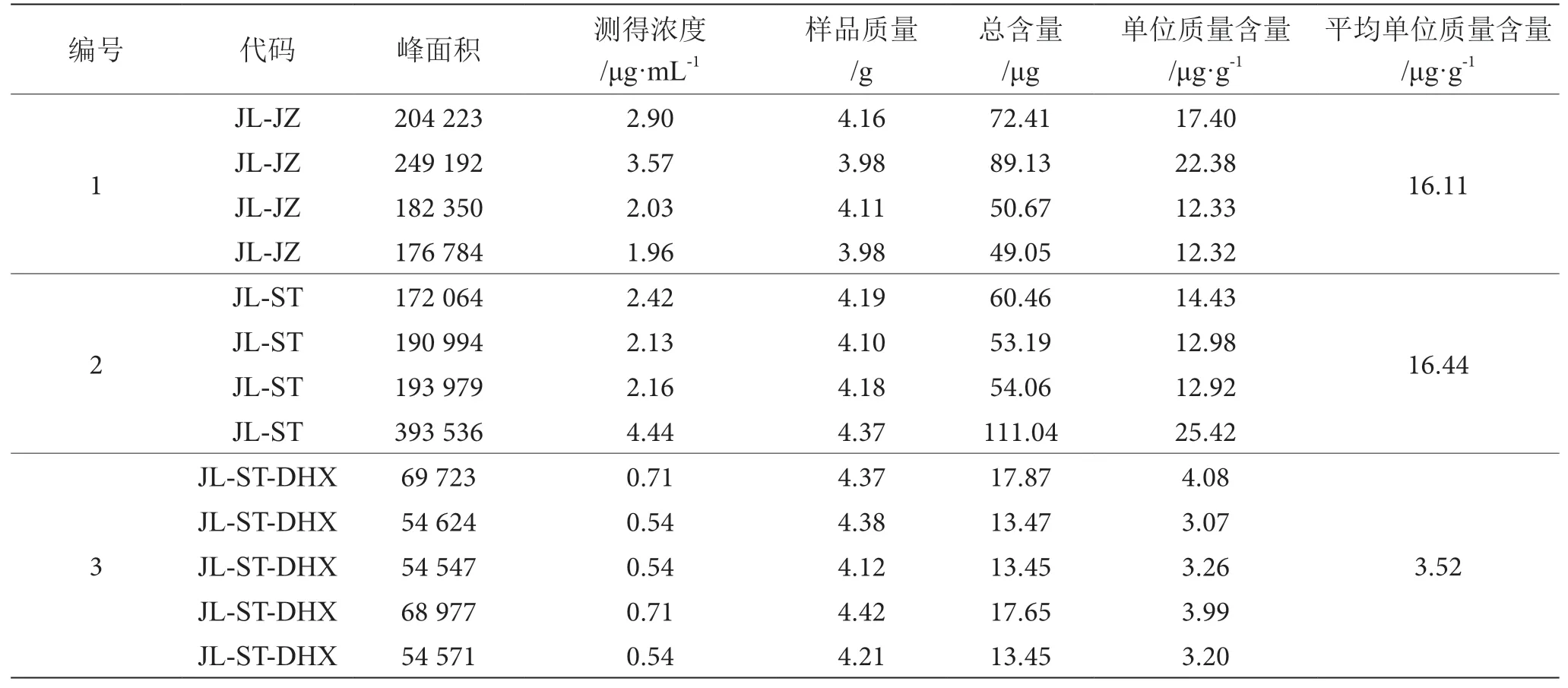
表5 各产地杏中β-胡萝卜素含量的测定表
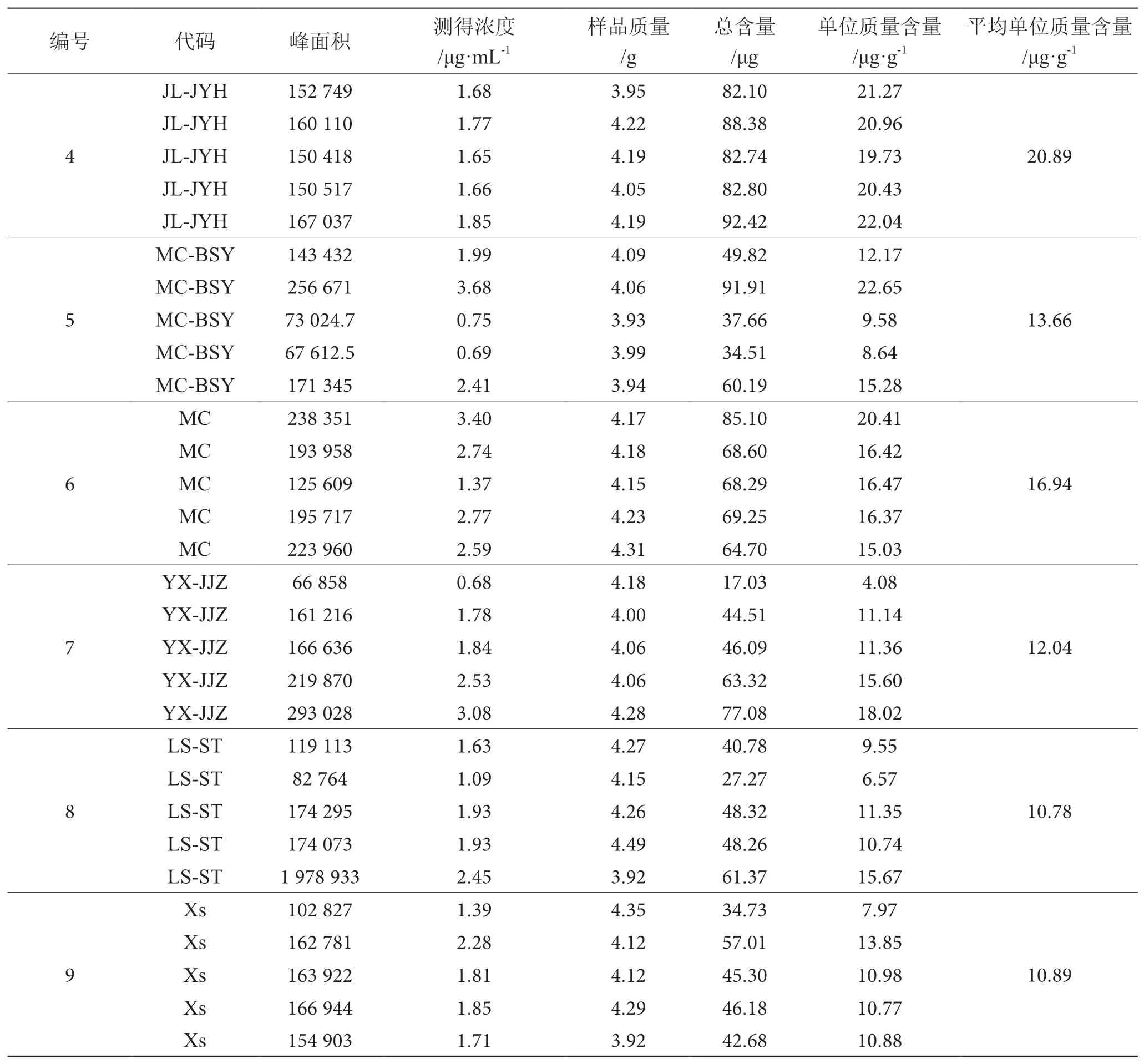
续表5
由以上分析可得,在所研究的几个产地的杏中,来自巨鹿上疃村城关镇的大红杏,其β-胡萝卜素含量最低,平均值为3.52 μg·g-1;β-胡萝卜素含量最高的产地为巨鹿棘园红休闲观光采摘园,其平均值为20.89 μg·g-1,约为大红杏含量的6倍;而巨鹿县其他产地中,β-胡萝卜素含量相对较高,分别达到大红杏的4.58倍、4.67倍;巨鹿县以外的产地中,β-胡萝卜素含量最高的是满城城郊,其含量达到大红杏的4.81倍,而其余产地,β-胡萝卜素含量分别为大红杏的3.88倍、3.42倍、3.06倍、3.09倍,含量较低。
2.6 聚类分析法
对测试样品的数据进行聚类分析,如图2所示,得到较好的分类结果。当距离为25时,可将不同产地的杏分为2类,巨鹿大红杏聚为1类,串枝红杏聚为1类,表明以β-胡萝卜素含量为原始变量可以较好的区分大红杏和串枝红杏这两个品种。当距离较小时,巨鹿其他采集点的杏聚为2类,其他产地满城、易县、涞水、房山聚为2类,表明巨鹿杏和其他产地杏有较好的区分度,但由于产地相近,个别产地聚类出现偏差,尤其是非巨鹿杏产地低区分度不高。

图2 巨鹿杏与其他地域杏中β-胡萝卜素含量聚类分析树状图
3 结论
本研究利用高效液相色谱法对几个产地杏中β-胡萝卜素含量进行测定。结果表明,以石油醚和丙酮为提取剂,对样品进行多次研磨而后经过离心、分液可以对杏中的β-胡萝卜素进行很好的提取和分离;测量结果的平均回收率为99.22%,稳定性为2.14%,精密度也可达到3.20%。综上所述,此方法具有较高的回收率,同时也具有较好的稳定性和准确性。与其他方法相比,此法大大缩短了样品的处理时间,简化了处理步骤,提高了测量结果的准确性。
通过对河北省邢台市巨鹿县县内主要杏品种的研究,并与保定满城、易县、涞水以及北京房山的杏进行比对后可以看出,巨鹿杏中除大红杏以外,其他品种(串枝红杏)β-胡萝卜素含量相对较高;巨鹿上疃村城关镇(巨鹿镇)的大红杏,在各产地中β-胡萝卜素含量最低,但其β-胡萝卜素含量稳定,范围为3.07~4.08 μg·g-1,平均值为3.52 μg·g-1;巨鹿棘园红休闲观光采摘园的杏中β-胡萝卜素含量较高且较稳定,其含量值在19.73~22.04 μg·g-1,平均值达到大红杏的6倍;巨鹿上疃村城关镇(巨鹿镇)的杏中,β-胡萝卜素含量虽不稳定,但存在β-胡萝卜素含量较高者,其含量达到25.42 μg·g-1,位居各产地含量之首,因此β-胡萝卜素含量可以作为研究巨鹿杏的特征值之一,通过聚类分析法获得较好的结果。
本研究对β-胡萝卜素的提取和测量方法进行了改进,为杏中β-胡萝卜素含量快速测定及巨鹿杏的品质特征性研究提供了理论依据,对杏品质保真研究和质量保证具有较高的应用价值和极大的现实意义。
——河北省巨鹿县西郭城镇中心小学书法社团活动掠影

