抗程序性细胞死亡受体1抗体导致孤立性促肾上腺皮质激素缺乏一例
王芬 刘洋 陈茜 杨雁
患者,男,51岁,因“乏力、纳差8个月”于2020年6月入院。2019年10月23日患者因右侧输尿管高级别浸润性尿路上皮癌接受第4次卡瑞丽珠单抗治疗后出现乏力、纳差,体重逐渐下降4 kg。2019月10月25日实验室检查结果示:ALT 222.4 U/L(0~46.0 U/L,括号内为正常参考值范围,以下相同),AST 427.0 U/L(0~46.0 U/L),碱性磷酸酶364.0 U/L(15.0~121.0 U/L),血肌酐139.0 μmol/L(41.0~111.0 μmol/L),血钾4.63 mmol/L(3.50~5.40 mmol/L),血钠135.7 mmol/L(135.0~148.0 mmol/L)。游离甲状腺素(FT4)14.4 pmol/L(12.0~22.0 pmol/L),游离三碘甲腺原氨酸(FT3)5.63 pmol/L(3.10~6.80 pmol/L),促甲状腺激素(TSH)2.550 μIU/ml(0.270~4.200 μIU/ml)。当地医院考虑为抗程序性细胞死亡受体1(PD-1)抗体相关性肝功能不良,予强的松每天50 mg口服治疗,每3天减量5mg,1个月后停用强的松。治疗期间患者上述症状好转。2020年1月患者再次出现显著乏力、纳差,于当地医院查肝功能正常。静脉注射糖皮质激素3天后症状好转。2020年2月患者反复出现乏力、纳差,自行服用强的松每周10 mg,症状可好转,停药后再发。4天前患者症状再次复发,以“乏力待查”收入华中科技大学同济医学院附属同济医院内分泌科。既往史:2017年4月患者因右侧输尿管高级别浸润性尿路上皮癌行右肾+输尿管切除术,术后行吉西他滨+顺铂方案化疗6次。2018年1月发现肺部转移,改用紫杉醇+顺铂方案化疗3次;2018年9月~2019年3月行白蛋白结合型紫杉醇化疗3次;2019年5月行肺部转移灶放疗;2019年10月9日行左肺上叶舌段切除+左肺下叶背段部分切除术;2019年8月3日、8月23日、9月25日、10月23日分别行4次卡瑞丽珠单抗(每次200 mg)治疗。入院体格检查:T 36.2 ℃,P 80次/分,R 20次/分,Bp 100/66 mmHg。神志清楚,精神可,营养一般。皮肤黏膜未见色素沉着,心、肺、腹体格检查未见明显异常。辅助检查:血红蛋白112.0 g/L,嗜酸性粒细胞1.8%,尿比重1.013,肝功能正常,血肌酐106 μmol/L(60~104 μmol/L),血钾4.67 mmol/L,血钠140.1 mmol/L,空腹血糖4.19 mmol/L。垂体前叶功能检测结果示:促肾上腺皮质激素(ACTH),为正常低限,皮质醇显著降低(表1)。胰岛素低血糖兴奋试验检测结果示:生长激素水平明显上升,皮质醇水平无明显上升(表2)。垂体磁共振成像(MRI)平扫结果未见明显异常。诊断:孤立性ACTH素缺乏症(IAD);右输尿管癌伴肺部转移综合治疗后。给予患者强的松2.5mg隔日1次口服治疗,但仍觉乏力、精神不佳,遂调整至每日5.0 mg,症状明显好转。
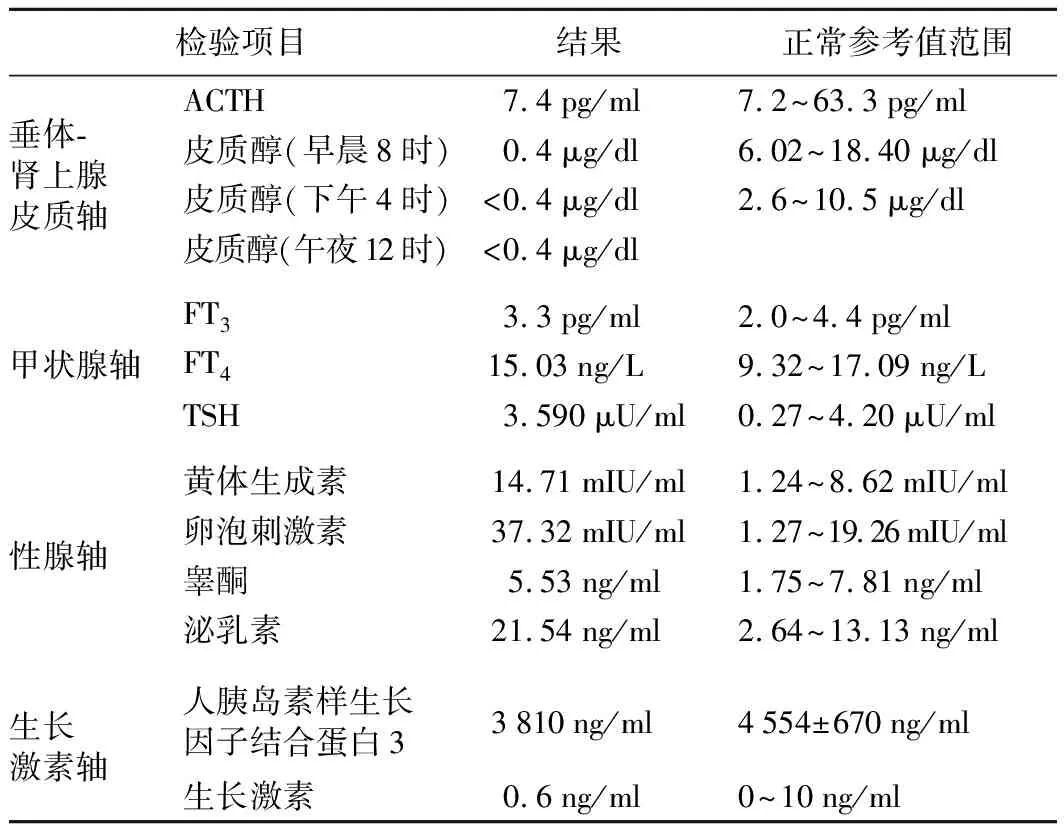
表1 患者的垂体前叶功能检测结果
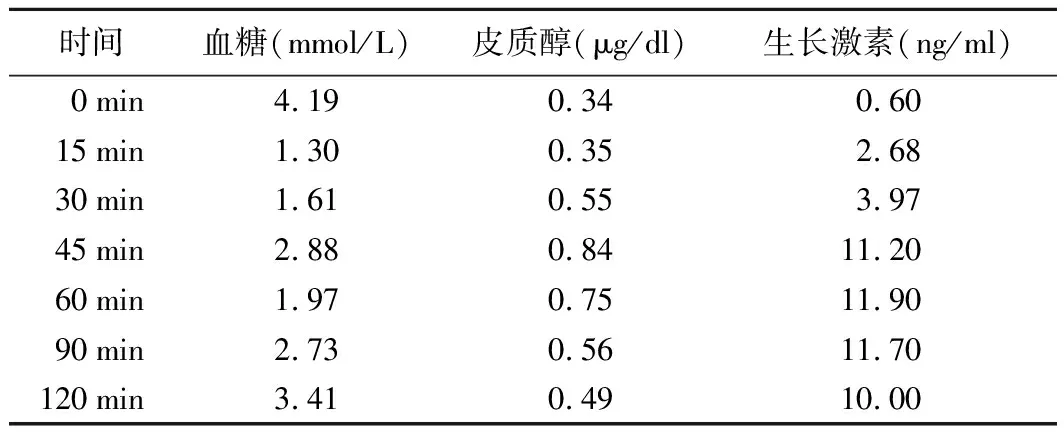
表2 胰岛素低血糖兴奋试验结果
讨 论
免疫检查点抑制剂(ICIs)包括抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抗体、抗PD-1抗体和抗程序性细胞死亡配体1(PD-L1)抗体[1]。卡瑞丽珠单抗为抗PD-1抗体之一。目前ICIs在多种恶性肿瘤如黑色素瘤、非小细胞肺癌、霍奇金淋巴瘤等中广泛应用,也用于治疗消化系统、泌尿系统的恶性肿瘤。随着ICIs的广泛应用,其不良反应也得到了较多报道[2],如在皮肤可表现为皮肤瘙痒、皮疹、白癜风;在肺部可表现为肺炎;在内分泌系统可表现为甲状腺功能减退、甲状腺功能亢进、垂体炎、肾上腺功能减退、糖尿病等[2]。美国食品药品监督管理局不良反应报告系统收集了2014~2019年第一季度发生的ICIs相关的内分泌系统不良反应的病例资料显示,2019年第一季度报道的病例数量是2014年整年的6.3倍。最常见的内分泌系统不良反应为甲状腺功能减退,占总体的14.14%,其次为肾上腺功能不全(11.66%)、垂体炎(10.99%)、甲状腺功能亢进(7.54%)、糖尿病(<1%)[3]。内分泌系统不良反应的发生常与免疫反应有关,可检测出相应的抗体,如甲状腺免疫球蛋白抗体、甲状腺过氧化物酶抗体、抗肾上腺抗体、抗垂体前叶细胞抗体等。
ICIs导致的内分泌系统不良反应也有相应的时间规律。如抗PD-1抗体尼沃单抗导致的内分泌系统相关不良反应出现的中位时间为距离第1次使用尼沃单抗后10.4(3.6,46.9)周[2]。本例患者ACTH缺乏出现的时间距离第1次使用卡瑞丽珠单抗11.5周(卡瑞丽珠单抗使用4次后)。从文献检索结果来看,IAD即可发生于使用尼沃单抗多达20次之后[4],也可发生于使用尼沃单抗2次之后(通常每3周使用1次尼沃单抗)[5]。IAD常发生于规律使用ICIs时,也可发生于停药数月之后。而在地区分布上,Pubmed检索到的71例ICIs相关的IAD报道中,日本报道占71.8%,可能与人类白细胞抗原(HLA)的分型相关[6]。
除IAD外,ICIs相关的IAD患者也可合并其他的内分泌功能紊乱。在Pubmed检索到的71例ICIs相关IAD病例中,18例患者合并自身免疫性甲状腺疾病,1例患者合并尿崩症,2例患者合并1型糖尿病,1例患者合并暴发型糖尿病。这种合并疾病在非ICIs导致的肾上腺皮质功能减退症中也存在[7]。
ICIs导致的肾上腺皮质功能减退症根据严重程度可分为4级[1]:1级为无肾上腺皮质功能减退的症状;2级为存在中度肾上腺皮质功能减退的症状,需要药物干预;3级为存在严重肾上腺皮质功能减退的症状,需要住院;4级为存在威胁生命的情况,需要紧急干预。对于1级不良反应,可继续ICIs治疗;对于2级不良反应,在恢复免疫治疗之前可开始每天使用氢可的松15~20 mg替代治疗,直至患者病情稳定;3级及以上的不良反应需暂停ICIs治疗,可能需要应激剂量的静脉糖皮质激素治疗。出现内分泌系统不良反应之后,是否继续使用ICIs通常取决于ICIs对原发病治疗影响的利弊权衡,通常不会仅仅因内分泌腺体的不良反应而弃用ICIs[1,8]。本例患者出现3级肾上腺皮质功能减退的症状,暂停卡瑞丽珠单抗治疗,由于原发疾病病情平稳,暂未恢复卡瑞丽珠单抗治疗。
ICIs相关的内分泌腺体功能减退以替代治疗为主,内分泌腺体功能亢进以抑制治疗为主。对于抗细胞毒性T淋巴细胞抗原4(CTLA4)抗体引起的类似于淋巴细胞性垂体炎相关的改变可使用大剂量糖皮质激素治疗。有文献报道,性腺轴和甲状腺轴功能均可能恢复[9],但糖尿病、肾上腺皮质功能减退患者一般难以逆转[10]。
综上,ICIs导致的IAD少见,多与抗PD-1、PD-L1抗体相关。IAD导致的乏力、纳差、恶心需与ICIs的一般不良反应鉴别。IAD可能致命,及时诊断、及时治疗至关重要。

