代谢因素对银屑病关节炎的影响
张金涛 戴冰冰 刘畅
银屑病关节炎(PsA)是一种与银屑病相关的炎性关节病,具有银屑病皮疹并导致关节和周围软组织疼痛、肿胀、压痛、僵硬和运动障碍,部分患者可出现骶髂关节炎和脊柱炎,病情迁延、易复发、晚期可出现关节强直,导致残疾[1]。美国流行病学调查结果显示,PsA患病率为0.06%~0.25%,银屑病患者约5%~7%发生关节炎,我国PsA患病率约为0.123%[2]。近年来已有研究发现银屑病关节炎和代谢综合征(MS)之间关系密切[3-5]。本研究通过分析代谢因素对PsA的影响,旨在探讨其代谢方面可能的危险因素,对疾病的早期预防、治疗及改善预后提供帮助。
对象与方法
1.对象:2013年1月~2018年12月于我科住院的符合Moll-Wright银屑病关节炎分类标准的PsA患者77例(PsA组),其中男34例(44.2%),女43例(55.8%),年龄40.0~61.0岁,中位年龄54.0岁;另选取于我院体检中心体检的健康者49例(对照组),其中男22例(44.9%),女27例(55.1%),年龄48.5~58.5岁,中位年龄55岁。排除标准:(1)近期有感染、严重肝脏疾病、心脑血管疾病及肿瘤;(2)应用影响脂质代谢的药物(噻嗪类、β-受体阻滞剂、局部或全身性激素制剂、他汀类药物、贝特类药物等)。
2.方法:收集两组受试者的临床资料,主要是与代谢相关的可能危险因素,包括:年龄、吸烟史、血尿酸(SUA)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、BMI及合并血糖升高(空腹血糖≥5.6 mmol/L)、高血压、肾功能不全情况。TC>5.18 mmol/L为高TC血症;TG>1.70 mmol/L为高TG血症;男性HDL-C<1.0 mmol/L、女性<1.3 mmol/L为低HDL-C血症;LDL>3.12 mmol/L为高LDL-C血症;男性和绝经期后女性SUA>420 μmol/L、绝经期前女性>360 μmol/L定义为高尿酸血症。每天至少吸烟1支且连续吸烟≥1年定义为吸烟。BMI正常范围为18.5~23.9 kg/m2,BMI≥24 kg/m2为超重。血肌酐>110 μmol/L定义为肾功能不全。采用2009年国际糖尿病联盟(IDF)和美国心脏协会/美国国家心、肺、血研究所(AHA/NHLBI)共同制定的新MS定义,符合以下3项及以上可诊断:(1)腹部肥胖;(2)血TG≥1.7 mmol/L;(3)血HDL-C水平降低,男性<1.0 mmol/L,女性<1.3 mmol/L;(4)血压升高:收缩压≥130 mmHg和舒张压≥85 mmHg;(5)空腹血糖升高>5.6 mmol/L。
3.统计学处理:应用SPSS 22.0软件进行统计分析。符合正态分布但方差不齐或不符合正态分布的计量资料以M(P25,P75)表示,两组间比较均采用Mann-WhitneyU检验。计数资料以例数和百分比表示,两组间比较采用χ2检验。PsA代谢方面的危险因素分析采用二元logistic回归分析。以P<0.05为差异有统计学意义。
结 果
1.PsA组和对照组受试者MS的发生率比较:PsA组患者MS的发生率(29/77,37.7%)明显高于对照组(10/49,20.4%),差异有统计学意义(P=0.041)。
2.PsA组和对照组受试者各项指标构成比及其水平比较:PsA组合并高尿酸血症、低HDL-C血症、超重患者比例均高于对照组(P<0.05),而两组男性、年龄≥60岁、吸烟、合并高TC血症、高TG血症、高LDL-C血症、高血压、血糖升高、肾功能不全受试者比例比较差异均无统计学意义(P>0.05)。见表1。PsA组受试者SUA水平、BMI均高于对照组,HDL-C水平低于对照组(P<0.05),而两组受试者年龄、TC、TG、LDL-C水平比较差异均无统计学意义(P>0.05)。见表2。
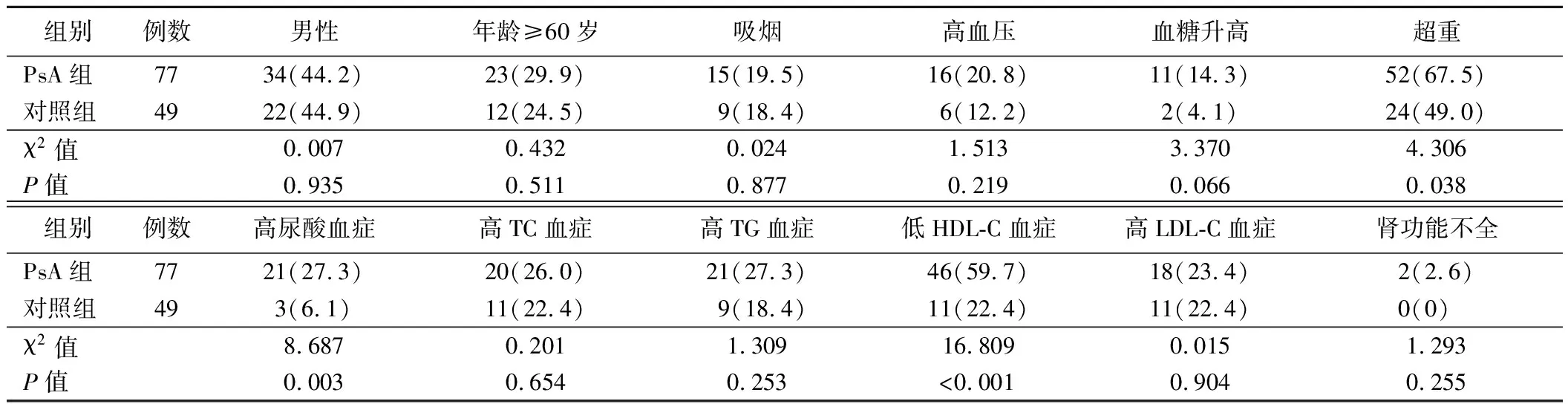
表1 PsA组和对照组受试者各项指标构成比比较[例,%]
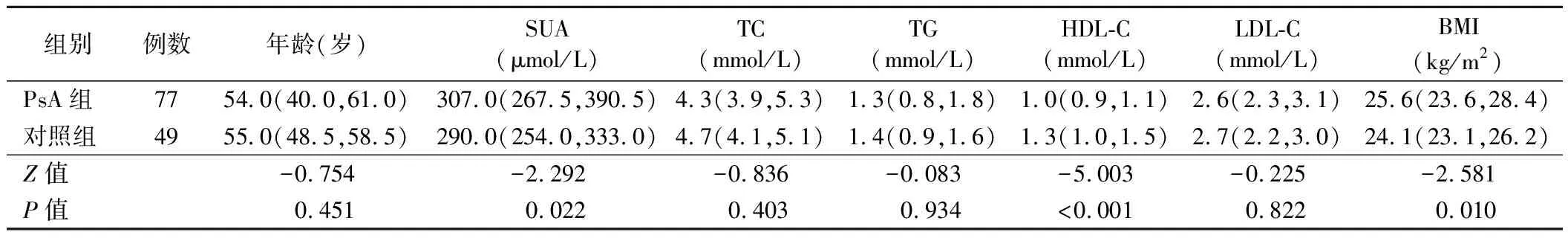
表2 PsA组和对照组受试者各项指标水平比较[M(P25,P75)]
3.PsA代谢方面危险因素的二元logistic回归分析:PsA组和对照组比较结果显示,两组高尿酸血症、低HDL-C血症、超重患者比例比较差异均有统计学意
义,但目前的多数临床研究表明,高尿酸血症是PsA中的常见临床表现之一,且影响SUA的因素较多,为避免该因素造成系统误差,因此在构建二元logistic回归过程中,分别构建模型1及模型2来进一步判断PsA代谢方面的可能危险因素。其中模型1以高尿酸血症、低HDL-C血症、超重为自变量,以有无PsA为因变量;模型2以低HDL-C血症、超重为自变量,以有无PsA为因变量。结果显示,模型1中,高尿酸血症和低HDL血症均为PsA代谢方面的独立危险因素(P<0.05);模型2中,超重和低HDL-C血症均为PsA代谢方面的独立危险因素(P<0.05)。见表3。
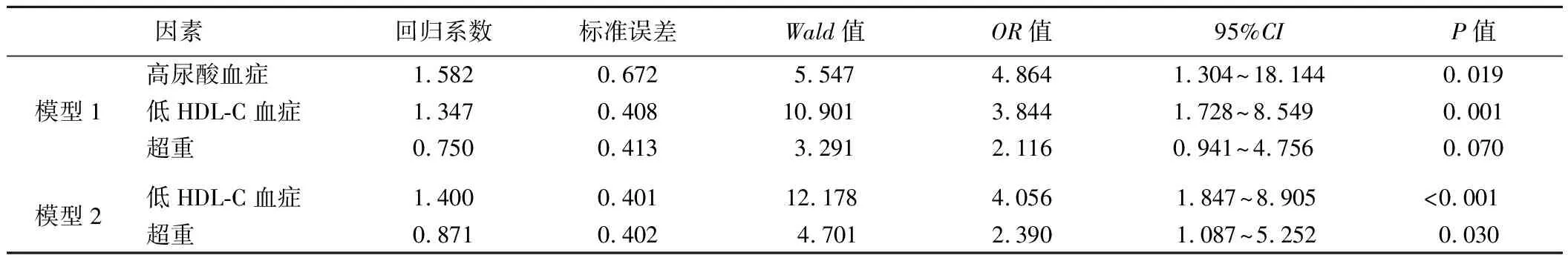
表3 PsA代谢方面危险因素的二元logistic回归分析
讨 论
越来越多的证据表明PsA患者中MS的发生率较高[4-5]。本研究中,PsA组患者MS的发生率高于对照组,与既往文献报道一致。MS由一组代谢性危险因素组成,包括腹型肥胖、葡萄糖耐受不良、高血压、高TG血症、低HDL-血症及胰岛素抵抗(IR)等。慢性促炎状态在PsA合并MS中起重要作用,脂肪因子可调节PsA炎症和新陈代谢状态[6-7]。PsA患者外周血、皮肤、滑膜和体液中的肿瘤坏死因子(TNF)-α、白细胞介素(IL)-17及IL-6上调,而TNF-α、IL-17及IL-6可以诱导IR[8]。既往文献报道,与普通人群相比,牛皮癣和PsA患者明显超重(BMI为25.00~29.99 kg/m2),且这些患者似乎更可能患有严重的皮肤和关节疾病[9-10],适当的控制体重可能会控制PsA的发生,PsA患者高尿酸血症和血脂异常的发生率较高[5,11],与本研究中PsA组患者BMI、SUA水平高于对照组,HDL-C水平低于对照组的结果一致。
早在1982年,Lundquist等[12]发现银屑病患者黄嘌呤氧化酶和尿嘌呤酶在人体皮肤表皮中活性增加,进一步导致核酸降解率增加,核酸降解后形成大量嘌呤,最后嘌呤在机体中代谢后形成高尿酸血症。本研究结果显示,高尿酸血症、低HDL-C血症、超重是PsA的危险因素,与国外报道高尿酸血症是PsA的危险因素一致[5,13]。2000年Bruce[14]等发现20.7%的PsA患者合并高尿酸血症。2018年AlJohani等[15]研究发现PsA患者中31.9%发生高尿酸血症。本研究中,PsA患者中高尿酸血症的发生率为27.3%,与国外报道的结果相似。尿酸盐结晶是一种“警报器”,它能通过核苷酸结合寡聚化结构域样受体3(NALP3)炎症小体激活先天免疫系统,诱发强烈的炎症反应如产生细胞因子、IL-1和IL-18[16]。在含有尿酸盐晶体的培养表皮细胞中,NALP3炎症小体的形成和TNF-α、IL-1α,IL-8/趋化因子(CXC)配体8和IL-6的产生也已得到证实[17],这些细胞因子参与免疫反应的银屑病斑块的发病机制,先天免疫系统对微小尿酸结晶过度敏感的患者容易患银屑病。与类风湿性关节炎等其他关节炎患者比较,尿酸盐结晶也能更频繁的在PsA患者关节液中检测到[18-19],提示尿酸可能参与PsA的发病机制。
本研究结果显示,PsA组高尿酸血症、低HDL-C血症、超重患者比例均明显高于对照组。高尿酸血症在PsA患者中很常见,由于银屑病皮肤代谢加快,可产生大量的代谢产物,为消除可能混杂因素的影响,本研究构建模型1(纳入高尿酸血症为自变量)及模型2(不纳入高尿酸血症为自变量),结果表明,高尿酸血症可能为本研究的混杂因素,关于高尿酸血症是否为银屑病关节炎代谢方面的危险因素,仍需要进一步的前瞻性研究进行探讨。本研究结果显示,超重、低HDL是PsA代谢方面的危险因素。既往文献报道指甲、头部及臀部皮损在PsA中更多见[20],本研究未对银屑病皮损进行分析。临床对有指甲、头部及臀部皮损或高尿酸血症或超重、低HDL-C血症的银屑病患者需动态随访注意早期发现是否存在PsA,早期诊断、早期治疗以改善预后和提高生活质量。
关于PsA患者脂质异常已有相关报道。既往文献报道牛皮癣或PsA患者具有多种血脂变化,可出现血清TC、LDL-C和TG水平升高,HDL-C、载脂蛋白A(ApoA)和载脂蛋白B(ApoB)水平降低[5,11,21-22]。本研究中,PsA组患者HDL-C水平低于对照组,低HDL-C是PsA代谢方面的危险因素,与既往报道一致,分析原因考虑可能为低HDL-C患者的抗炎、抗氧化、血管保护因素减弱,引起辅助性T细胞1(Th1)的增加、炎症因子如TNF/IL/干扰素(IFN)等炎症因子的释放从而诱发免疫紊乱发生PsA。血HDL-C降低在冠心病发病过程中具有重要作用,是冠心病的重要危险因素。所以PsA合并低HDL-C血症更易发生心血管疾病,临床需高度重视,积极治疗PsA可预防心血管疾病的发生。近年来的研究结果也显示,血脂代谢异常是心血管疾病发生的必要条件,高密度脂蛋白(HDL)的血管保护作用是由于它可通过胆固醇逆转运,将胆固醇从周围组织(包括动脉粥样硬化斑块)转运至肝脏进行再循环或以胆汁酸的形式排泄,从而减少脂质在血管壁的沉积[23];HDL还能调节内皮一氧化氮的生成和活性,改善内皮功能;此外HDL尚可通过抗氧化、抗炎、抗血栓和促纤溶及清除毒性磷脂等作用,发挥保护血管的功能。也有新的研究发现,HDL-C水平并不等同于HDL功能,HDL功能而非HDL-C水平与动脉粥样硬化的关系近年来被更多的关注,但目前临床上尚无公认的简便易行的HDL功能检测方法,还需临床进一步探索。
关于高尿酸血症与PsA的关系仍存在争议。有研究发现PsA患者中高尿酸血症与无临床症状的动脉硬化具有明显相关性[24],提示慢性系统性炎症和内皮细胞的损伤可能使无症状的高尿酸血症和动脉粥样硬化之间存在联系。AlJohani等[15]发现有高尿酸血症的PsA患者患心血管疾病的概率增加。高尿酸血症不仅能导致痛风且能刺激系统炎症反应导致心血管事件和肾脏疾病的发生。美国一项关于银屑病、PsA患者患痛风事件的大样本随访研究发现,银屑病和PsA均能增加痛风的发生风险[25]。本研究中,PsA患者3个月随访时发现有2例患冠心病(1例SUA升高,1例血HDL-C水平降低),3例患痛风。PsA、高尿酸血症和痛风与代谢综合征及心血管事件的发生密切相关[26-27]。有研究结果显示,对于病情较长和肥胖的PsA患者,适当控制高尿酸血症、控制体重和代谢性疾病可能在预防PsA发生、改善预后(发生心血管疾病等)方面起重要作用[15]。
综上,PsA患者出现超重和低HDL-C血症的概率较高,超重和低HDL-C血症可能是PsA代谢方面的独立危险因素,高尿酸血症有可能参与了PsA的发病机制,适当控制BMI或代谢性疾病可以预防PsA的发生,积极治疗PsA可以减少心血管事件的发生。本研究样本量相对较小,且可能有一些未考虑到的因素,对于PsA发病的危险因素还需大样本的临床研究进一步探讨。

