四川省动物源常见细菌耐药性现状
郝 运 ,周沁怡,李 锐,杨 华,郝力力,唐 标*
(1.西南民族大学生命科学与技术学院,四川成都 610041;2.浙江省农业科学院农产品质量安全与营养研究所,浙江杭州 310021;3.南京农业大学动物医学院,江苏南京 210095)
细菌耐药性问题已经成为全球重要的公共卫生问题。抗生素治疗人和动物疾病效果突出,给人和动物的健康带来巨大福祉。然而,近年来在养殖业大量使用抗生素,养殖从业人员过分依赖抗生素,甚至出现滥用抗生素的现象。许多养殖农户对于细菌耐药性问题认识不足,认为只要大量使用抗生素,延长其使用时间就可以达到预防和治疗疾病的效果。抗生素作为促生长剂的大量使用,是导致致病菌出现耐药性的主因。从国内外的研究报道来看,大肠埃希氏菌、沙门氏菌等常见致病菌的耐药性不断升高,耐药基因流行区域广,且不断出现新的变异耐药基因。一些常见抗生素在动物疾病治疗中已失去价值。王丹等[1]对哈尔滨地区分离的23株沙门氏菌的药敏试验结果显示,对四环素的耐药率最高,对氨苄西林、环丙沙星、庆大霉素等药物的耐药率仅为8.7%。Lei C W等[2]从山东、贵州等12个省份36个畜禽养殖场中分离到208株屎肠球菌和137株粪肠球菌,并从中检测到19株有poxtA耐药基因的菌株,这19株菌均对氯霉素、氟苯尼考、红霉素和多西环素耐药。另外,据江婷婷[3]等报道显示,我国西南地区1999年、2003年、2006年3个不同时期猪源大肠埃希氏菌对四环素、多西环素、氟苯尼考等10种抗生素的耐药性逐步增加。有报道提出,四川省分离的467株大肠埃希氏菌对阿莫西林和氨苄西林等药物的耐药率超过90%,远高于2006年和2009年的报道6.6%~10.0%,高于2011年报道的51.4%[4],这说明四川省大肠埃希氏菌、沙门氏菌和肠球菌的耐药性也呈逐年增加趋势,细菌耐药问题不断恶化。
对动物源细菌耐药性进行连续监测,可以及时了解耐药性的发生和流行情况。虽然农业农村部已经对动物源细菌耐药性问题展开研究,但是局部地区对动物源细菌耐药性问题依然不够重视。本文旨在总结四川地区常见动物源细菌的耐药水平和耐药基因的传播特征,为省内继续开展耐药监测工作提供数据。
1 大肠埃希氏菌的耐药现状
大肠埃希氏菌(Escherichiacoli)俗称大肠杆菌,属于埃希氏菌属,是革兰氏阴性菌耐药性水平指示菌。大肠埃希氏菌是条件致病菌,部分致病性大肠埃希氏菌是引起细菌性食物中毒的常见病原菌[5]。大肠埃希氏菌不仅可引起消化系统感染,还能导致肠道外其他脏器感染。研究表明,四川地区动物源大肠埃希氏菌广泛被分离到,诸明欣[6]对四川阿坝州的牦牛源大肠埃希氏菌的分离率为19.17%(74/386);徐俊杰[7]等对四川遂宁市的鸭源大肠埃希氏菌的分离率为96.67%(29/30)。
养殖场在动物养殖过程中通过饲喂抗生素来达到促生长的作用,在选择压力下,耐药菌株不断出现。根据研究报道总结四川地区大肠埃希氏菌的耐药状况如表1所示,其中阿莫西林、复方新诺明等药物均出现耐药率为100%的情况,氨苄西林、四环素等耐药率也超过90%。其中对头孢噻肟、头孢曲松等药物的耐药率最低,这可能与禁止对动物使用第三代头孢类药物有关,但是动物源大肠埃希氏菌对第三代头孢类药物仍具有耐药性,这可能与β-内酰胺类抗生素的交叉耐药性有关。但就2006年至2018年而言,大肠埃希氏菌对不同抗菌药物的耐药率普遍上升。
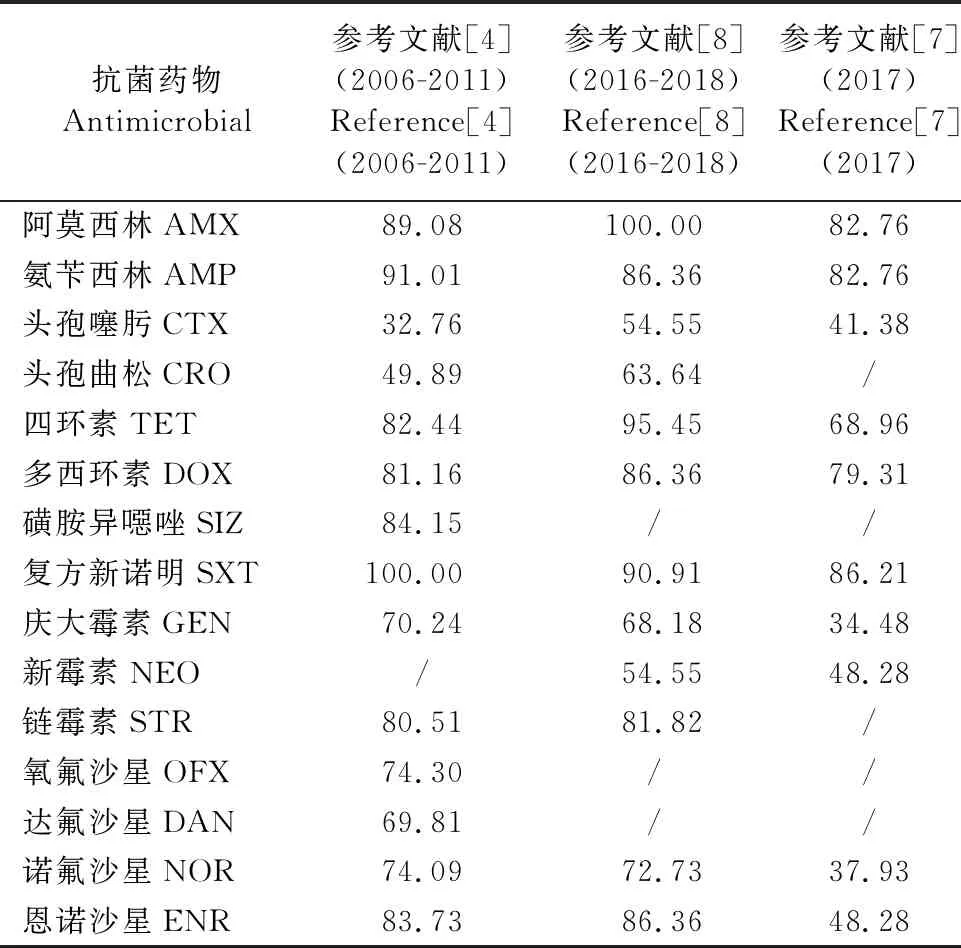
表1 四川省大肠埃希氏菌的耐药率状况
产β-内酰胺酶是大肠埃希氏菌重要的耐药表现之一,临床上常见的有超广谱β-内酰胺酶(ESBLs)、碳青霉烯酶和头孢菌素水解酶(AmpC)[9]。另外,近年来由于黏菌素大量使用,导致耐药性迅速增高,黏菌素耐药基因mcr除了mcr-1以外,已经发现了8个变异型mcr-2、mcr-3、mcr-4、mcr-5、mcr-6、mcr-7、mcr-8[10]和mcr-9。2018年Liu L等[11]通过PCR测序发现了一株人源携带blaNDM耐药基因的大肠埃希氏菌,与blaNDM-5相比,只有1个核苷酸差异(G205A),并命名为blaNDM-21。该基因具有与blaNDM-5相同的抗碳青霉烯类抗生素活性,还发现该耐药基因由IncX3类型质粒携带。2015年Kong L H等[12]从四川某猪场分离出105株大肠埃希氏菌,对其中耐药基因研究结果显示,16株同时携带blaNDM-5和mcr-1耐药基因。2010年-2016年杨承霖等[13]分离到444株大肠埃希氏菌,对其耐药基因的检测率分别为blaTEM-1(63.3%)、blaTEM-52(32.1%)、blaCTX-M-55(42.2%)、blaCTX-M-65(27.8%)、blaCTX-M-14(21.1%)。2019年Bai L等[14]从四川分离得到的23株猪源大肠埃希氏菌中分离到2株tet(X4)阳性菌,并通过MLST分析鉴定出两个属于ST101基因型的菌株。2016年-2018年彭珂楠等[8]分离到猪源大肠埃希氏菌22株,并对其耐药基因进行分析,结果发现sul2耐药基因的阳性率最高为95.54%,其次是tet(B)(四环素类)阳性率为86.36%、tet(A)(四环素类)阳性率为81.82%、floR(酰胺醇类)阳性率为81.82%,blaOXA(β内酰胺类)和blaSHV(β内酰胺类)耐药基因的阳性率最低,都是9.09%。2015年-2016年Chen D Y等[15]从四川省野生大熊猫的粪便样本中分离到82株大肠埃希氏菌,有40%的菌株表现为多重耐药,耐药基因检测结果显示strB耐药基因阳性率为32%,aph(3′)-IIa耐药基因阳性率28%,ant(3″)-Ia耐药基因的阳性率为23%,aadA1耐药基因的阳性率为21%。aac(3)-Iia耐药基因的阳性率为5%。综上所述,四川省大肠埃希氏菌中流行耐药基因较多,blaNDM、blaCTX、mcr-1等耐药基因,四环素tet(A)、tet(M)、tet(B)耐药基因,以及blaOXA、blaSHV、strB、aph(3′)-IIa等耐药基因都有被检出,其中部分耐药基因可通过质粒传播,对公共卫生安全具有潜在威胁。
2 沙门氏菌的耐药现状
沙门氏菌(Salmonella)属于肠杆菌科,具有多种血清型。按生化反应本属菌可分为4个亚属:①亚属Ⅰ是具典型生化反应的和最常见的沙门氏菌;②亚属Ⅲ是亚利桑那沙门氏菌;③亚属Ⅱ和Ⅳ是不具典型生化反应的沙门氏菌[16]。由于沙门氏菌有超过2 000种的血清型,对于沙门氏菌的防治较为复杂,每年沙门氏菌对养殖业造成的危害较大。据李晚霞等[17]研究,从四川邛崃、乐至、金堂、广汉、新津、眉山和彭州等7个地区的养鸡场可分离到沙门氏菌。杨丹等[18]对甘孜地区的藏鸡源沙门氏菌的分离率为21.43%(42/196),也同样说明沙门氏菌在四川地区的分布非常广泛。
沙门氏菌不仅是四川地区重要的动物源致病菌,也是食源性致病菌中重要的耐药性监测指标。从目前发表的论文来看,四川省不同年份不同株沙门氏菌的耐药率具有明显的差异。四川省沙门氏菌的耐药状况如表2所示,彭峻烽[19]从四川省肉鸭屠宰场分离得到156株沙门氏菌,其药敏试验结果显示,分离菌株对萘啶酸的耐药率最高,达到94.2%,对阿莫西林/克拉维酸和庆大霉素耐药率最低,只有14.7%和14.1%。其多重耐药性也相当严重,有63.5%的菌株对至少3种抗菌药物耐药。杨丹等[18]对藏鸡沙门氏菌进行耐药性分析,结果显示沙门氏菌对阿莫西林的耐药率超过90%,而对庆大霉素、氨苄西林的耐药率较低,此外该论文中97.62%的沙门氏菌表现为对4种以上抗菌药物耐药的多重耐药性。与之前的研究相比,Ma S等[20]研究结果的耐药率普遍较低,这可能与采样的随机性有关。
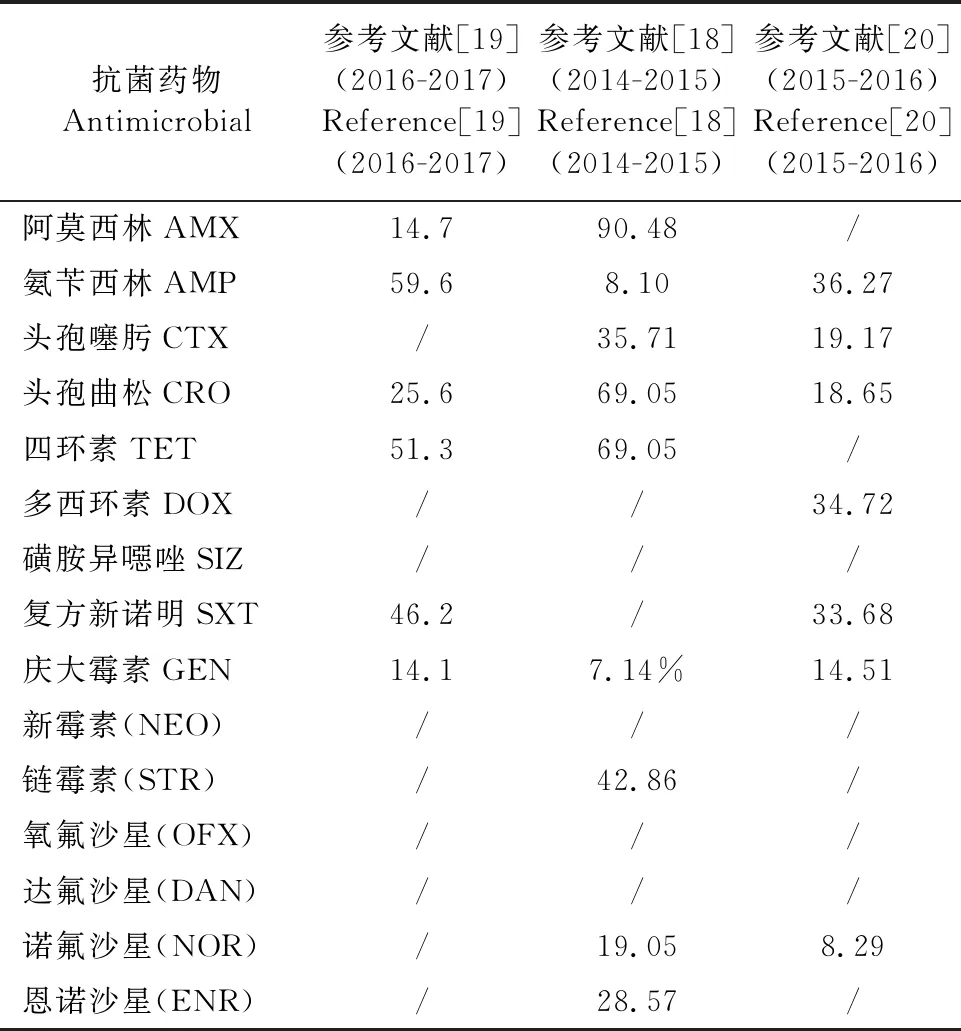
表2 四川省沙门氏菌的耐药率状况
近年来,随着沙门氏菌耐药性的不断增高,沙门氏菌已出现了由质粒介导的产β-内酰胺酶耐药基因。有研究发现IncN质粒中携带有blaCTX-M-1耐药基因[21],并且IncI1质粒可以和IncN质粒共同参与blaCTX-M-1耐药基因的转移。盛焕精等[22]发现,IncI1质粒阳性菌株比IncN质粒阳性菌株的耐药谱更宽,对头孢类抗生素的耐受水平更高;IncN质粒阳性菌株对氨基糖苷类抗生素的抗性相对更高。YANG Y Q等[23]通过分析病鸡中ESBLs阳性沙门氏菌中含有mcr-1和blaCTX-M-55基因的IncI2型接合质粒的全序列,发现mcr-1和blaCTX-M-55基因可共存于同一个质粒上,将该质粒提取出来,并对其基因文库进行测序,发现该质粒具有包含mcr-1和tnpA基因的ISApl1转座元件。Carroll L M等[24]在2019年首次报道了沙门氏菌中检测到新耐药基因mcr-9,发现mcr-9的基因序列与mcr-3和mcr-7最接近,但是却对黏菌素不产生耐药性,然而,将mcr-9导入大肠埃希氏菌DH5α后会对黏菌素产生耐药性。杨丹等[18]检测42株沙门氏菌的耐药基因,其中blaTEM(β内酰胺类)耐药基因阳性率最高(90.48%),其次是addA2(氨基糖苷类)和tet(A)(四环素类)耐药基因,阳性率分别是85.71%和83.33%。Li R等[25]对四川省食品动物源(鸡、猪和鸭)沙门氏菌的耐药基因分析结果显示,25株IntI1阳性沙门氏菌含有5组抗性基因,分别是dfrA12-aadA2、dfrA1-aadA1、dfrA1、blaPSE-1和dfrA1/aadA2。检测出β内酰胺酶基因分别为blaOXA-1、blaTEM-1、blaPSE-1和blaCMY-2,含β内酰胺酶基因菌株均对氨苄西林耐药,且blaCMY-2基因是国内首次报告,这对国内沙门氏菌病的治疗和公共卫生安全具有潜在影响。Ma S等[20]对四川省养殖场和屠宰场分离到的鸡源沙门氏菌、猪源沙门氏菌进行耐药基因分析显示,28株氨基糖苷类耐药菌株中,1株携带armA,27株携带rmtB,在70个氨苄西林耐药菌株中有57个存在blaTEM-1,在36个第3代头孢菌素耐药菌株中发现blaCTX-M-55、blaCTX-M-164、blaCTX-M-79、blaCTX-M-15、blaCTX-M-65和blaCTX-M-14,mcr-1存在于22株耐多黏菌素B菌株中,20株同时具有ESBLs基因。67株强力霉素耐药菌株中分别检测出tet(A)耐药基因49株和tet(M)耐药基因1株。冯兰等[26]从四川红原的牦牛粪便样本中分离到16株ST71沙门氏菌,这些菌株对氨苄西林、头孢噻呋、四环素和氯霉素的耐药率全部为100%。综上所述,四川省动物养殖中受沙门氏菌污染严重,且沙门氏菌携带多种重要耐药基因,这些耐药基因广泛传播并且可能存在人和动物之间的交叉传播,对公共卫生健康造成严重影响。
3 肠球菌的耐药现状
肠球菌属(Enterococcus)包括粪肠球菌(E.faecalis)、屎肠球菌(E.faecium)、鸟肠球菌(E.avium)、耐久肠球菌(E.durans)、鸡肠球菌(E.gallinarum)、酪黄肠球菌(E.casselipavus)和病臭肠球菌(E.malodoratus)等50多个种。肠球菌也被认为是世界范围内重要的临床病原体,且越来越多的耐药表型出现。在欧洲,9.8%的感染与肠球菌属有关,其中10.2%的分离株对万古霉素具有耐药性[27]。而四川省2015年-2018年从无菌体液分离得到的肠球菌中有2.2%(40株)是万古霉素耐药菌株[28]。肠球菌是革兰氏阳性菌的耐药性水平指示菌,肠球菌耐药性问题的日益严重,对全球范围内动物和人的健康具有潜在威胁。目前四川省对于人源肠球菌的报道较多,但是对于动物和食品源肠球菌的报道较少。目前已知的报道中,四川省动物源肠球菌感染猪较多,也有关于林麝等野生动物中分离肠球菌的报道。另外,郝中香等[29]从成都、雅安、平武和凉山地区的大熊猫繁殖基地中分离到11种肠球菌。
肠球菌产生耐药性的机制有很多,而获得性耐药基因的传播是肠球菌获得耐药性的重要途径。张平等[30]从四川某规模猪场中分离到50株肠球菌,MIC测定结果显示,50株菌的MIC50为32 μg/mL,MIC90为64 μg/mL,对于氟苯尼考的耐药率为68%。50株分离菌仅检测出fexA和fexB基因。该研究首次发现了325 bp的正向重复序列,由于其可形成环化结构的中间过渡态,从而以类似于质粒的方式在菌株间水平转移,大大促进了fexA基因水平传播的可能性。Yang J等[31]通过对尿液、分泌物和血样本进行检测,得到了43株耐万古霉素肠球菌,其耐药率为5.47%,并从中检测到了vanR、vanS、vanH、vanA、vanX、vanY和vanZ耐药基因。Kang Z Z等[32]从四川25个规模养猪场分离出的93株粪肠球菌和65株屎肠球菌进行研究,分别检测到可转移的噁唑烷酮耐药基因cfr(0株)、optrA(6株)、poxtA(1株)。所有菌株对氯霉素、氟苯尼考和红霉素耐药,对氨苄西林、万古霉素敏感,其中E.faecalisC25菌株含有2个optrA基因。张明国等[33]从198份健康奶牛粪便中分离到肠球菌105株,并做药敏试验,结果显示所有分离肠球菌对多西环素和红霉素耐药率最高,分别是50%和42.3%,没有分离到万古霉素耐药菌株。Cai J等[34]推测optrA突变、optrA的遗传环境、细菌宿主和其他因素可能调节optrA的表达,并导致不同程度的利奈唑胺类耐药。龚永平等[35]从四川省死亡林麝内脏中分离出1株屎肠球菌LS170308,并对其分离菌做药敏试验,结果显示屎肠球菌LS170308对四环素、庆大霉素、多西环素等13种药物具有耐药性,并发现该菌株携带PRI1和PRI4耐药基因岛。PRI1包括ant(9)、ermA和aac(6′)-le-aph(2″)-la耐药基因,PRI4携带dfrG耐药基因。综上所述,四川省动物源肠球菌耐药谱广,耐药基因复杂,多重耐药性较严重。
4 展望
大肠埃希氏菌、沙门氏菌和肠球菌均为动物源以及食源性重要的致病菌,对人和动物的健康都有巨大的威胁。根据现有的论文总结来看,四川省大肠埃希氏菌、沙门氏菌和肠球菌的耐药状况严重,耐药率普遍较高,对阿莫西林、四环素等一些常见抗生素耐药性最为严重,多数菌株呈现多重耐药性。此外,四川省大肠埃希氏菌、沙门氏菌和肠球菌携带多种对公共卫生安全具有重要威胁的耐药基因。四川省细菌耐药问题不容小觑,当地应督促养殖场在临床上规范使用抗生素,防止细菌耐药情况进一步恶化,出现“超级细菌”。目前国家已经开展了对动物源耐药细菌的监测,但省级层面监测力量仍不足。建议省级层面应将研究工作落实到各个地(市),并加强对大肠埃希氏菌、沙门氏菌和肠球菌耐药性的筛查和检测力度,深入研究其耐药基因和耐药表型。