乌鲁木齐市宠物源粪肠球菌和屎肠球菌耐药性及耐药基因检测
宋超慧,轩慧勇,吾买尔江·牙合甫,秦 蕾,徐琦琦,夏利宁
(新疆农业大学动物医学学院,新疆乌鲁木齐 830052)
肠球菌是革兰氏阳性球菌,可定殖于人和动物的肠道,属于机会致病菌。粪肠球菌和屎肠球菌是其主要种类[1],它们可引起人和动物的多种感染,而毒力基因和生物膜的形成,可增加肠球菌的致病性[2]。此外,肠球菌能引起犬、猫、食品动物继发感染[3-5]。由于临床上人和宠物经常使用相似的抗菌药物进行治疗,人与宠物的密切接触存在抗药性细菌转移的风险[6]。粪肠球菌经常被报道为致病性或潜在致病性细菌的抗药性基因贮藏库[7],在医院临床病例中分离得到的肠球菌多药耐药现象严重[8],对新型抗菌药物利奈唑胺的耐药性和耐药基因optrA的检出率呈上升趋势[9]。由于人和宠物的密切接触,了解宠物肠球菌的耐药情况及可能携带的相关耐药基因有助于评估细菌耐药性向人类传播的潜在风险。本文通过对新疆乌鲁木齐市宠物源粪肠球菌和屎肠球菌的耐药性及相关耐药基因流行情况调查,为宠物临床合理用药提供参考,以期减少耐药菌株的产生,同时也为宠物源肠球菌耐药性监测提供数据支持。
1 材料与方法
1.1 材料
1.1.1 菌株来源 2019年9月于新疆乌鲁木齐市宠物医院、警犬基地、犬养殖基地采集犬和/或猫的肛拭子样品449份,从中分离试验用粪肠球菌和屎肠球菌。
1.1.2 试剂与抗菌药物 BHI培养基、MH培养基、肠球菌选择培养基,奥博星生物技术有限公司(北京)产品;PCR反应体系试剂,天根生化科技有限公司(北京)产品;庆大霉素(gentamicin,GEN)、阿米卡星(amikacin,AMK)、恩诺沙星(enrofloxacin,EN)、环丙沙星(ciprofloxacin,CIP)、阿莫西林/克拉维酸(amoxicillin/Clavulanic Acid,A/C)、氨苄西林(ampicillin,AMP)、亚胺培南(imipenem,IPM)、四环素(tetracycline,TET)、万古霉素(vancomycin,VAN)、利奈唑胺(linezolid,LNZ)抗菌药物,上海源叶生物科技有限公司产品。
1.1.3 主要仪器设备 电热恒温培养箱(DG-70D),成都红星电燃厂产品;PCR扩增仪(YK1125511),Bio-Rad公司产品;核酸蛋白测定仪(Bio Photometer plus)、高速冷冻离心机(5415R),德国Eppendorf公司产品;电泳成套设备(DYY-6C),北京六一生物科技有限公司产品;凝胶成像系统(JS-780),上海培清科技有限公司产品。
1.1.4 引物 根据文献[10]已有序列合成屎肠球菌和粪肠球菌持家基因引物;根据文献[11-18]已有序列合成待检耐药基因引物,均由上海生工生物工程技术服务有限公司合成,引物序列见表1。

表1 引物序列及片段大小
1.2 方法
1.2.1 菌株分离 将采集的样品置于灭菌的65 g/L氯化钠BHI肉汤中,42℃、200 r/min培养18 h~24 h,用无菌一次性接种环蘸取菌液划线于肠球菌培养基平板上,37℃倒置培养18 h~24 h,平板表面呈白色圆滑、凸起、大小适中且菌落周围显黑色的单一菌落,可初步鉴定为肠球菌,挑取单菌落保存备用。菌落纯化后,进行肠球菌菌种鉴定。
1.2.2 菌种鉴定 通过水煮法提取细菌DNA模板,采用PCR方法对屎肠球菌和粪肠球菌持家基因进行扩增,扩增产物送测序。测序结果经BLAST序列比对,阳性菌株用灭菌的600 mL/L甘油保菌,置-20℃保存。
1.2.3 药敏试验 按美国临床实验室标准委员会(Clinical and laboratory standards institute,CLSI)推荐的琼脂稀释法进行,对分离鉴定出的粪肠球菌和屎肠球菌进行氨基糖苷类(庆大霉素、阿米卡星)、β-内酰胺类(阿莫西林/克拉维酸、氨苄西林)、喹诺酮类(恩诺沙星、环丙沙星)、四环素类(四环素)、碳青霉烯类(亚胺培南)、糖肽类(万古霉素)、噁唑烷酮类(利奈唑胺)共7大类10种抗菌药物的最小抑菌浓度(minimal inhibitory concentration,MIC)测定。标准质控菌株为金黄色葡萄球菌ATCC 29213、粪肠球菌ATCC 29212,药敏试验结果以敏感(S)、中介(I)、耐药(R)3种形式表示。
1.2.4 耐药基因检测 利用PCR和测序技术对肠球菌进行以下耐药基因检测,包括氨基糖苷类耐药基因aac(6′)/aph(2″)、aph(3′)-Ⅲ、ant(4′-4″);四环素类耐药基因tetA、tetC、tetM;β-内酰胺类耐药基因blaTEM、blaCTX-M;糖肽类耐药基因VanA、VanB;噁唑烷酮类耐药基因optrA。引物序列见表1。
2 结果
2.1 肠球菌分离鉴定结果
经分离鉴定出宠物源粪肠球菌和屎肠球菌共计123株(123/449,27.4%),其中粪肠球菌81株(81/123,65.9%),包括犬粪肠球菌73株(73/81,90.1%)和猫粪肠球菌8株(8/81,9.9%);屎肠球菌42株(42/123,34.1%),包括犬屎肠球菌35株(35/42,83.3%)和猫屎肠球菌7株(7/42,16.7%)。部分PCR鉴定结果见图1。

A.粪肠球菌基因扩增结果;B.屎肠球菌基因扩增结果M.DNA标准DL 2 000;+.阳性;-.阴性;1~5.试验菌株A.Amplification results of E.faecalis gene; B.Amplification results of E.faecium geneM.DNA Marker DL 2 000; +.Positive control; -.Negative control; 1-5.Tested strains
2.2 粪肠球菌与屎肠球菌的耐药结果
粪肠球菌与屎肠球菌耐药结果显示,粪肠球菌对被检药物中的5种有耐药菌株检出,对庆大霉素(51.9%)和四环素(81.5%)的耐药率较高,对其他被检抗菌药物的耐药率分布在2.5%~17.3%;屎肠球菌对被检药物中的6种有耐药菌株检出,对四环素耐药率较高(73.8%),而对其他被检抗菌药物的耐药率分布在7.1%~21.4%;整体而言,屎肠球菌的耐药情况较粪肠球菌稍严重,粪肠球菌与屎肠球菌对阿莫西林/克拉维酸、氨苄西林、万古霉素以及利奈唑胺高度敏感,结果详见表2。
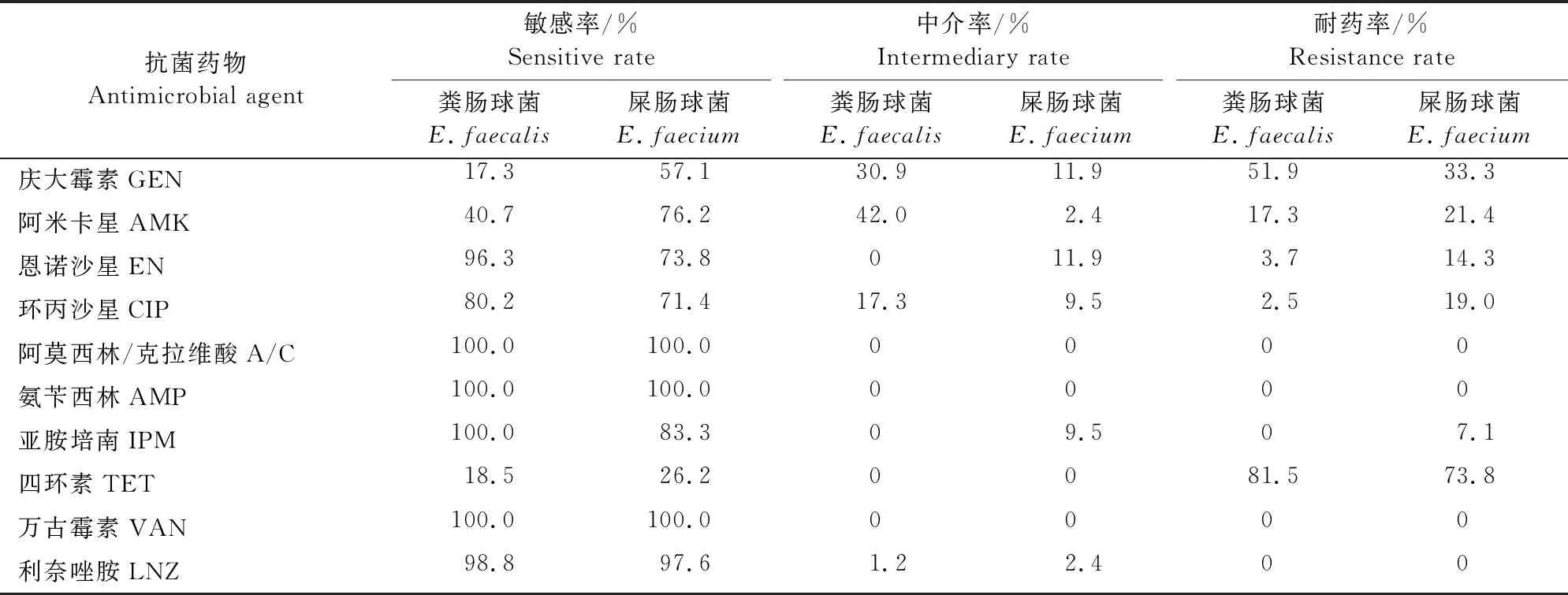
表2 粪肠球菌与屎肠球菌的耐药结果
2.3 粪肠球菌与屎肠球菌的多药耐药及耐药谱型结果
图2为粪肠球菌与屎肠球菌的多药耐药结果,屎肠球菌和粪肠球菌多药耐药主要分布在0~3耐,其中粪肠球菌以2耐最高,多药耐药率达35.8%;屎肠球菌以1耐最高,多药耐药率达40.5%,6耐分布有1株屎肠球菌。
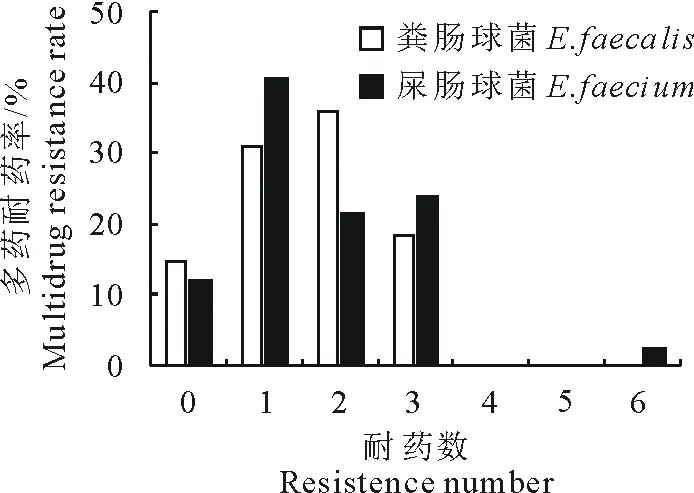
图2 粪肠球菌与屎肠球菌多药耐药结果
耐药谱型结果显示,123株肠球菌共检出14种耐药谱型。其中,粪肠球菌共有8种耐药谱型,以1耐、2耐和3耐谱型为主,1耐谱型中以GEN为主,占29.6%(24/81);2耐谱型中以GEN+TET为主,占33.3%(27/81);3耐谱型中以GEN+AMK+TET为主,占16.0%(13/81)。屎肠球菌共有13种耐药谱型,以1耐和3耐谱型为主,1耐谱型中以TET为主,占31.0%(13/42);3耐谱型中以GEN+AMK+TET为主,占16.7%(7/42)。1株6耐菌株的谱型为GEN+ENO+AMK+TET+IPM+CIP。
2.4 犬、猫源粪肠球菌与屎肠球菌的耐药性差异
结果详见表3。犬、猫源粪肠球菌与屎肠球菌对抗菌药物的耐药结果显示,犬源和猫源粪球菌耐药谱相同,均对10种被检药物中的5种药物耐药,对庆大霉素的耐药率均超过50%(犬:50.7%;猫:62.5%)、对四环素的耐药率均超过75.0%(犬:79.5%;猫:100%),且猫源粪肠球菌耐药率均高于犬源粪肠球菌;犬源屎肠球菌对恩诺沙星(17.1%)、环丙沙星(20.0%)和四环素(74.3%)的耐药率高于猫源屎肠球菌,猫源屎肠球菌对庆大霉素(57.1%)、阿米卡星(42.9%)和亚胺培南(14.3%)的耐药率高于犬源屎肠球菌;犬、猫源粪肠球菌对亚胺培南高度敏感,猫源屎肠球菌对恩诺沙星高度敏感,同时犬、猫源粪肠球菌和屎肠球菌对阿莫西林/克拉维酸、氨苄西林、万古霉素以及利奈唑胺也保持高度敏感,无耐药菌株检出。
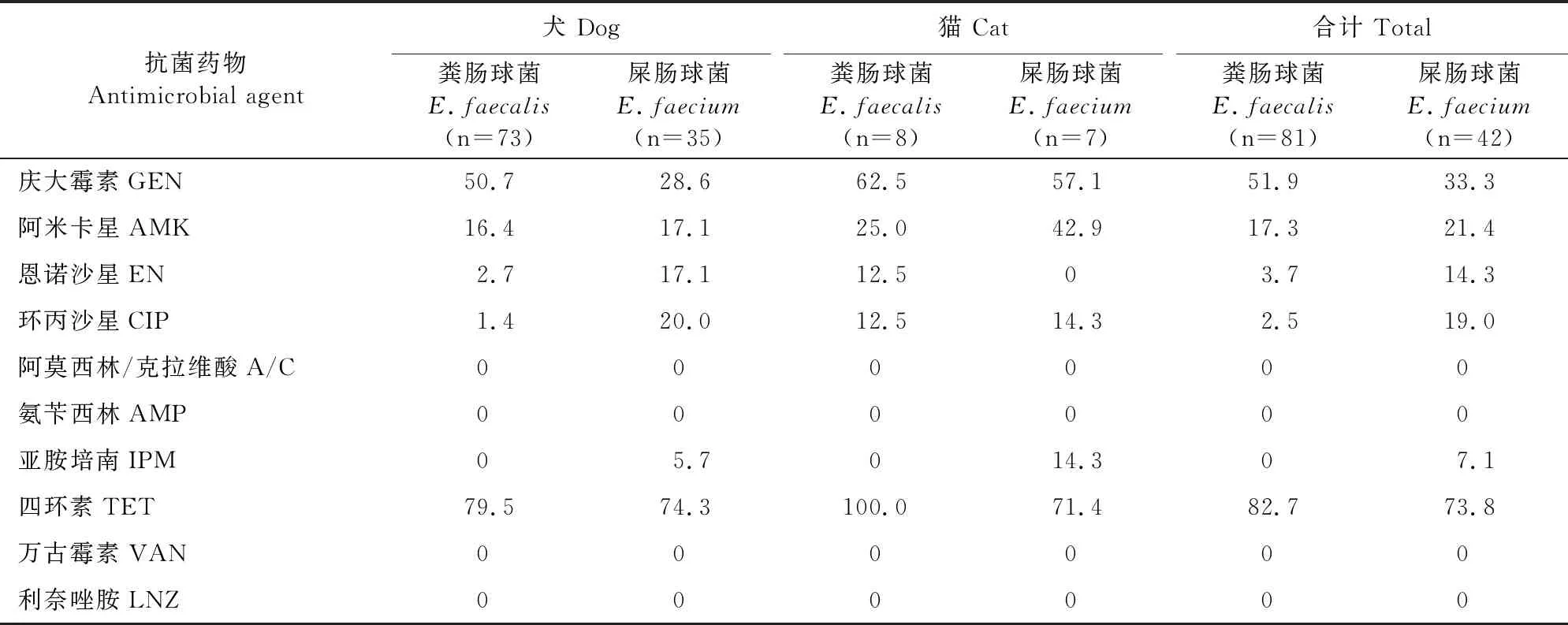
表3 犬、猫源粪肠球菌与屎肠球菌耐药率
2.5 犬、猫源粪肠球菌与屎肠球菌的多药耐药及耐药谱型结果
图3为犬、猫源粪肠球菌与屎肠球菌的多药耐药结果,多药耐药结果主要分布在0~3耐。犬粪肠球菌和屎肠球菌以1耐、2耐为主,猫粪肠球菌和屎肠球菌以2耐和3耐为主;其中1耐分布的犬粪肠球菌(31.5%)和屎肠球菌(41.9%)均高于猫粪肠球菌(25.0%)和屎肠球菌(28.6%);2耐分布的猫粪肠球菌(37.5%)略高于犬粪肠球菌(35.6%),未检出2耐猫屎肠球菌;3耐分布的猫粪肠球菌(37.5%)和屎肠球菌(57.1%)均高于犬粪肠球菌(16.4%)和屎肠球菌(17.1%);6耐分布1株犬屎肠球菌。
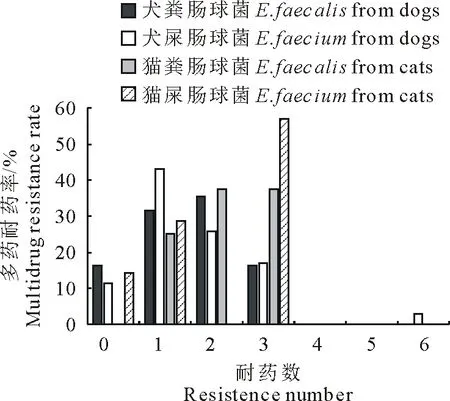
图3 犬、猫源粪肠球菌和屎肠球菌多药耐药结果
耐药谱型结果显示犬粪肠球菌共有7种耐药谱型,以1耐、2耐和3耐谱型为主,1耐谱型中以TET为主,占30.1%(22/73),2耐谱型中以GEN+TET为主,占32.9%(24/73),3耐谱型中以GEN+AMK+TET为主,占15.1%(11/73);犬屎肠球菌共有10种耐药谱型,以1耐分布最多,1耐谱型中以TET为主,占34.3%(12/35)。猫粪肠球菌共检出4种耐药谱型,以2耐为主,占37.5%(3/8),2耐谱型中以GEN+TET为主;猫屎肠球菌共检出4种耐药谱型,以3耐为主,占42.9%(3/7),3耐谱型中以GEN+AMK+TET为主;1株6耐菌株为犬屎肠球菌。
2.6 犬、猫源粪肠球菌与屎肠球菌耐药基因的检测结果
检测结果详见表4。对不同来源耐药粪肠球菌与耐药屎肠球菌进行11种耐药基因的检测结果显示,犬、猫粪肠球菌和屎肠球菌检出的氨基糖苷类耐药基因均以aac(6′)/aph(2″)和aph(3′)-Ⅲ为主;四环素耐药基因以tetM为主,tetA基因仅在犬粪肠球菌(1.4%)和屎肠球菌(2.9%)中检出;犬粪肠球菌和屎肠球菌检出噁唑烷酮类耐药基因optrA,检出率分别为2.7%和8.6%。耐药基因ant(4′-4″)、tetC、blaTEM、blaCTX-M、VanA、VanB未检出。
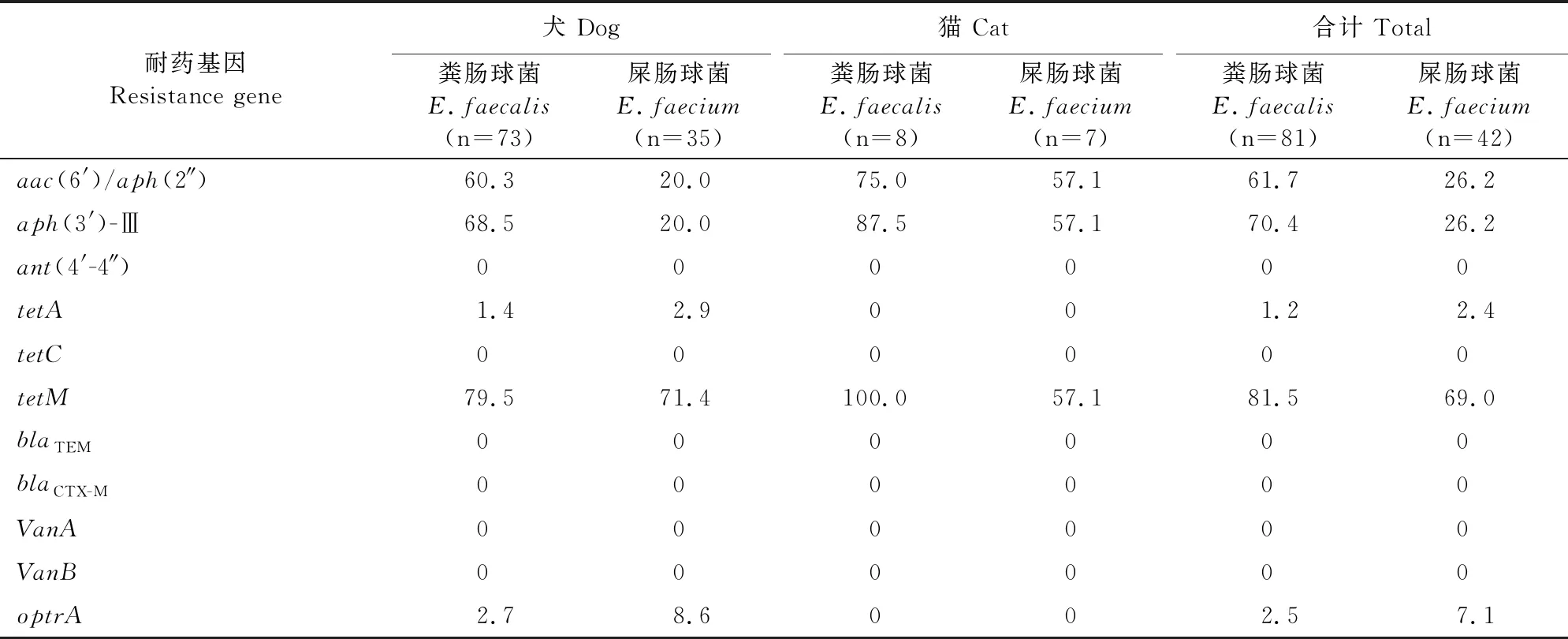
表4 犬、猫源粪肠球菌与屎肠球菌耐药基因检出率
3 讨论
肠球菌由于自身细胞壁坚厚,对许多抗菌药物表现为固有耐药[19-20],如对青霉素类、头孢菌素类、低浓度氨基糖苷类、红霉素和复方新诺明。通过突变株的发生、质粒交换以及转座子编码的耐药基因,肠球菌对许多抗菌药物产生获得性耐药,如高水平耐β-内酰胺类、氨基糖苷类、糖肽类、四环素、红霉素。由于肠球菌存在于人和动物肠道以及自然环境,耐药株的存在可增强其耐药性在三者之间传播的风险。人与宠物可以密切接触,更应加强肠球菌耐药性监测,评估细菌耐药性向人类传播的潜在风险,避免危害公众健康事件的发生。
分离鉴定出的宠物源粪肠球菌和屎肠球菌,对被检抗菌药物表现出不同程度的耐药。宠物源粪肠球菌和屎肠球菌对四环素耐药率较高,对喹诺酮类药物恩诺沙星、环丙沙星耐药率较低,且屎肠球菌的耐药率略高于粪肠球菌,这与国内外部分报道结果一致[6,21-22]。对庆大霉素产生耐药性的肠球菌菌株应引起重视,避免产生对庆大霉素高水平耐药的肠球菌,因为它会导致氨基糖苷类和β-内酰胺类或糖肽抗生素的协同杀菌作用丧失[23]。宠物源肠球菌对阿莫西林/克拉维酸、氨苄西林、万古霉素完全敏感,对亚胺培南高度敏感,这与Rodrigues J L等[1]研究结果一致,未发现噁唑烷酮类耐药菌株。据Van Den Bunt G等[24]所述,今后应继续监测宠物源肠球菌的耐药性,避免耐氨苄青霉素的屎肠球菌和耐万古霉素的菌株产生。犬、猫源肠球菌的耐药率存在不同,可能与样品采集动物的种类、年龄、体重、性别及健康状况的差异有关,即使同为犬或猫,机体对不同药物的吸收和排泄也存在差异,导致用同一种药物治疗后结果不同[25]。虽然肠球菌具有宿主特异性,但Jackson C R等[26]发现,部分犬、猫源肠球菌具有非常相似的PFGE模式,肠球菌菌株包含多种耐药基因组合且遗传关系密切,有可能在犬和猫之间交换。此外,在健康的犬和猫源肠球菌中发现携带在人源肠球菌中检出的抗性基因,Jackson C R等认为健康的犬、猫源肠球菌可能是抗菌药物耐药基因的储存库,存在从宠物转移到人和环境中的风险。因此,宠物临床应正确选择抗菌药物,合理用药。
根据耐药基因检测结果发现猫源肠球菌携带的耐药基因型较少,以同时携带aac(6′)/aph(2″)+aph(3′)-Ⅲ+tetM耐药基因为主。犬源肠球菌耐药基因型多,犬源粪肠球菌以同时携带aac(6′)/aph(2″)+aph(3′)-Ⅲ+tetM耐药基因为主;犬屎肠球菌以携带tetM耐药基因为主,与Jackson C R等[26]报道的美国犬、猫中检测出的部分耐药基因结果相同。宠物源肠球菌耐药基因型与耐药表型基本保持一致,利奈唑胺作为一种新型抗菌药物,是目前公认为治疗革兰氏阳性菌最有效的药物,但在本研究中对该药表现为中介的犬源肠球菌菌株中检出携带optrA基因,这提示optrA基因有加速细菌耐药性的风险,应加强监测避免耐药菌株的产生和其在人与宠物之间传播的可能;部分耐药菌株未检出耐药基因,如对亚胺培南耐药的菌株未检出耐药基因,分析耐药株的产生可能还与毒力基因有一定关系,Rathnayake I U等[27]在比较临床和环境中分离得到的粪肠球菌和屎肠球菌的毒力和抗生素耐药性关系时发现,带有毒力基因的粪肠球菌和屎肠球菌分离株也都含有抗生素抗性决定簇,毒力基因的存在与抗生素抗性之间显著相关。而关于携带毒力基因与耐药表型之间的关系还需继续研究。
综上所述,新疆乌鲁木齐市宠物源粪肠球菌与屎肠球菌存在不同程度的耐药现象,且粪肠球菌与屎肠球菌耐药性存在不同;菌株对四环素类药物耐药最为严重且相关耐药基因检出率最高,耐药基因型丰富。故在宠物临床治疗中,建议根据耐药性结果进行合理用药,持续加强对宠物源肠球菌耐药性监测。