结膜支原体研究进展
郭秉鑫,杨发龙,刀筱芳
(西南民族大学畜牧兽医学院,四川成都 610041)
结膜支原体(Mycoplasmaconjunctivae,Mco)属柔膜体纲支原体目支原体科支原体属,是引起羊传染性角膜结膜炎(Infectious keratoconjunctivitis,IKC) 最主要的病原。该病原最早于1968年由Surman在澳大利亚从患病绵羊眼部分离出来,并由Barile M F等[1]于1972年对其进行描述并命名。IKC俗称“红眼病”,以结膜和角膜发炎并伴有大量流泪为特征。在该病早期阶段,病畜表现为单侧或双侧的结膜炎及血管充血,随着病情的发展会产生黏膜胶质性结膜炎和角膜溃疡,在疾病最晚期,角膜混浊甚至穿孔。IKC对圈养绵羊和山羊的危害较小,但对放养和野生动物危害较大。野外情况下,动物感染失明后找不到充足的食物,造成消瘦、营养不良,甚至会从悬崖跌落,这也是IKC死亡率可以达到30%的原因[2]。家养羊群中,IKC虽然不易直接导致死亡,但由于影响患病羊的采食而导致其生长缓慢和掉膘,降低生产性能,给养殖业带来经济损失。
结膜支原体作为IKC的主要病原,为了有效对该病进行防控,近年来国内外学者对其生物学特性、诊断技术及传播机制等进行了一系列的研究。本文对结膜支原体的相关研究进行了综述,旨在总结国内外对该病原的研究现状,以促进对IKC的有效防治。
1 结膜支原体与IKC发生的相关性
首次报道的IKC暴发于1916年奥地利阿尔卑斯山的岩羚羊中[2],此后相继在家养的绵羊、山羊及欧洲盘羊等羊亚科中均有报道。针对IKC的病原,起初存在较大的争议,包括羊属布兰汉氏菌、鹦鹉热衣原体、结膜立克次体和金黄色葡萄球菌等都曾被认为是引起IKC的病原体。早在1994年,Dagnall G J R[3]就将羊属布兰汉氏菌、结膜支原体和鹦鹉热衣原体同时接种羔羊,从而复制结膜炎病例,结果发现受感染羊角膜结膜炎的严重程度与结膜支原体有关,在表现出轻度结膜炎症状的动物中不能再分离出鹦鹉热衣原体。Giacometti M等[4]对3只阿尔卑斯野山羊接种了从绵羊中分离出来的结膜支原体后引起了结膜炎的发生,并且第4只未进行人工感染的野山羊也因接触感染动物而发生了相同的以浆液性至黏液性泪液为特征的结膜炎症状,且从感染动物中仅能检测到结膜支原体,而没有发现鹦鹉热衣原体和绵羊布兰汉氏菌等其他可能导致结膜炎或角膜炎的病原体。Motha M X等[5]在对新西兰5个发生严重IKC的羊群进行调查的结果显示,3/5的病畜用PCR方法能检测出结膜支原体DNA,所有病畜血清中均能检出结膜支原体抗体,仅从1只患病绵羊的结膜拭子中分离出1株绵羊布兰汉氏菌(Branhamellaovis)。此外,Fernández-Aguilar X等[6]通过qPCR对巴基斯坦绵羊和山羊的眼拭子进行检测的结果显示,无论在绵羊还是山羊中,结膜支原体的检出率均明显大于衣原体,并且发现衣原体只有与结膜支原体混合感染时才引起IKC相关症状。在2017年,Hsu P C等[7]报道了一起在我国台湾地区奶山羊养殖场内暴发传染性角膜结膜炎的病例,并通过PCR检测发现其病原为结膜支原体。因此,上述这些研究均表明结膜支原体是引起家养绵羊和山羊、岩羚羊、野山羊和其他羊亚科感染IKC的主要病原体。
该病原目前在全球范围内广泛流行,包括瑞士[8]、芬兰[9]、新西兰[5]、西班牙[10]和巴基斯坦[6]等国家都报道了因结膜支原体感染绵羊、山羊、阿尔卑斯岩羚羊以及欧洲盘羊等羊亚科并引起IKC的病例。最近,有学者发现挪威的一个麝牛种群也暴发了角膜结膜炎,并通过对其眼拭子样本进行DNA序列分析发现其病原为结膜支原体。这说明结膜支原体不仅仅感染绵羊和山羊等羊亚科动物,也可能感染其他反刍动物[11]。
在我国,山羊和绵羊中IKC流行广泛,除上述Hsu P S等[7]在我国台湾省奶山羊感染结膜支原体导致IKC发生的报道外,在重庆、广西、海南、青海等地均有暴发IKC的病例[12-15],并发现该病虽然对羊群的直接致死率偏低,但传播速度较快,如不进行及时的控制,会在短时间内向整个羊群传播蔓延,从而给羊养殖业带来巨大的经济损失。然而,我国针对IKC的相关研究仍然十分有限,多数仅从流行病学、临床症状、病理变化等进行了初步的诊断,而对其进行病原分离和鉴定报道甚少,也缺乏我国结膜炎支原体病原特征的相关研究。但我国相关学者提出了许多中医治疗、西医治疗及中西医结合治疗羊IKC的方法,具有一定的效果[12,16-17]。
2 病原分子生物学特征
支原体在系统发育上与革兰氏阳性梭菌密切相关,是能自我复制和自主生活的最小的原核生物,基因组在0.6 Mbp~1.3 Mbp之间。由于其有限的遗传信息,仅表达少量的细胞蛋白,缺乏许多活性酶和代谢途径[2]。Pettersson B等[18]基于16S rRNA基因对结膜支原体的系统发育进行分析,结果显示其与牛眼支原体(M.bovoculi)具有最近的亲缘关系,同时和绵羊肺炎支原体(M.ovipneumoniae)及猪肺炎支原体(M.hyopneumoniae)等共处于一个大的分支。为了进一步了解结膜支原体分子生物学特性,Calderon-Copete S P等[19]对结膜支原体全基因组进行测序、注释及分析,发现结膜支原体基因组是由1条染色体组成,大小约为0.9 Mbp,G+C含量为29%,共编码734个基因。其中699个被预测为蛋白质的编码序列,其中49%的基因的功能已知,5.6%的基因被注释为“假定蛋白”,在剩下的45%的基因中,有25%则被认为是结膜支原体所特有的。
黏附素在支原体的致病过程中起着核心作用,其介导支原体对宿主细胞的黏附、定植和进一步致病[20]。目前,发现2个结膜支原体的重要黏附素分子,即富含丝氨酸的脂蛋白S(lipoprotein S,LppS)和脂蛋白T(lipoprotein T,LppT)。Belloy L等[21]对lppS进行基因克隆和序列分析表明,该基因编码一种前体膜蛋白。成熟的LppS蛋白表观分子质量为150 ku,具有一个富含丝氨酸的结构域,由41个氨基酸组成,其中有37个(90.2%)是丝氨酸残基,并且这些残基中有27个是连续的。体外黏附试验表明,该蛋白能黏附在羔羊关节滑膜细胞上,针对LppS的特异性IgG的Fab片段可抑制结膜支原体对细胞的黏附作用。
LppT和LppS是由一个操纵子编码,为一个由947个氨基酸组成的膜蛋白,分子质量为105 ku。在其氨基末端有一个由34个氨基酸构成的信号肽序列,随后是两个跨膜结构,与猪肺炎支原体的膜蛋白p76和p110有明显的相似性。lppT基因缺乏启动子,而是与lppS共转录,这提示LppS与LppT两者的功能密切相关[21]。2010年,Zimmermann L等[22]在对LppT的研究中发现,LppT中的RGD(Arg-Gly-Asp)基序是结膜支原体与宿主细胞结合的特异性位点,在结膜支原体的黏附作用中起着至关重要的作用,抗LppT 的IgG Fab片段同样能阻断结膜支原体对细胞的黏附过程。研究还发现,采用针对LppS或LppT特异性IgG的Fab片段,阻断其中一种蛋白,会导致LppS-LppT介导的黏附功能失活。这与猪肺炎支原体232菌株的蛋白p146和mhp683之间的关系类似,而这两个蛋白也同样由一个操纵子编码[20]。说明结膜支原体的LppS和LppT在其黏附宿主细胞的过程至关重要且协同发挥作用。
3 感染和致病机制
相关研究表明,结膜支原体引起IKC的严重程度与眼中结膜支原体的数量有关,与衣原体等其他病原体的混合感染也可能会加剧临床症状,动物怀孕和寒冷的天气等因素也可能是影响IKC严重程度的重要因素[5]。就传播途径而言,通常认为结膜支原体主要通过直接接触传播,而苍蝇等也可能起到间接传播的作用[2,23]。虽然其主要存在于感染动物的眼部,而Aguilar X F等[23]通过qPCR的方法,在羊的鼻拭子和耳拭子中也检测到了结膜支原体DNA,说明结膜支原体可能存在其他的传播机制。
目前,针对结膜支原体的致病机制研究甚少。一般而言,支原体由于缺乏细胞壁,其致病机制与大多数致病性细菌有着很大的差异。其一般不产生毒素、溶细胞素及侵袭素等典型的毒力因子,主要是通过黏附素附着于宿主细胞表面,并通过有毒中间代谢产物对宿主细胞造成损伤[24]。由于LppS和LppT具有介导结膜支原体黏附的作用,在结膜支原体的致病性中起着至关重要的作用[21-22],是目前已知的两个重要的毒力因子。
研究表明,甘油的摄取及代谢过程与支原体的毒力密切相关[25],也是目前较为明确的支原体致病机制之一。在该机制中,支原体黏附于宿主细胞后,摄取甘油并氧化的过程中所形成的副产物H2O2可直接对宿主细胞产生毒害作用,造成细胞损伤和产生炎症(图1)。
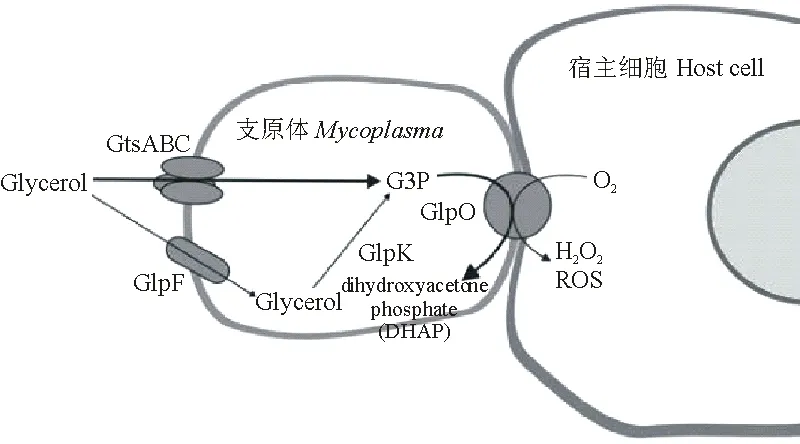
图1 支原体甘油代谢途经[26]
该途径始于细胞膜上ABC转运系统(Sn-glycerol-3-phosphate transport system permease)对甘油的吸收,然后甘油被磷酸化为3-磷酸甘油(glycerol-3-phosphate,G3P),或者由丙三醇吸收促进蛋白(glycerol uptake facilitator protein,GlpF)摄入甘油,并由丙三醇激酶(glycerol kinase facilitator protein,GlpK)磷酸化为G3P,随后G3P在O2存在下被3-磷酸甘油脱氢酶(glycerol-3-phosphate dehydrogenase,GlpO)氧化为磷酸二羟丙酮(dihydroxyacetone phosphate,DHAP),并生成分子H2O2,而H2O2通过GlpO跨膜蛋白直接释放到宿主细胞内,导致细胞死亡[24,26]。Calderon-Copete S P等[19]对5种支原体基因组序列的蛋白质功能进行分类并对比,发现结膜支原体中碳水化合物和运输代谢明显偏低,这提示结膜支原体具有强大的甘油代谢途径。通过对结膜支原体基因组进行分析,发现其同样具有GlpO、GlpK、GlpF和ABC转运系统,说明结膜支原体拥有上述代谢途径。此外,Calderon-Copete S P等[19]还发现结膜支原体中有3种与猪痢短螺旋体(Brachyspirahyodysenteriea)毒素高度相似的蛋白,分别是溶血素A(hemolysin A,HlyA)、溶血素B(hemolysin B,HlyB)和溶血素C(hemolysin C,HlyC),虽然这些蛋白在其他的支原体中不是致病所必须的,但不排除这些毒素与结膜支原体的致病性有关。
4 结膜支原体检测方法
4.1 病原分离培养
对病原进行分离培养是诊断支原体感染的经典方法,也可以认为是“金标准”。不同支原体所需要的营养条件也具有一定差异,因而选择合适的培养基对支原体的培养显得尤为重要。目前,结膜支原体的培养通常在含有200 mL/L马血清、25 g/L酵母膏和10 g/L的葡萄糖的标准支原体PPLO肉汤培养基中进行,可加入酚红指示剂以便观察颜色以及青霉素和醋酸铊作为抗菌剂[7-8]。除此之外,改良的Hayflick培养基和Eaton培养基也可以很好地培养结膜支原体[1,5]。虽然很多学者采用分离培养的方法对结膜支原体进行了鉴定,但该方法易受到细菌等其他微生物的污染,分离难度较大,成功率很低,且病原体的培养过程很繁琐,生长周期长,营养条件要求高,需要实验人员具备专业的技术经验。特别是在一些养殖场中由于大环内酯类、四环素类和喹诺酮类等抗生素的大量使用,会抑制其体外生长,也是不能成功分离出结膜支原体的重要原因之一[5]。此外,即使分离和培养成功后,仍需要用其他方法对其进行鉴定。因此,病原分离培养的方法并不适用于临床上结膜支原体感染的及时诊断。
4.2 血清学方法
血清学方法作为一种传统的诊断技术,具有简便、快捷、特异性强、灵敏度高等优点,而酶联免疫吸附试验、间接血凝试验、间接免疫荧光试验和补体结合试验等方法已被学者广泛用于支原体的检测[27]。相比于其他支原体,用于结膜支原体诊断的血清学方法报道甚少。2011年,Belloy L等[28]分析了绵羊中结膜支原体和绵羊肺炎支原体之间的血清学交叉反应,发现产生交叉反应主要归因于42 ku和83 ku的两种强抗原蛋白,并利用Tween-20提取了结膜支原体HRC/581T菌株的膜蛋白作为特异性抗原,建立了间接酶联免疫吸附试验方法,用于鉴定绵羊群体中的结膜支原体。次年,Giacometti M等[8]也基于Belloy L等[28]的方法,建立了用于检测阿尔卑斯山岩羚羊血清中特异性结膜支原体抗体的间接ELISA方法。但由于感染羊的支原体种类较多,且相关支原体之间抗原的相似性很高,会导致强烈的血清学交叉反应,往往会影响诊断的准确性[28]。同时,血清学方法主要是检测感染抗体,无法直接反映动物的感染状况,因此是一种间接诊断方法,需要结合临床症状等进行综合判断。
4.3 分子生物学方法
分子生物学检测具有快速、敏感、特异性强等优点。针对结膜支原体,已建立了普通PCR、套式PCR及实时荧光定量PCR等多种特异性分子检测方法。1999年,Giacometti M等[29]基于结膜支原体rrs基因(16s rRNA)的独特序列,设计了一对特异性引物McoR1和McoF1,建立了鉴定结膜支原体的普通PCR,该方法成功鉴定出来自不同国家的山羊、绵羊、野山羊及岩羚羊源的结膜支原体分离株,而对其他支原体扩增具有很高的特异性。随后发现这种普通PCR虽然能用于结膜支原体的快速、特异的鉴定,但该方法的灵敏度不高,仅能用于对结膜支原体分离株培养物的鉴定。对此,又建立了一种套式PCR,首先用一对支原体属通用引物MOLIGEN1-L和16UNI-R进行第一步扩增,然后再利用结膜支原体特异性引物McoR1和McoF1进行第二步扩增。通过比较发现,套式PCR与直接分离培养的检测结果相当,灵敏度却远高于普通PCR,是普通PCR的104倍,并且可以直接用于临床样本的检测。但这种方法的缺点是需要对样本进行两轮PCR扩增,相对较为耗时,并且在对大量样本进行检测时,由于需要对第一轮扩增产物进行操作,增加了样本间相互污染的可能性。
实时荧光定量PCR是指在PCR体系中加入荧光基团,利用荧光信号对反应过程进行实时监测,并可实现定量分析。常用的定量PCR方法有SYBR GreenⅠ染料法和TaqMan探针法。2007年,Vilei E M等[30]针对结膜支原体lppS基因5′末端设计了TaqMan荧光探针,成功建立了TaqMan探针实时荧光定量PCR方法,并且通过与套式PCR进行对比,发现其具有更高的灵敏性。虽然TaqMan探针实时荧光定量PCR方法相比其他鉴定方法显示出了更高的准确性,但由于其需要合成探针,成本相对较高,且需要有价格昂贵的荧光定量PCR仪,因此在基层实验室的应用受到较大的限制。
因此,针对结膜支原体的检测,仍有必要建立更为方便、简单或快速的新型分子检测方法。
5 疫苗
目前,尚未见到针对结膜支原体疫苗研究的报道。但如前所述,学者们已经鉴定出LppS、LppT等与结膜支原体黏附作用有关的膜表面脂蛋白,并发现其具有很强的免疫原性,以及溶血素A、溶血素B和溶血素C等3种与猪痢短螺旋体毒素高度相似的蛋白[19,21-22]。这些与感染和致病相关的蛋白可作为候选抗原用于今后的疫苗研究中,可研制针对基于上述蛋白的重组亚单位疫苗或基因载体疫苗等,用于IKC的预防。
6 结语
结膜支原体是引起羊亚科传染性角膜结膜炎的主要病原体,会严重影响羊群的健康。虽然该病原在世界范围内流行,但与其他重要的动物病原性支原体相比,对结膜支原体的研究明显滞后,特别是对其病原分子生物学特征了解甚少,对重要毒力因子和免疫原的结构和功能缺乏了解,从而为进一步阐明其感染和致病机制造成障碍,也不利于疫苗研制。此外,虽然目前也建立了一些针对该病原的血清学和分子生物学方法,但仍存在特异性不强、耗时费力等不足,因此,建立重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)及恒温隔绝式荧光PCR(insulated isothermal PCR,iiPCR) 等方便、快速的新型核酸检测技术,对于结膜支原体的检测和其感染的诊断具有重要的意义。
疫苗免疫接种是预防传染病最为有效的手段之一,目前尚无任何针对结膜炎支原体的灭活苗、弱毒苗及亚单位疫苗的报道。因此,在了解其生物学特征和保护性抗原的基础上,进行疫苗创制应是未来该病原研究的重要课题。