小鼠孤雌激活胚胎早期发育过程中胞吞作用相关蛋白的动态表达分析
许瑞华,周应聪,孙 莹,王 萌,芮 弦,王靖雷,马 睿,余四九,潘阳阳*
(1.甘肃农业大学动物医学院,甘肃兰州 730070;2.中牧实业股份有限公司兰州生物药厂,甘肃兰州 730046)
窖蛋白是分子质量为17 ku~24 ku的整合膜蛋白,具有参与胞膜窖形成、细胞内吞等生物学功能,是胞膜窖区别于其他脂筏结构的特征性分子[1-2]。胞吞是细胞与外界进行物质交换的途径之一,其通过胞膜窖完成这一生理程序[3]。而胞吞作用相关蛋白窖蛋白1(caveolin-1,Cav1)、窖蛋白2(caveolin-2,Cav2)和窖蛋白3(caveolin-3,Cav3)通过不同的信号转导通路,与多种信号分子之间相互作用[4-5],进而控制跨膜信号转导,从而产生一系列生理效应[6],其动态变化势必影响着胚胎的发育质量。由此可见,研究哺乳动物卵母细胞的激活及发育过程中胞吞作用相关蛋白的动态表达分析,对动物和人类辅助繁殖技术以及在信号转导、胆固醇运输、细胞内化等方面有着重要的意义[7]。
哺乳动物的生理调控过程中,Caveolin基因家族的3个成员(Cav-1、2、3),通过选择性剪切编码了6种窖蛋白,即Cav-1(1α、1β共2种亚型)、Cav-2(2α、2β、2γ共3种亚型)和Cav-3[8-10]。Cav1和Cav2是两种细胞表面的穴样内陷中的主要膜内在蛋白[11-13],它们作为胞膜窖的主要成分参与了生理及病理条件下的胞吞作用、信号转导、细胞生长的调控及细胞凋亡等其他功能[14]。Cav1参与在胚胎发育过程中发挥着重要作用的骨形态发生蛋白信号通路和Cripto-1信号通路,且已有的对Cav1作用的研究发现,Cav1在信号转导和体内稳态中也起着重要作用[15-16]。Cav2参与细胞的重要功能,并可在许多细胞上调节胞膜窖的数量[17-18]。
本研究旨在探索哺乳动物孤雌激活胚胎早期发育过程中胞吞作用的调控机制及其对胚胎发育质量的影响。研究工作以小鼠孤雌激活胚胎为模型,从基因和蛋白水平检测孤雌激活胚胎发育各时期胞吞作用相关蛋白的表达水平和动态分布,探明胞吞作用相关蛋白在小鼠孤雌激活胚胎附植前发育的调控机制,为进一步研究提高早期胚胎发育能力、成活率和试管动物技术提供研究基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级昆明小鼠,均为雌性,4周龄~5周龄,购自中国农业科学院兰州兽研所动物中心。饲养于提前准备好的鼠房中,温度20℃~26℃,相对湿度40%~70%,自由采食、饮水,昼夜明暗交替时间12/12。
1.1.2 主要试剂 G1/G2联合培养液,Vitrolife公司产品;胎牛血清(Fetal Bovine Serum,FBS),Gibco公司产品;KSOM培养液,国产分析纯试剂配制;Srcl2、细胞松弛素B(cytochalasin B,CB)、磷酸缓冲盐溶液(phosphate-buffered saline,PBS)、透明质酸酶,Sigma公司产品;微量RNA提取试剂盒,Omega公司产品;两步法反转录试剂盒,Promega公司产品;SYBR Green Ⅱ荧光定量PCR 试剂盒,宝生物工程(大连)有限公司产品;免疫荧光检测、蛋白免疫印迹所用试剂,南京碧云天生物公司产品;蛋白免疫印迹所用抗体,博奥森公司(北京)产品。
1.1.3 主要仪器设备 PCR仪(T100TMThermal Cycler),Bio-Rad公司产品;超净工作台(CBV-1500A),上海瑞仰净化装备有限公司产品;细胞培养箱,Thermo公司产品;体式显微镜 (BX51-DP71)、荧光倒置相差显微镜(BX51-DP71),Olympus公司产品;低温离心机 (Centrifuge 5417R),Eppendorf公司产品;SDS-PAGE凝胶电泳槽、转膜仪,美国Bio-Rad公司产品;凝胶成像仪(Amersham Imager 600),美国GE公司产品。
1.2 方法
1.2.1 小鼠超排处理 选择处于临近发情期阴门呈淡粉红色的雌性小鼠,于16:00~18:00腹腔注射孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)8 IU;注射PMSG 48 h后,每只小鼠再腹腔注射人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG)10 IU,进行超排处理。
1.2.2 小鼠孤雌激活胚胎的获得及培养 颈椎脱臼法处死小鼠,采集完整生殖器官(子宫、输卵管)和卵巢,在37℃生理盐水中清洗2遍,移至体视显微镜下观察,用针头挑破输卵管膨大部,采卵针吸出优质COCs,PBS清洗3次后移入1 g/L的透明质酸酶中反复轻微吹打,使其脱去周围卵丘细胞形成裸卵。将裸卵在含有胎牛血清的PBS中清洗3次,移至Srcl2+CB微滴(提前平衡)中并于37℃、体积分数为5% CO2、饱和湿度(95%)条件下作用4 h,完成激活。
孤雌激活完成后在体视显微镜下观察胚胎激活状况,然后将其移入含10 g/L BSA的KSOM培养液中(每100 μL的微滴含有20个卵母细胞),在37℃、体积分数为5% CO2、饱和湿度(95%)的培养箱中培养,在处理完成后24、48、60、84 h分别收集2细胞、4-8细胞、桑椹胚和囊胚时期的孤雌发育胚胎。
1.2.3 引物设计与合成 根据GenBank公布的小鼠Cav1、Cav2的mRNA序列,使用软件NCBI primer-BLAST在保守区域设计扩增小鼠Cav1、Cav2编码区域的基因序列引物及其RT-qPCR引物,并根据小鼠GAPDH(EU195062)基因序列设计内参引物,见表1。

表1 RT-qPCR引物信息
1.2.4 胚胎RNA的提取和反转录 对不同发育时期的孤雌发育胚胎,用微量RNA提取试剂盒进行总RNA的提取,并参照反转录试剂盒的说明,两步法合成cDNA,置-20℃保存,以待后续试验。
1.2.5 荧光定量PCR检测小鼠孤雌激活胚胎Cav1、Cav2基因的表达 使用荧光定量PCR检测仪检测Cav1、Cav2基因的表达水平。反应体系为20 μL,主要包含2 μL cDNA模板,上、下游引物各0.8 μL,2×SYBR GreenⅡ PCR mix 10 μL,ddH2O 6.4 μL。具体反应程序为:95℃ 10 s;95℃ 10 s,58℃ 10 s,72℃ 10 s,共40个循环。重复3次,在反应结束时根据生成的熔解曲线确定扩增特异性,采用相对定量分析法分析基因表达水平。
1.2.6 免疫荧光检测Cav1和Cav2蛋白在不同时期胚胎中的表达定位 收集各处理组2细胞、4-8细胞、桑椹胚和囊胚时期的胚胎,PBS清洗3次后,用免疫染色固定液室温固定30 min,免疫染色封闭液封闭1 h后,使用Cav1、Cav2抗体4℃孵育过夜,PBS洗3遍,移入荧光二抗中室温孵育1 h用于标记目的蛋白,PBS洗3遍,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染色5 min,PBS洗3遍,抗荧光猝灭剂封片,奥林巴斯荧光倒置显微镜拍照。
1.2.7 Western blot检测小鼠不同时期孤雌激活胚胎Cav1、Cav2的蛋白表达 用PBS清洗2细胞、4-8细胞、桑椹胚和囊胚时期的胚胎3遍,加入蛋白裂解液充分裂解2 h,10 000 r/min离心15 min,收集上清,置-80℃保存。100℃金属浴15 min使蛋白质充分变性。经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)后,将目标蛋白湿转至PVDF膜(polyvinylidene fluoride,PVDF),室温封闭3 h,孵育一抗(4℃12 h),PBST(PBS+tween-20)清洗5 min×6次,二抗室温孵育1 h,PBST洗20 min×3次,电化学发光试剂盒进行曝光2 min~5 min,待蛋白条清晰时拍照分析。
2 结果
2.1 小鼠孤雌激活胚胎体外发育情况
将收集好的卵母细胞在体式显微镜下激活后,体外培养使其继续发育,在24、48、60、84 h时依次观察到2细胞胚胎(图1A)、4-8细胞胚胎(图1B)、桑椹胚(图1C)、囊胚(图1D),此时内细胞团和囊胚腔已在孤雌激活胚胎内形成。经统计,不同时期胚胎的发育率分别为2细胞胚胎45.64%(110/241)、4-8细胞胚胎82.72%(91/110)、桑椹胚86.81%(79/91)和囊胚72.15%(57/79)。

A.2细胞期; B.4-8细胞期; C.桑椹胚期; D.囊胚期
2.2 不同发育时期孤雌激活胚胎Cav1、Cav2基因表达情况
利用普通PCR方法从基因水平检测孤雌激活胚胎2-4细胞、4-8细胞、桑椹胚和囊胚时期的胚胎中Cav1、Cav2的表达水平。电泳结果显示,目的条带单一清晰,产物大小与预期一致,说明引物及模板特异性良好,可以进行后续研究(图2)。实时荧光定量PCR检测结果显示Cav1、Cav2主要在桑椹胚时期表达,囊胚与4细胞胚胎次之,在2细胞胚胎中的表达量最低(图3)。

M.DNA标准DL 1 000;1.桑葚胚;2.囊胚;3.4-8细胞;4.2细胞
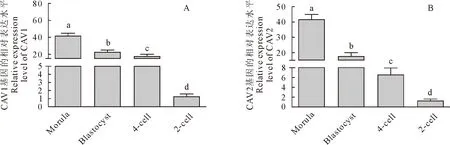
A.Cav1基因的相对表达水平;B.Cav2基因的相对表达水平A.Relative expression level of Cav1;B.Relative expression level of Cav2
2.3 不同发育时期孤雌激活胚胎中Cav1和Cav2蛋白的相对表达量
蛋白质免疫印迹试验结果显示,Cav1、Cav2在胚胎不同时期均有表达(图4A)。其中,桑椹胚时期Cav1、Cav2的表达量最高,囊胚与4细胞胚胎次之、2细胞胚胎最低(图4B)。

A.小鼠孤雌激活胚胎不同发育时期Cav1、Cav2WB检测;B.小鼠孤雌激活胚胎不同发育时期Cav1、Cav2相对表达量;1.2-细胞; 2.4-细胞; 3.桑椹胚; 4.囊胚
2.4 不同发育时期孤雌激活胚胎Cav1、Cav2免疫荧光检测结果
免疫荧光技术检测显示,在不同发育时期胚胎中均可检测到Cav1、Cav2的表达,桑椹胚和囊胚中荧光强度最高,2细胞胚胎最弱,且其主要定位在细胞质,囊胚内细胞团中Cav1和Cav2的荧光强度高于滋养层细胞(图5)。

A.Cav1免疫荧光染色结果;B.Cav2免疫荧光染色结果A.Cav1 immunofluorescence staining results;B.Cav2 immunofluorescence staining results
3 讨论
孤雌激活是指雌性动物产生的卵子在没有雄性配子的参与下就能形成胚胎并可进一步发育,又被称为孤雌生殖,孤雌激活胚胎具有类似于正常精卵结合胚胎的发育能力[19],能够进一步卵裂发育成为2-4细胞、4-8细胞、桑椹胚和囊胚,因此本研究以小鼠孤雌激活胚胎为模型,旨在探讨哺乳动物胚胎早期发育过程中胞吞作用的生理调控机制。分子信号转导、胆固醇与磷脂的运输、分选等生理调控作为哺乳动物胚胎早期发育过程中的关键生物学事件,可影响胚胎的发育质量。窖蛋白Cav1可与多种信号分子相互作用,形成不同的信号转导通路,进而调控这些信号分子,并通过对细胞内分子信号的调控,启动细胞迁移,从而影响胚胎的形成和发育[20-21]。细胞发育与生长过程中窖蛋白不仅在细胞膜运输系统中不可或缺,而且参与细胞的分析信号调节[7]。
Caveolae是信号转导中心,各种信号分子可聚集在Caveolae区,通过不同的模式形成组装平台,发挥生理调控。Cav1作为信号分子的支架蛋白和负性调节蛋白,在各种组织的上皮细胞或内皮细胞的胞膜上主要负责转运物质分子[22-23],如介导胆固醇的转运和流出等。Cav2的脚手架区域无抑制活性[24],但是否存在其他的其他信号抑制区域仍需证实。大多数动物组织细胞中Cav2与Cav1形成异源二聚体,进行共表达[25]。Cav1与Cav2形成的窖蛋白组装平台,不仅在细胞内外运输中起重要作用,在细胞的生长、囊泡运输等生物过程也发挥着重要的调控功能,两者形成的复合体对细胞胞吞作用的发挥也至关重要[7-15]。本研究以Cav2与Cav1为靶标,探明了小鼠早期胚胎发育胞吞作用的动态变化,为细胞胞吞作用参与哺乳动物胚胎发育生理调控提供理论依据。
通过体外生产孤雌激活胚胎,检测不同发育阶段胞吞作用相关蛋白(Cav1、Cav2)的动态表达,结果发现在囊胚期和桑葚胚中Cav1、Cav2的表达水平最高,可见随着胚胎的发育,胚胎内细胞数量的增多,因营养竞争等生理因素细胞损伤启动。而该阶段Cav1、Cav2表达的增加揭示胞吞生理调控可以在该阶段保护细胞的损伤,从而维持胚胎的高质量发育。囊胚中内细胞团(inner cell mass,ICM)是胎儿发育的主要来源细胞,滋养层(tropheetoderm,TE)细胞主要发育成为胎儿的胎膜和胎盘,囊胚形成后,胚胎的极性在形态上显现,形成具有明显差别的2个细胞群,位于囊胚内部的ICM仍然保持多能性,未来发育成胚体、卵黄囊、尿囊和羊膜等,外部的细胞分化为滋养外胚层,具有典型上皮性,滋养外胚层游离边缘具有微绒毛和侧面具有特殊蛋白复合物的分布,包括紧密连接和黏附连接,滋养外胚层增殖后形成胎盘和绒毛膜等胚外器官[26-27]。且在二者分裂分化过程中,涉及到许多基因的表达和细胞因子的参与,而两者间胞吞作用相关蛋白Cav1、Cav2的表达必定与二者朝着不同方向发展,最终形成完整个体有关[28]。两者的平衡对于胎儿的发育和胚胎的附植至关重要,研究结果显示,囊胚中内细胞团细胞和滋养层细胞均可表达Cav1、Cav2蛋白,推测两者的表达可能有助于通过胞吞作用调控囊胚细胞平衡,维持囊胚质量。此外,囊胚中发现内细胞团中Cav1和Cav2的荧光强度高于滋养层细胞,可见胞吞调控对胚胎的发育更为重要,结果为早期胚胎发育和囊胚质量的调控提供了一个新的突破点,有助于通过相关条件改变调控胚胎发育的胞吞生理功能,对动物辅助繁殖技术有重要意义。
胞吞作用相关蛋白Cav1、Cav2可参与小鼠早期胚胎发育的整个生理过程调控,但在不同的发育阶段存在一定差异,其中桑椹胚和囊胚中生理调控作用更为显著。囊胚中不同的细胞类型胞吞作用相关蛋白的生理功能也存在一定差异,其对内细胞团的保护机制更为明显。研究结果可为探索胞吞作用参与哺乳动物胚胎早期发育的调控机制提供参考。