6 种食用香辛料基因组DNA提取方法比较
周梦月,邢冉冉,王 楠,葛毅强,陈 颖,*
(1.中国检验检疫科学研究院,北京 100123;2.中国农业大学食品科学与营养工程学院,北京 100083;3.中国农村技术开发中心,北京 100045)
香辛料是对花、花蕾、种子、芽、叶、茎、块根和根茎等器官,或从这些器官取得的原料而制成的有刺激性香辛味、可赋予食物风味并增进食欲和帮助消化的物质的统称[1]。大多数香辛料是药食同源植物,用于食品烹调时,可以呈现出各种辛、香、辣味等特性,能够赋予食物以风味,起到开胃、调香、增色等作用,因此被广泛地运用在食品工业、家庭和酒店的菜肴烹调中[2]。最新研究表明,香辛料还具有抗氧化[3]、抗糖尿病[4]、抗癌[5]、抗病毒[6]、抗胃溃疡[7]以及提供营养素[8]等特殊生理功效。随着全球贸易的发展,食用香辛料的市场需求还会继续增加。但是由于我国目前对食用香辛料还没有统一的产品质量标准,这给食用香辛料的掺假创造了机会。由于不同食用香辛料经济价值不同,因此其价格也存在较大差异。在经济利益的驱动下,一些不法商人利用价廉的材料全部或部分替代价格较高的食用香辛料产品[9],如2017年“天津独流镇调料造假”事件的发生扰乱了市场秩序[10]。为了规范市售食用香辛料的商品情况,合理制定食用香辛料的质量标准,迫切需要一种准确快速的食用香辛料真伪鉴别方法。
基于DNA的分子检测方法对物种判别的基础是遗传物质,可以克服表型不能完全或真实地反映食用香辛料变异情况的缺点,从而保证检测结果的确定性和重现性[11]。近年来,序列特异扩增区域-聚合酶链式反应(sequence characterized amplified region-polymerase chain reaction,SCAR-PCR)和DNA条形码技术成为检测食品掺假的理想方法,已被广泛用于香辛料的物种鉴别[12]。Gul等[13]使用随机引物扩增出区分胡椒和番木瓜种子的特异性RAPD标记片段,并转化为SCAR标记,最终成功鉴别胡椒及其常见掺假物(番木瓜种子)。ITS2基因是5.8S和28S基因之间的转录间隔区,其两端区域高度保守易于通用引物的设计,且该区域易扩增,是唯一被广泛使用的核基因[14]。Chen Shilin等[15]利用通用引物对992 种药用植物(双子叶植物、单子叶植物、裸子植物、蕨类植物)进行PCR扩增,结果表明,PCR扩增成功率达到89.6%,可成功扩增大部分药用植物的ITS2基因序列。Zhang Mengting等[16]以ITS2和psbA-trnH基因序列为分子标记,利用DNA条形码技术成功鉴别了16 种具有代表性的食用香辛料及其常见掺杂物,但部分白胡椒、丁香和肉豆蔻因DNA质量浓度低(<20 ng/μL)导致PCR扩增失败,未能进行下一步研究。由此可见,DNA纯度和质量浓度是基于DNA分子检测方法成功的重要因素。食用香辛料来自不同科属植物的不同部位,有些含有大量的多糖和多酚类化合物,这些化合物的存在会抑制DNA的提取[17]。多酚经长时间放置被氧化,可以不可逆结合蛋白质和核酸形成高分子质量的复合物,导致所提DNA质量差[18]。而多糖会阻碍聚合酶、连接酶和限制性内切酶的活性,若DNA提取过程中未完全去除会导致后续研究无法进行[19]。目前关于食用香辛料DNA提取方法的研究多针对单一物种[20-23],缺少对大多数食用香辛料通用的提取方法。
本研究针对常见的食用香辛料,采用改良十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-CTAB法和4 种市售DNA提取试剂盒对其基因组DNA进行提取,并利用ITS2序列引物对其进行PCR扩增,通过比较DNA提取效率和所提DNA的质量及PCR扩增成功率,以筛选出最适合食用香辛料DNA提取的方法。
1 材料与方法
1.1 材料、试剂与仪器
选用常见的19 种食用香辛料作为实验材料(图1)。其中,砂仁、草果、豆蔻、干姜、高良姜、山柰、小茴香、白芷、肉桂、肉豆蔻、花椒、陈皮、丁香、八角、甘草购于北京同仁堂开发区店,孜然、芫荽子、月桂叶、白胡椒购于电子商务平台。所有样品均根据中国植物志进行形态学鉴定。市售粉状食用香辛料,孜然粉、肉桂粉、花椒粉、八角粉、白胡椒粉和辣椒粉购于线上京东超市。

图1 食用香辛料图片Fig. 1 Pictures of edible spices tested in this study
DNA提取试剂盒:TIANGEN植物基因组DNA提取试剂盒、TIANGEN DNAsecure新型植物基因组DNA提取试剂盒 天根生化科技(北京)有限公司;DNeasy plant kit 德国QIAGEN公司;Nucleospin®Food kit 德国Machereye-Nagel公司。为了便于区分,以上4 种DNA提取试剂盒分别用公司名称代替,即TIANGEN-I试剂盒、TIANGEN-II试剂盒、QIAGEN试剂盒和MN试剂盒。
CTAB、Tris-HCl、EDTA、NaCl、NaCOOH、KCOOH、异丙醇、无水乙醇 国药集团(上海)化学试剂有限公司;SDS 美国Amresco公司;聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP) 北京索莱宝科技有限公司;DNA抽提试剂 北京拜尔迪生物技术有限公司;2×SuperTaqPCR MasterMix、6×上样缓冲液北京康润诚业生物科技有限公司;DL2000 DNA Marker宝生物技术(大连)有限公司;琼脂糖 北京擎科新业生物技术有限公司。
TissueLyser II高通量组织研磨仪 德国QIAGEN公司;BT323S电子天平 赛多利斯科学仪器(北京)有限公司;Thermo Heraeus Pico 17微量离心机、Nano Drop ONE超微量分光光度计 美国Thermo Fisher Scientific公司;电泳仪、Versa Doc凝胶成像系统美国Bio-Rad公司;微量移液器 德国Eppendorf公司;Veriti 96-Well Thermal Cycler梯度PCR仪 美国Applied Biosystems公司。
1.2 方法
1.2.1 样品前处理
取食用香辛料样品,块状和片状的食用香辛料用70%乙醇溶液擦拭,颗粒状和粉状食用香辛料放入70%乙醇溶液中,混合均匀后弃上清液。随后将清洗后的食用香辛料晾干并放入组织研磨器中,在频率30 Hz研磨90 s。将粉碎后的食用香辛料放入研钵中,加入液氮充分研磨3~5 次。根据文献报道,为了防止多酚氧化影响DNA的质量,CTAB法和SDS-CTAB法在研磨时加入2%的PVP,使多酚与PVP络合[24]。
1.2.2 DNA提取
使用4 种商业化试剂盒以及改良CTAB法和SDSCTAB法对块状、片状及颗粒状食用香辛料样品进行基因组DNA提取。筛选出最优DNA提取方法用于粉状食用香辛料中基因组DNA的提取,以验证该方法在市售香辛料粉中的适用性。每个样品设置3 个重复,且每个DNA提取方法设置一个空白对照。
1.2.2.1 TIANGEN-I试剂盒
TIANGEN-I试剂盒采用以硅基质为材料的离心柱,适用于从多种植物的不同组织中快速提取基因组DNA,特别适用于多酚、多糖含量高的植物组织和植物干粉。分别称取30 mg样品进行DNA提取,DNA裂解时间由20 min延长至60 min;由于食用香辛料中多酚较多,苯酚-氯仿-异戊醇(25∶24∶1,V/V)代替氯仿进行等体积抽提2 次,最终使用60 μL双蒸水洗脱DNA,洗脱后的溶液再加入离心柱中重复洗脱步骤,其余按照说明书步骤操作。
1.2.2.2 TIANGEN-II试剂盒
TIANGEN-II试剂盒是离心柱型试剂盒,适用于各种植物组织。分别称取20 mg样品按照试剂盒说明书进行DNA提取。其中DNA裂解条件改为65 ℃水浴60 min,且最终使用60 μL双蒸水重复洗脱2 次。
1.2.2.3 QIAGEN试剂盒
QIAGEN试剂盒通过基于硅胶膜的离心柱形式,从植物细胞、组织或真菌细胞样本中分离总DNA。分别称取20 mg样品按照试剂盒说明书操作,其中DNA裂解时间延长为60 min,最终使用60 μL双蒸水重复洗脱DNA 2 次。
1.2.2.4 MN试剂盒
MN试剂盒是一种硅胶柱吸附式试剂盒,能提取复杂基质(加工食品、大豆、巧克力,谷物、肉类、动物饲料等)中的DNA。分别称取30 mg样品进行DNA提取,DNA裂解时间由30 min延长为60 min,最终使用双蒸水重复洗脱2 次,其余按照说明书步骤进行。
1.2.2.5 改良CTAB法
分别称取30 mg样品参照余亚东[25]的方法进行DNA提取,部分步骤进行改进。其中样品经CTAB提取液裂解60 min后,使用DNA抽提试剂苯酚-氯仿-异戊醇(25∶24∶1,V/V)代替氯仿-异戊醇(24∶1,V/V)将DNA抽提至上层水相中,加入异丙醇和3 mol/L NaCl溶液后置于-20 ℃中冰浴,冰浴时间由60 min延长至过夜。12 000 r/min离心5 min,弃上清液,并使用70%乙醇溶液和无水乙醇分别洗涤沉淀,最后使用60 μL双蒸水溶解DNA。
1.2.2.6 SDS-CTAB法
称取30 mg样品,参考赵玲云等[26]的方法进行DNA提取,并针对食用香辛料部分改进。基于预实验省略缓冲液I洗涤和RNase的加入,样品在2% SDS溶液中65 ℃裂解60 min后,加入5 mol/L KCOOH(pH 6.0),并置于-20 ℃中冰浴60 min。离心取上清液后加入CTAB缓冲液,65 ℃裂解60 min后改用等体积的DNA抽提试剂苯酚-氯仿-异戊醇(25∶24∶1,V/V)抽提DNA。随后加入异丙醇和NaCl溶液过夜沉淀DNA,离心弃上清液,并用70%乙醇溶液洗涤2 次,最后使用60 μL双蒸水溶解DNA。
1.2.3 DNA质量检测
1.2.3.1 DNA质量浓度和纯度测定
取1 μL提取的DNA用Nano Drop ONE测定其质量浓度、A260nm/A280nm和A260nm/A230nm的比值,以评估提取DNA的质量和杂质去除情况。
1.2.3.2 DNA完整度检测
选取3 个重复中DNA质量浓度最高的样品进行琼脂糖凝胶电泳,评价不同提取方法所得DNA的完整度。取5 μL DNA原液与1 μL 6×上样缓冲液混匀,以1%的琼脂糖凝胶进行电泳,电压90 V,电泳时间40 min。电泳结束后放于EB染液中染色10 min,水洗2 min,最后放入凝胶成像系统中成像。
1.2.3.3 PCR扩增
将DNA稀释至10 ng/μL,用ITS2序列引物[27]进行PCR扩增以评价所提DNA是否满足后续研究。引物序列为MS2F:5’-GAGTCTTTGAACGCAAGTTG-3’和MS2R:5’-TCCTCCGCTTATTGATATG-3’。PCR体系为:2×PCR reaction mix 12.5 μL,正反向引物各0.1 mmol/L,DNA 30 ng,加水补充至25 μL。PCR程序:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸40 s,33 个循环,最后72 ℃延伸7 min。PCR结束后,取5 μL PCR产物,在2%的琼脂糖凝胶中电泳45 min,电压90 V。随后用Versa Doc凝胶成像系统检测PCR扩增情况。
1.3 数据分析
2 结果与分析
2.1 DNA完整度分析
食用香辛料来自植物的不同部位,其组织中含有不同含量和种类的次生代谢产物,这些物质的存在会影响DNA的提取质量。本研究选取适用于富含多酚和多糖的植物DNA提取试剂盒、复杂基质的食品DNA提取试剂盒及针对次生代谢产物改良的CTAB法和SDS-CTAB法提取食用香辛料基因组DNA。
采用琼脂糖凝胶电泳检测提取的DNA完整性。条带紧凑、分子质量大的表明提取方法效果较好,高分子质量条带呈分散状,低分子质量区域较亮,表明降解较为严重[28]。结果表明,不同DNA提取方法对DNA完整性影响不同,都观察到一定程度的降解。6 种方法提取的7号(孜然)、9号(芫荽子)、12号(月桂叶)、14号(青花椒)和18号(甘草)样品DNA在2 kb以上区域有明显条带,但存在拖尾现象。2号(草果)、11号(肉桂)、13号(肉豆蔻)和17号(八角)样品的DNA均无明显条带,主要是由于食用香辛料在干燥及存放过程中,DNA暴露在高温、物理或化学处理下,导致DNA的降解[29]。总体来看,TIANGEN-II试剂盒和改良CTAB法所提DNA完整性最好。而QIAGEN试剂盒法所提DNA电泳条带亮度较弱,表明该方法提取的DNA产率较低。

图2 6 种方法提取食用香辛料基因组DNA的电泳图Fig. 2 Electrophoresis of genomic DNA from edible spices obtained by six extraction methods
2.2 DNA质量浓度分析
由于6 种方法所用食用香辛料的量不同,因此将质量浓度换算为20 mg样品所提DNA的质量浓度进行比较。结果表明,不同食用香辛料种类和提取方法在统计学上存在显著差异,证明DNA质量浓度取决于提取方法和样品种类(表1)。比较不同的DNA提取方法,发现改良CTAB法、SDS-CTAB法所提DNA质量浓度显著高于MN试剂盒法、TIANGEN-I试剂盒法和QIAGEN试剂盒法(P<0.05)。在4 种商业试剂盒中,TIANGEN-II试剂盒和MN试剂盒所提DNA质量浓度显著高于TIANGEN-I和QIAGEN试剂盒(P<0.05)。研究发现,DNA质量浓度受食用香辛料种类的影响。皮类食用香辛料,如11号(肉桂),提取DNA质量浓度为2.44~62.36 ng/μL,其中改良CTAB法提取的DNA质量浓度最高,其次依次为SDS-CTAB法、TIANGEN-II试剂盒法、QIAGEN试剂盒法、MN试剂盒法和TIANGEN-I试剂盒法。主要是由于木质素合成途径中存在的蛋白质、多糖和酚类化合物会强烈抑制DNA的提取,使得从木材中提取基因组DNA对困难[30],导致树皮/木质组织的DNA产量较低(<50 ng/μL)[31]。根茎类食用香辛料,如4号(干姜)、5号(高良姜)、6号(山柰)、10号(白芷)和18号(甘草),所提DNA平均质量浓度低于85 ng/μL,这是由于这类样品大多质地坚硬且组织中含有较多的纤维和储藏物质[32],导致同等质量的样品中DNA含量少、较难提取。部分果实类食用香辛料,如1号(砂仁)和2号(草果),其质地坚硬(图1),在相同的前处理情况下仍有块状物质存留,表明细胞壁未完全破除,导致所提DNA质量浓度低。因此,在根、茎、皮类等质地坚硬的食用香辛料DNA提取中,应充分研磨,且适当增加样品量和裂解时间,以获得高质量浓度、高质量的DNA。13号(肉豆蔻)经6 种提取方法提取后得到的DNA质量浓度低,平均为8.54 ng/μL。这是由于13号(肉豆蔻)含油率较高[33],脂质的存在阻碍了遗传物质的提取。另外,其平均DNA质量浓度低于其他食用香辛料的DNA质量浓度,证明脂质对DNA提取的影响比坚硬的组织更大,这也与Tear等[34]研究一致。
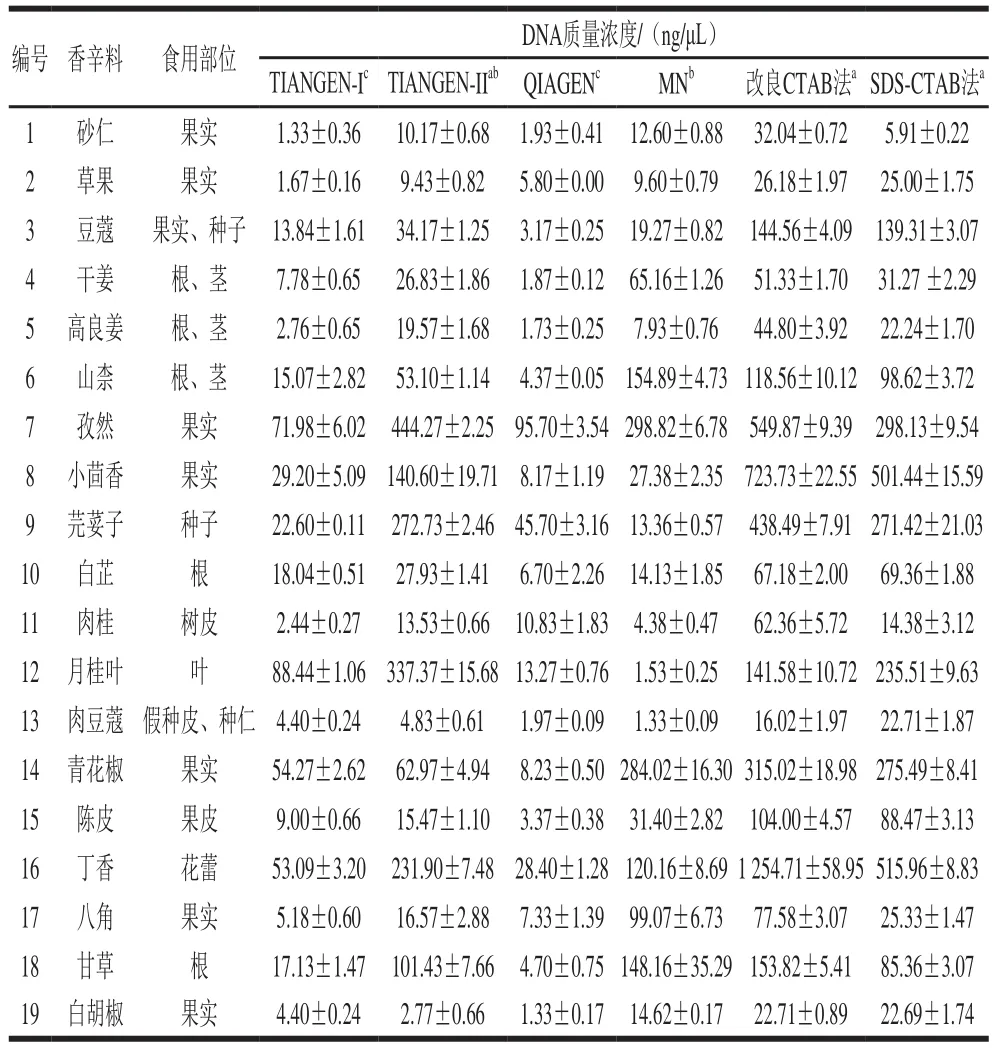
表1 6 种方法提取的19 种食用香辛料DNA的质量浓度Table 1 Concentrations of DNA from 19 edible spices extracted by six methods
2.3 DNA纯度分析
多糖和多酚的存在会干扰DNA进一步分析[35],本研究采用A260nm/A280nm和A260nm/A230nm比值对提取的DNA进行质量评价。所有方法提取DNA的A260nm/A280nm比值在(0.70±0.03)~(2.05±0.01)之间(表2),TIANGENII试剂盒所提DNA的A260nm/A280nm比值最高,与改良CTAB法、SDS-CTAB法和TIANGEN-I试剂盒法无统计学差异(P>0.05),但显著高于MN试剂盒法和QIAGEN试剂盒法(P<0.05)。利用TIANGEN-II试剂盒提取到的19 种食用香辛料DNA,其中63%的样品优于其他方法,且26.3%的样品DNA的A260nm/A280nm比值高于1.8,证明DNA提取过程中蛋白质去除良好。MN试剂盒法提取的4号(干姜)和6号(山柰)样品DNA的A260nm/A280nm比值分别为1.12±0.02和0.99±0.02,DNA中存在蛋白质污染,表明MN试剂盒不适用于两者中蛋白质的去除。本研究采用A260nm/A230nm比值评估各方法对碳水化合物的去除情况,6 种方法提取DNA的A260nm/A230nm比值低于2.0(P<0.05),表明DNA中可能存在多糖、小分子盐类及色素等物质。6 种DNA提取方法中TIAGEN-I碳水化合物去除情况最好,且52.6%的样品所提DNA优于或同于其他方法。总体而言,6 种方法所提DNA的A260nm/A230nm比值无显著性差异(P>0.05)。
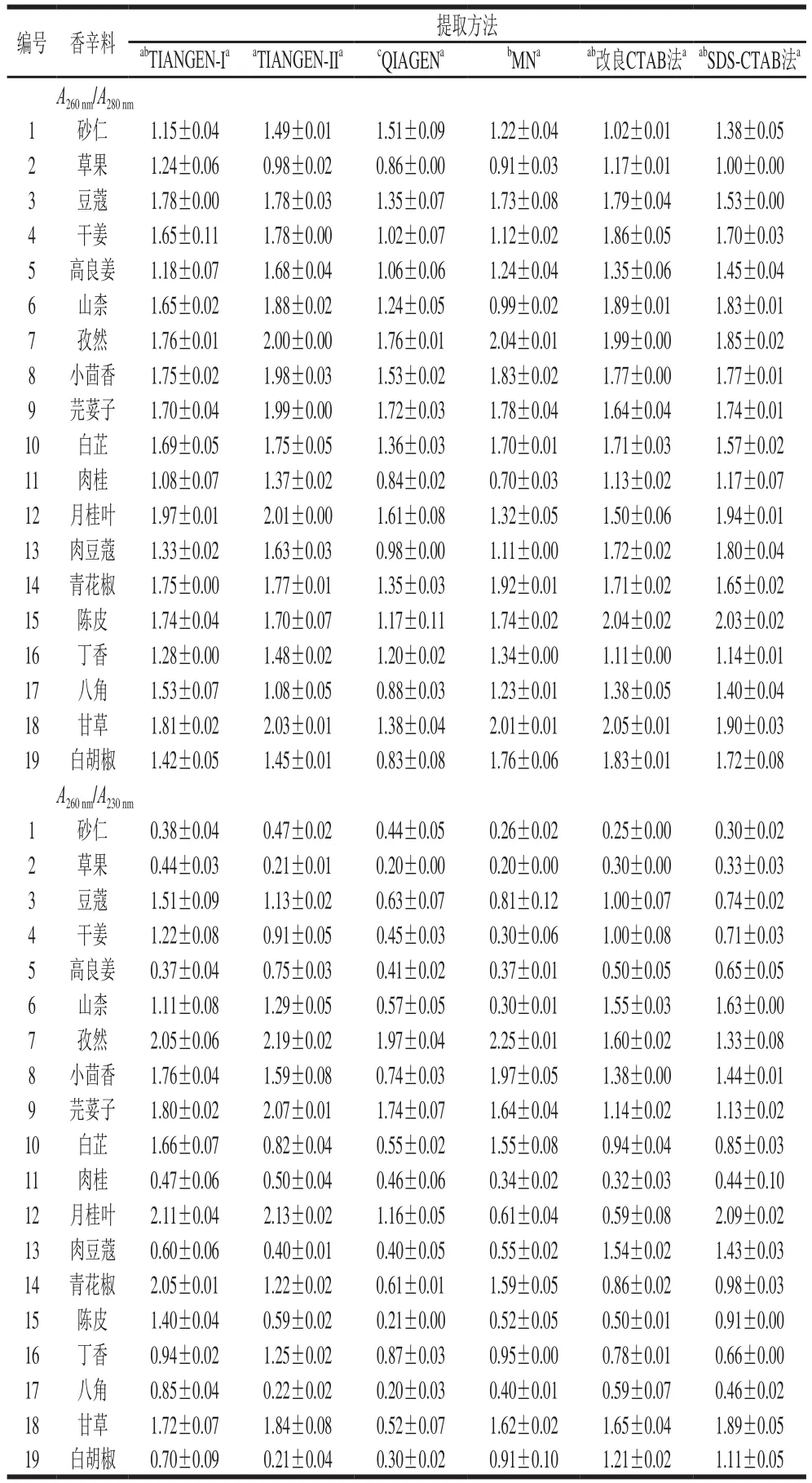
表2 6 种方法提取的19 种食用香辛料DNA的纯度Table 2 DNA purity from 19 edible spices extracted by six methods
2.4 PCR扩增结果分析
本研究将6 种方法提取的食用香辛料DNA进行PCR扩增以评估DNA的扩增成功率,进而比较不同方法去除PCR抑制剂的能力,以选出最佳DNA提取方法。结果显示,6 种方法提取的DNA在PCR扩增效率上有明显差异(图3),表明不同方法去除干扰PCR抑制剂的能力不同。总体上,4 种商业试剂盒法提取DNA的PCR扩增成功率均大于80%,高于改良CTAB法(75.2%)和SDSCTAB法(77.2%)。TIANGEN-I试剂盒法和QIAGEN试剂盒法提取的DNA扩增成功率最高为100%,但QIAGEN试剂盒法提取的2号(草果)、11号(肉桂)和14号(花椒)样品DNA只能观察到微弱的电泳条带,这表明QIAGEN试剂盒法所提DNA中仍存在少量PCR抑制剂。食用香辛料种类不同导致PCR扩增结果产生差异。3号(豆蔻)、7号(孜然)、8号(小茴香)、9号(芫荽子)和18号(甘草)样品利用6 种方法所提DNA的PCR扩增产物均具有明亮、单一的电泳条带,表明样品DNA扩增效率高。而TIANGEN-I试剂盒法、TIANGEN-II试剂盒法、改良CTAB法和SDS-CTAB法所提12号(月桂叶)样品的DNA质量浓度及纯度高,但只能观察到微弱的电泳条带,表明研究所用引物在月桂叶DNA中扩增效率低。对于11号(肉桂)样品,PCR扩增产物电泳条带弱,这是由于DNA质量浓度低导致的。

图3 6 种方法提取的19 种食用香辛料DNA PCR扩增产物电泳图Fig. 3 Electrophoresis of PCR products of DNA from 19 edible spices extracted by six methods
在实际工作中,选择一种快速、准确的DNA提取方法对食用香辛料的检测具有重要意义。SDS-CTAB法和改良CTAB法耗时长,分别需要14 h和10 h,且PCR扩增成功率最低。4 种试剂盒法均用时较短(≤2 h),其中TIANGEN-I和QIAGEN试剂盒法的PCR扩增成功率最高,但QIAGEN试剂盒法所提DNA的质量浓度最低,并存在一定的PCR抑制剂。因此,经过综合比较,本研究推荐使用TIANGEN-I试剂盒法作为食用香辛料中基因组DNA提取的优选方法。
2.5 市售香辛料粉中提取DNA的质量浓度及质量分析
使用DNA提取效果最好的TIANGEN-I试剂盒对7 份常见的市售食用香辛料粉进行DNA提取,并根据DNA质量浓度、纯度及PCR扩增效率评估该方法对香辛料粉的适用性。为使结果更加直观,将质量浓度换算为20 mg香辛料粉所提DNA的质量浓度进行比较。
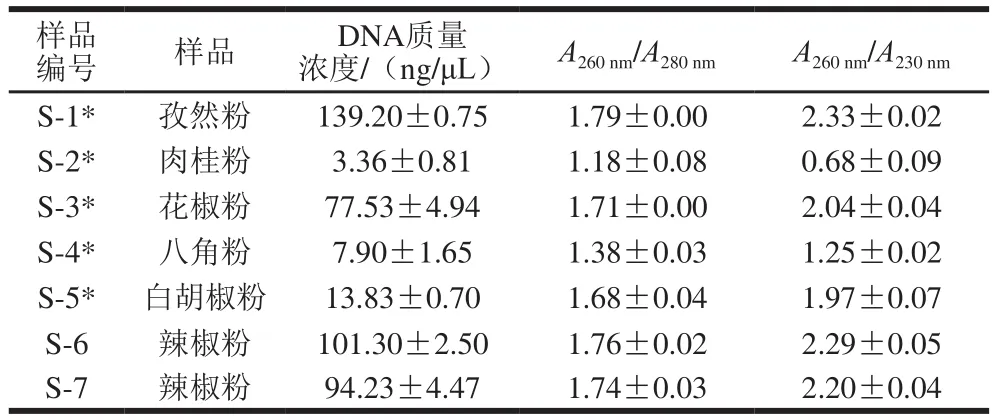
表3TIANGEN-I试剂盒法提取市售香辛料粉DNA的质量浓度和纯度Table 3 DNA concentrations and purity from commercial spice powder extracted by TIANGEN plant genomic DNA kit
结果表明,所有样品DNA质量浓度在3.36~139.20 ng/μL之间(表3),其中,S-1(孜然粉)、S-2(肉桂粉)、S-3(花椒粉)、S-4(八角粉)和S-5(白胡椒粉)的DNA质量浓度显著高于完整的食用香辛料所提DNA的质量浓度(P<0.05),这是因为粉状食用香辛料细胞壁破碎更加完全。因此,在食用香辛料DNA提取过程中充分研磨可以提高DNA提取的效率。与片状肉桂(11)类似,因肉桂粉(S-2)中蛋白质、多糖和多酚物质的存在会抑制DNA提取,导致其DNA质量浓度较低(3.36 ng/μL)。市售香辛料粉DNA的A260nm/A280nm比值在1.18~1.80之间,与其对应的完整食用香辛料所提DNA的A260nm/A280nm比值无统计学差异(P<0.05)。同样,粉状食用香辛料细胞壁破碎完全,细胞中的碳水化合物释放出来,使其在DNA裂解和纯化过程中被充分去除。研究利用PCR扩增成功率判断该方法所提DNA中抑制剂去除情况,以评估是否适用于后续研究。S-1(孜然粉)、S-3(花椒粉)、S-4(八角粉)、S-5(白胡椒粉)、S-6(辣椒粉)和S-7(辣椒粉)的PCR产物条带明亮(图4),证明DNA质量良好,适合后续的研究。当使用30 mg肉桂粉,裂解时间为60 min时,所得DNA质量浓度为5.07 ng/μL,但PCR扩增后显示无电泳条带。将样品量增加至50 mg,裂解时间延长至120 min后,提取到的DNA质量浓度提高至(13.20±0.19)ng/μL,且PCR扩增成功(图4)。因此,在提取皮类或者坚硬的食用香辛料时需要适当增加样品量,延长DNA裂解时间。

图4 市售食用香辛料粉PCR扩增结果Fig. 4 Electrophoresis of PCR amplification products of DNA from commercial spice powder
综上所述,利用TIANGEN-I试剂盒可以成功提取7 份常见的市售食用香辛料粉中的基因组DNA。其中,对于皮类食用香辛料,如肉桂粉样品(S-2),可以通过增加样本量和延长裂解时间,以提取得到符合实验要求的基因组DNA。
3 结 论
食用香辛料中因含有多糖、多酚和色素等化合物,导致DNA提取相对困难。本研究通过DNA的完整性、DNA纯度和PCR扩增成功率,比较4 种商业DNA提取试剂盒、改良CTAB法和SDS-CTAB法用于食用香辛料的DNA提取。结果表明,QIAGEN试剂盒法能够去除大部分PCR抑制剂,但提取的DNA质量浓度较低且质量较差;改良CTAB法和SDS-CTAB法提取的食用香辛料DNA质量浓度高,但由于采用异丙醇和高质量浓度盐沉淀DNA,会导致PCR抑制剂及其他有机化合物与DNA同时沉淀,影响PCR扩增,从而造成PCR扩增成功率低;TIANGEN-I试剂盒法去除次生代谢物和PCR抑制剂的能力最强,对块状、片状、颗粒状和粉状香辛料均能提取得到质量浓度及纯度良好的DNA,且所得DNA的PCR扩增成功率高,适合含多糖、多酚以及其他次生代谢物含量较高的食用香辛料DNA提取。
此外,由于食用香辛料种类不同,其细胞破坏难易程度及组织中存在的物质不同,需要根据实际情况对DNA提取步骤进行优化。对于根茎类、皮类等坚硬的食用香辛料,由于细胞破坏困难导致其DNA质量浓度低,因此在DNA提取时需要研磨充分,适当增加样品量、裂解液以及延长裂解时间,以得到较好的DNA提取效果。

