姜黄素调节Na/K-ATPase/Src信号通路保护LLC-PK1细胞缺氧复氧损伤
翟兵中,张丽婧,刘 臻,陈建国,胡志航,梅 松,胡文力,楼敏涵,王 茵,曲雪峰*
(杭州医学院食品科学与工程学院,浙江 杭州 310013)
缺血性心脏病是全球范围内导致死亡的重要病因之一[1]。在围手术期,心肌缺血和心肌梗死等心脏病并发症是导致患者术后发病和死亡的主要原因。心脏早期再灌注是限制梗死面积的有效方法,但再灌注本身能够诱导心肌凋亡,即心肌缺血再灌注损伤[2]。缺血再灌注损伤的发病机制尚未完全阐明,之前的研究发现,在缺血再灌注损伤发生的最初几分钟内,会产生一系列的氧化应激反应,通过不同的机制最终导致心肌损伤和心肌细胞死亡。心肌缺血再灌注损伤在世界范围内都是一个有待解决的难题,目前尚无有效的治疗方法[3]。
Na/K-ATPase是一种跨膜蛋白,通过偶联腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)水解运输钠离子和钾离子进出细胞,从而建立并维持细胞膜内外的离子浓度梯度。Na/K-ATPase除了发挥离子通道作用,以维持细胞内外液渗透压稳定外,还具有信号转导功能[4-7]。 Na/K-ATPase信号转导系统具有放大活性氧(reactive oxygen species,ROS)产生的作用。强心苷类物质与Na/K-ATPase结合[8-9]后,可以使Na/K-ATPase由E1构型转变为E2构型,从而增加类固醇受体辅助活化因子(steroid receptor coactivator,Src)活性,并激活Src下游信号通路细胞外调节蛋白激酶(extracellular regulated protein kinases,Erk)1/2,产生大量ROS[10-11]。Cui Χiaoyu等[7]的研究证明,ROS可以使Na/K-ATPase转变为E2构型,激活信号通路中的Src和Erk1/2,并触发信号级联产生大量ROS,增加的ROS进一步激活Na/K-ATPase/Src信号通路,形成Na/K-ATPase/Src/Erk1/2/ROS放大环路。这一过程可能与缺血再灌注等一些疾病的发生有着密切联系。
姜黄素是从植物姜黄的根茎中分离出来的一种重要的多酚类生物活性成分,具有抗炎、抗细胞凋亡、抗细胞增殖、抗氧化等作用。目前的研究已经发现,姜黄素对心肌缺血再灌注损伤、心肌梗死、高血压、糖尿病心肌病等具有保护作用[12],但是在以往研究中,关于姜黄素对缺血再灌注损伤的保护作用机理主要集中于姜黄素的抗凋亡和抗炎作用,对其他作用机制尚不明确。本研究在细胞水平通过细胞缺氧复氧模型损伤模拟细胞氧化应激损伤,利用富含Na/K-ATPase的猪肾上皮细胞LLCPK1细胞探索Na/K-ATPase/Src信号通路在缺氧复氧损伤中的作用,探究姜黄素减轻细胞缺氧复氧损伤的可能作用机制。
1 材料与方法
1.1 材料与试剂
猪肾上皮LLC-PK1细胞由南京凯基生物发展有限 公司提供。
Na/K-ATPase、ATP、姜黄素、乌苯苷、上样缓冲液 美国Sigma公司;胎牛血清 加拿大维森特公司;胰酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 美国Gibco公司;磷酸盐缓冲液(phosphate buffered saline,PBS) 杭州 吉诺生物医药技术有限公司;BIOMOL®Green Reagent磷酸盐显色试剂盒 日本关东化学株式会社;Erk抗体、p-Erk抗体 美国Cell Signaling公司; Src抗体 美国Santa公司;p-Src抗体 美国Invitrogen公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 杭州贤至生物科技有限公司;荧光二抗 美国Abcam公司; 乳酸脱氢酶(lactate dehydrogenase,LDH)活力、噻唑蓝(methyl thiazolyl tetrazolium,MTT)细胞增殖及细胞毒性检测试剂盒 江苏凯基生物技术股份有限公司;M199培养液 美国Gibco公司。
1.2 仪器与设备
SW-CJ-1 FD型单人单面净化工作台 苏州净化设备有限公司;BB150 CO2培养箱 美国Thermo Scientific 公司;5417R低温高速离心机 德国Eppendorf公司;DK-S22型电热恒温水浴锅 上海精宏实验设备有限公司;Spectra Max M4多功能酶标仪 美国Molecular Devices公司;双色红外激光成像系统扫描仪 美国 Li-Cor公司。
1.3 方法
1.3.1 Na/K-ATPase活力测定
用比色法测定Na/K-ATPase活力。向EP管中加入20 mmol/L Tris-HCl(pH 7.2)、1 mmol/L MgCl2、100 mmol/L NaCl、20 mmol/L KCl、1 mmol/L EDTATris各50 μL混匀,再加入不同浓度(0、0.01、0.1、1、10 μmol/L)姜黄素50 μL,以加等体积1 mmol/L乌本苷作为阴性对照,每管加入Na/K-ATPase 2 μg,于37 ℃孵育10 min后,加入50 μL 20 mmol/L ATP开始反应。37 ℃再次孵育10 min后加入1 mL预冷8%三氯乙酸溶液终止 反应,并将其置于冰上,反应生成的磷酸用磷酸盐显色试剂盒测定。用酶标仪于620 nm波长处测定OD值,不同组别磷酸生成量利用各组测得OD值根据标准曲线计算得出。以每小时每毫克Na/K-ATPase分解ATP产生1 μmol无机磷的量为一个酶活力单位。Na/K-ATPase活力按式(1)计算。

式中:1/6为反应时间/h;0.002为Na/K-ATPase质量/mg。
1.3.2 Na/K-ATPase构型分析
向EP管中加入20 mmol/L Tris-HCl(pH 7.2)、1 mmol/L MgCl2、NaCl/KCl混合液(含100 mmol/L NaCl、20 mmol/L KCl)、1 mmol/L EDTA-Tris各50 μL混匀,每管加入2 μg Na/K-ATPase、10 μmol/L姜黄素50 μL、不同浓度(0.01、0.02、0.04、0.1、0.3、1、10 μmol/L)Na/K-ATPase活力抑制剂钒酸钠50 μL,作为实验组;以加入50 μL 1 mmol/L乌本苷为阴性对照组,仅添加钒酸钠、不添加姜黄素为空白组。然后,加入50 μL 20 mmol/L ATP溶液于37 ℃反应10 min,然后加入质量分数8%三氯乙酸终止反应。用酶标仪于620 nm波长处测定OD值。乌本苷敏感Na/K-ATPase活力按式(2)计算,根据其分析姜黄素对Na/K-ATPase构型的影响。

1.3.3 LLC-PK1细胞培养和缺氧复氧损伤处理
将LLC-PK1细胞用含10%胎牛血清和双抗(青霉素和链霉素各100 U/mL)的M199培养液于37 ℃、5% CO2恒温培养箱中培养,待细胞贴壁生长至70%~80%融合进行实验[13]。细胞经无血清M199培养基饥饿过夜,培养12 h后LLC-PK1细胞经姜黄素+乌本苷或姜黄素预保护1 h后缺氧1 h复氧3 h不同处理。缺氧复氧模型为细胞置于5% CO2、95% N2的湿化环境中1 h,然后更换为含10%胎牛血清的M199培养基,并置于5% CO2、95%空气的环境中复氧3 h。
1.3.4 MTT法测定H2O2诱导氧化应激LLC-PK1细胞活力
利用MTT细胞增殖及细胞毒性检测试剂盒测定细胞活力。LLC-PK1细胞以1×104个/孔接种于96 孔板中,置于37 ℃、5% CO2细胞培养箱培养24 h后,经10 μmol/L 姜黄素预保护1 h,然后分别加入50、100、200、400、500 μmol/L H2O2作用24 h后,每孔内加入15 μL 5 mg/mL的MTT溶液,37 ℃处理4 h。弃去培养液,每孔加200 μL二甲基亚砜,将96 孔板置于摇床上室温慢摇10 min,使形成的深紫色晶体完全溶解,用酶标仪于490 nm波长处测定OD值。以加姜黄素、无细胞的完全培养基为空白组,不加H2O2其余处理相同为阴性对照组,每组6 个复孔。细胞存活率按式(3)计算。

1.3.5 LDH活力测定
LLC-PK1细胞以1×104个/孔接种于96 孔板中,置于37 ℃、5% CO2细胞培养箱培养24 h后,经10 μmol/L姜黄素预保护1 h后,缺氧1 h、复氧3 h处理,5 000 r/min离心10 min,收集细胞上清液。以未经缺氧复氧处理的细胞为对照组,按试剂盒检测上清液中LDH活力,以每升上清液于37 ℃与反应基质作用15 min反应体系中产生 1 μmol丙酮酸为一个酶活力单位,单位为U/L。
1.3.6 蛋白免疫印记分析
细胞于10 μmol/L姜黄素溶液中分别暴露15、30 min和60 min。弃去细胞培养液,用PBS冲洗2 次,静置2 min,吸弃残留液体,重复吸取2 次,尽可能将液体全部吸出(全程冰上操作)。配制细胞裂解液(V(RIPA裂解液)∶m(100×磷酸酶抑制剂)∶m(100×蛋白酶抑制剂)=100∶1∶1)。每瓶细胞加入300 μL上述细胞裂解液,用细胞刮刀将培养瓶内细胞充分刮下至1.5 mL EP管中,用细胞超声破碎仪超声10 s,提取细胞中总蛋白。4 ℃、13 500 r/min离心15 min,取上清液用于后续实验。利用BCA法测定蛋白浓度。上样量80 μg,计算体积后将各组用RIPA裂解液补至相同体积,加入5×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液,将处理好的蛋白样品100 ℃加热5 min使蛋白变性。蛋白经10% SDS-聚丙烯酰胺凝胶电泳分离,再转移至硝化纤维膜上,5%脱脂牛奶封闭,加入Src、p-Src、Erk、p-Erk以及GAPDH等抗体作为一抗,4 ℃孵育过夜,含0.05% Tween-20的PBS清洗3 次,每次10 min,加入二抗(兔源性多克隆1∶10 000),室温避光孵育1 h。扫描仪扫描薄膜,用Odyssey 4.0软件分析条带灰度,以GAPDH作内参,计算各蛋白相对表达水平。
1.4 数据处理与分析
采用SPSS 26.0软件处理实验数据,结果用平均值±标准差表示。两组间比较用Student’s检验,多组间比较用单因素方差分析,P<0.05认为有显著差异。
2 结果与分析
2.1 姜黄素对Na/K-ATPase活力的影响
已有研究表明姜黄素可调节跨膜P型ATPase活力[7]。 由图1可知,与对照组(0 μmol/L)相比,0.1、1、10 μmol/L姜黄素可以显著降低Na/K-ATPase活力 (P<0.05、P<0.01、P<0.001),且呈剂量依赖性。姜黄素浓度为10 μmol/L时,Na/K-ATPase活力降低至对照组的69%。

图1 姜黄素对Na/K-ATPase活力的影响Fig.1 Effect of curcumin concentration on Na/K-ATPase activity
2.2 姜黄素对Na/K-ATPase构型的影响
研究表明,10 μmol/L姜黄素能够有效抑制马来酸诱导的LLC-PK1细胞氧化应激损伤[14],同时也可以通过调控Notch信号通路减轻心肌细胞缺氧复氧导致的氧化应激损伤[15]。因此,本实验选择10 μmol/L的姜黄素进行后续研究。Na/K-ATPase存在E1和E2两种构型,可以通过E1和E2构型间的转换来调节Na/K-ATPase/Src/Erk1/2信号通路。钒酸盐不能与E1构型结合,但能与E2构型结合,钒酸钠与Na/K-ATPase结合使其稳定在E2状态并由此抑制Na/K-ATPase活性。由图2可知,钒酸钠呈剂量依赖性降低Na/K-ATPase活力。而钒酸钠与姜黄素(10 μmol/L)共同处理可部分恢复Na/K-ATPase活力,表明Na/K-ATPase处于E2构型过度累积的状态时,姜黄素可使Na/K-ATPase从E2构型向E1构型转换,因此,姜黄素具有一定的双向调节功能。

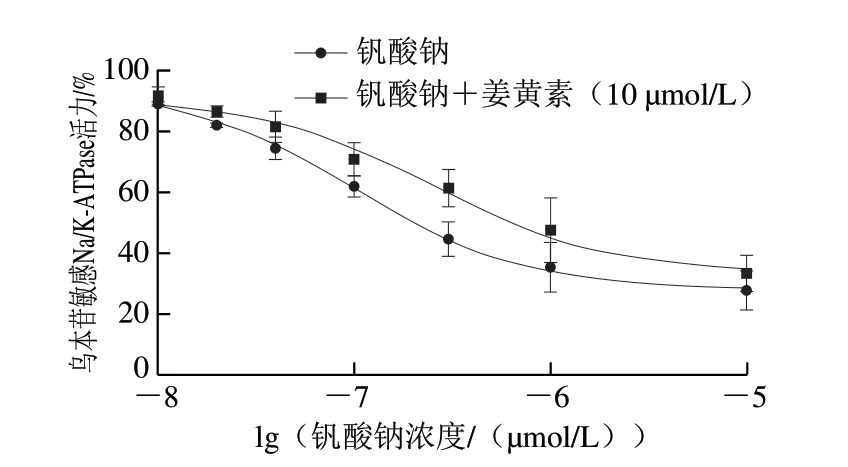
图2 Na/K-ATPase抑制剂存在时姜黄素对Na/K-ATPase活力的影响Fig.2 Effect of curcumin concentration on Na/K-ATPase activity in the presence of Na/K-ATPase inhibitors
2.3 姜黄素对Na/K-ATPase/Src/Erk1/2信号通路的调节作用
LLC-PK1细胞中Na/K-ATPase表达丰富,常被用于Na/K-ATPase/Src/Erk1/2信号通路研究。通过测定Src(Y418位点)和Erk1/2磷酸化水平,分析LLC-PK1细胞暴露于姜黄素后Na/K-ATPase/Src/Erk1/2信号通路中Src和Erk1/2活性变化,以未处理的正常细胞为对照组。由图3A、B可知,与未经姜黄素预处理的对照组(0 min)相比,LLC-PK1细胞于10 μmol/L姜黄素溶液中暴露15、30 min和60 min后,Src和Erk1/2磷酸化水平均显著升高(P<0.05),且没有明显的时间效应。有研究表明,乌本苷可诱导Na/K-ATPase/Src/Erk1/2信号通路激活[7]。由图3C、D可知,姜黄素显著抑制了乌本苷诱导的Src和Erk1/2磷酸化水平升高(P<0.05)。以上结果表明,姜黄素可能对Na/K-ATPase/Src/Erk1/2信号通路可能具有双向调节作用,即姜黄素单独存在时可激活Na/K-ATPase/Src/Erk1/2信号通路,而该通路被过度激活时,姜黄素抑制Na/K-ATPase/Src/Erk1/2信号通路活化。
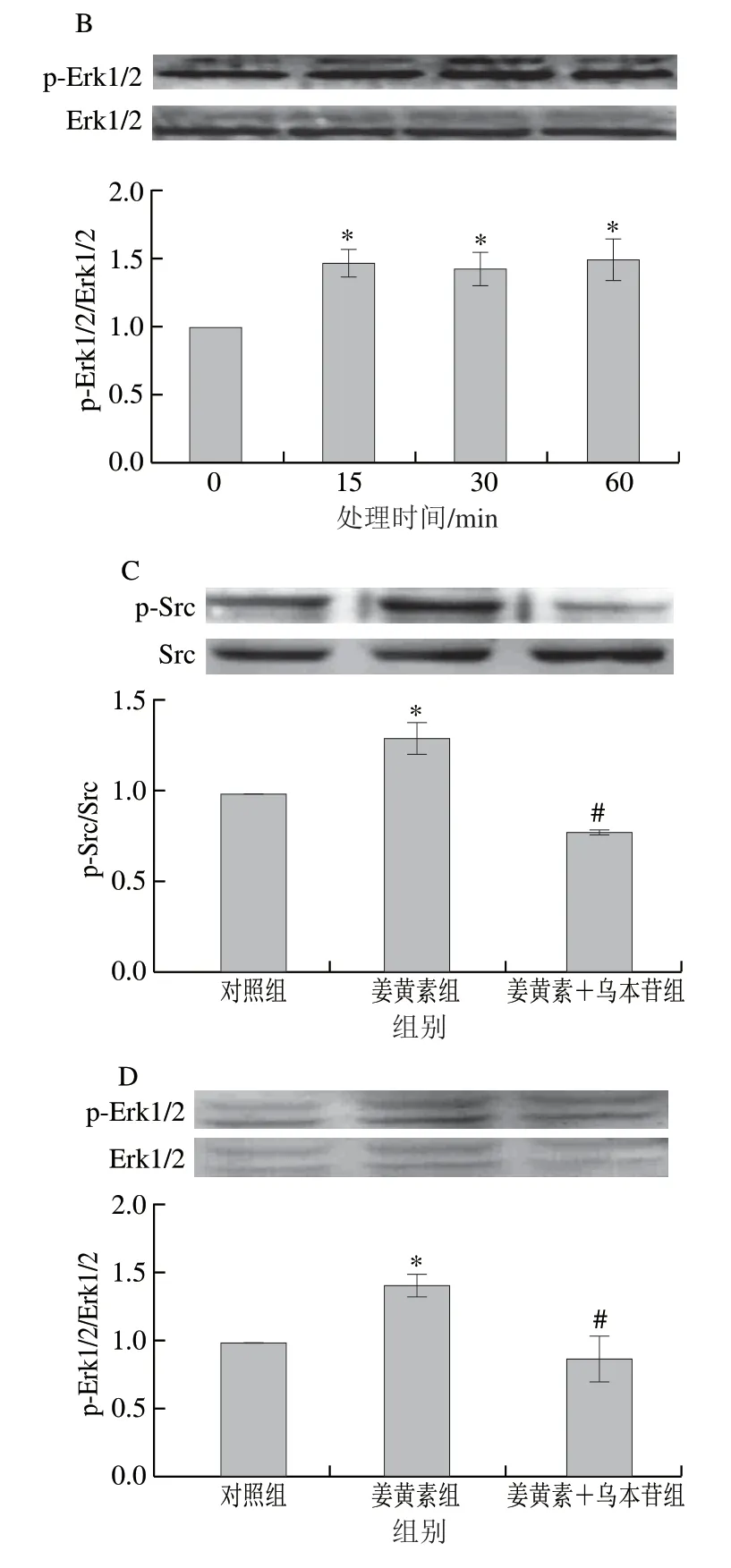
图3 姜黄素对Na/K-ATPase/Src/Erk1/2信号通路中Src和 Erk1/2磷酸化水平的调节作用Fig.3 Curcumin regulated the phosphorylation of Src and Erk1/2 proteins in the Na/K-ATPase/Src/Erk1/2 signaling pathway
2.4 姜黄素对H2O2诱导氧化应激LLC-PK1细胞存活率的影响
在细胞缺氧复氧时将产生大量ROS,诱导氧化应激损伤,本实验利用H2O2模拟氧化应激损伤。由图4可知,不同浓度H2O2作用LLC-PK1细胞24 h后,H2O2以剂量依赖的方式降低细胞活力,而经10 μmol/L姜黄素预保护1 h,可明显提高H2O2诱导的细胞存活率降低,表明姜黄素对H2O2诱导产生的氧化应激损伤具有保护作用。

图4 姜黄素对H2O2诱导氧化应激LLC-PK1细胞存活率的影响Fig.4 Effect of curcumin on cell viability of H2O2-induced LLC-PK1 cells
2.5 姜黄素对LLC-PK1细胞缺氧复氧损伤的保护作用
LDH是存在于动植物细胞质中的氧化还原酶,其在细胞中稳定表达,是机体能量代谢中一种重要的酶。当机体组织器官病变时,其组织内源性LDH活力发生改变,因此,可作为细胞毒性指标,常被用于评价组织和细胞的受损情况。由图5可知,与对照组正常细胞相比,缺氧复氧组LLC-PK1细胞释放LDH的量明显增多,细胞上清液中LDH活力高度显著增大(P<0.001),而姜黄素预保护组缺氧复氧诱导的LDH释放量增多明显被抑制,与缺氧复氧组相比差异极显著(P<0.01)。表明姜黄素能够保护缺氧复氧处理导致的细胞受损。

图5 姜黄素对缺氧复氧损伤LLC-PK1细胞中LDH活力的影响Fig.5 Effect of curcumin on extracellular LDH activity of LLC-PK1 cells subjected to H/R
2.6 姜黄素保护LLC-PK1细胞氧化应激损伤的可能机制
研究发现,ROS可以激活Na/K-ATPase/Src/Erk信号通路,并进一步促进ROS产生,扩大氧化损伤[16-17]。在细胞缺氧复氧过程中会产生大量的ROS(包括H2O2)。Cui Χiaoyu等[7]研究发现H2O2具有类似乌苯苷的作用,通过结合Na/K-ATPase E2构型抑制Na/K-ATPase活性并激活Src蛋白。由图6A可知,与对照组(未经缺氧复氧处理的细胞)相比,在细胞缺氧复氧过程中,Src蛋白磷酸化水平显著增加,而姜黄素预保护能够显著降低缺氧复氧导致的Src磷酸化水平升高(P<0.05)。由图6B可知,与对照组相比,缺氧复氧过程使磷酸化Erk1/2蛋白表达水平显著增加,而姜黄素预处理抑制了缺氧复氧诱导的Erk磷酸化水平升高(P<0.05)。以上结果表明,姜黄素可能是通过影响Na/K-ATPase/Src/Erk信号通路的活化保护LLC-PK1细胞免受缺氧复氧损伤。

图6 姜黄素对缺氧复氧损伤LLC-PK1细胞中Src(A)、 Erk1/2磷酸化(B)的影响Fig.6 Effect of curcumin on phosphorylation levels of Src (A) and Erk1/2 (B) in LLC-PK1 cells subjected to hypoxia/reoxygenation
3 讨 论
临床和营养流行病学研究表明,长期摄入多酚类物质姜黄素可以预防心血管疾病并降低引发心血管疾病的病理因素[18]。自发性高血压大鼠口服姜黄素12 周 能明显降低心脏左室中结缔组织生长因子、III型胶原蛋白、纤连蛋白的表达,并上调过氧化物酶体增殖物激活受体γ活性,从而缓解高血压引起的心肌纤维化[19]。心肌梗死过程中产生大量的氧自由基,诱导心肌细胞凋亡和炎症反应,损伤心脏组织[20-21],姜黄素的抗氧化功效可以减少体内产生的氧自由基,产生抗凋亡作用,抵抗心肌梗死诱导的心脏功能失调[22]。对猪冠状动脉血管内皮功能障碍的研究显示,姜黄素可以阻碍同型半胱氨酸诱导的内皮依赖血管舒张功能障碍,降低内皮型一氧化氮合酶水平,并减少超氧阴离子自由基的产生,从而缓解血管内皮功能失调[23]。这些功效表明,以姜黄素作为日常膳食的主要成分有助于预防心血管疾病的发生。
姜黄素的心脏保护作用可能在于其可以直接影响多种酶。已有研究表明,姜黄素可以调节P型ATPase活性。姜黄素通过抑制肌浆网上Ca2+-ATPase可以缓解胆囊纤维化[24-25]。Na/K-ATPase是维持心肌细胞内外离子浓度和心脏功能的重要酶[26],研究发现姜黄素可以与Na/K-ATPase发生直接的相互作用,因此姜黄素可能作为Na/K-ATPase的重要受体之一而发挥作用。本研究发现在Na/K-ATPase活性筛选反应体系中,姜黄素能明显抑制Na/K-ATPase活性,且表现出剂量依赖性。而当有Na/K-ATPase活性抑制剂钒酸钠存在时,姜黄素能促使Na/K-ATPase由E2构型向E1构型转变。表明姜黄素对Na/K-ATPase活性具有双向调节作用,是Na/K-ATPase的不完全促进剂。
心脏缺氧复氧过程中会产生大量ROS,其中的H2O2具有与乌本苷类似的作用,可抑制Na/K-ATPase活性,激活Na/K-ATPase/Src信号转导途径,进一步作用线粒体产生ROS[27-29]。本研究发现,姜黄素作为Na/K-ATPase不完全促进剂,对缺氧复氧过程导致的Na/K-ATPase/Src受体复合物的过度激活具有保护作用,即缺氧复氧诱导Na/K-ATPase/Src/Erk信号通路活化,使Src和Erk1/2磷酸化水平升高,而在该受体复合物被过度激活时,姜黄素则可以抑制其激活,从而发挥保护细胞损伤的作用[30]。
因此,本研究通过分析姜黄素对缺血再灌注引起的细胞损伤的保护作用以及姜黄素对细胞中Na/K-ATPase/Src信号转导途径的影响,阐明姜黄素作为不完全促进剂,通过调节Na/K-ATPase/Src/受体复合物活性保护细胞免受损伤。为评估姜黄素在治疗心血管疾病相关的营养膳食中的潜在效用、开发姜黄粗提物及其他姜黄中的有效化合物成分作为营养膳食提供了依据。

