重组酿酒酵母生物合成菜油甾醇
周武林,高惠芳,吴玉玲,张显,徐美娟,杨套伟,邵明龙,饶志明
(江南大学生物工程学院,江苏无锡 214122)
引 言
近年来,甾体药物因具备良好的抗炎、抗过敏和避孕等作用而备受生物医药行业的高度重视[1]。菜油甾醇是甾体药物(孕酮、雄烯二酮、氢化可的松等)的一种重要合成前体,也是植物来源的主要甾醇之一[1-2]。其与动物来源的主要甾醇(胆固醇)的结构仅在C24位多出一个甲基,与微生物来源的主要甾醇(麦角甾醇)的区别在于C7~8和C22~23位是饱和单键。因此,这为微生物法生产菜油甾醇提供了可行性的理论基础[3]。
目前,甾体类药物主要通过化学合成和生物催化两种主要方式进行生产[4-7]。由于化学合成法会造成严重的环境污染且中间步骤复杂,因此,生物催化因其绿色环保且反应过程简易而受到了极大的关注[8]。然而,由于甾体类药物及其中间体水溶性较差,难以进出细胞被利用,造成了生物催化生产甾体类药物的较低生物转化率。虽然有添加助溶剂以及将底物溶解于有机溶剂中进行添加等方法来提高微生物对底物的利用率,但转化率仍然不是很高[9-11]。已知酵母细胞体内存在着一条天然的甾醇合成途径(图1),因此可作为合成甾体药物的优良底盘细胞,以通过微生物发酵法生产甾体药物。其中酿酒酵母作为公认的模式安全(GRAS)生物,对低pH和发酵抑制剂有很高的耐受性,因此酿酒酵母被认为是生产生化试剂的首选底盘细胞[12]。除此之外,酿酒酵母作为容易操作的真核细胞生物之一,对其生理和代谢拥有丰富的知识以及现有的各种可实用的基因组遗传操作系统(如:目前最高效的CRISPR-CAS系统),为酿酒酵母的工程化改造提供了坚实的基础[13-15]。研究表明,菜油甾醇可以取代麦角甾醇成为酵母中的主要甾醇,其生物膜活性不受影响[16]。目前,已有文献报道在酿酒酵母体内成功构建了氢化可的松,皮质酮以及孕酮等多种甾体物质的从头合成[2]。此外,有文献报道在解脂耶氏酵母体内通过导入外源的7-脱氢胆固醇还原酶DHCR7(7-dehydrocholesterol reductase DHCR7)和敲除C-22甾醇去饱和酶Erg5(C-22 sterol desaturase Erg5),来使麦角固醇的C7~8位以及C22~23位的双键饱和,构建了一条菜油甾醇生物合成途径(图1)[17-18]。但是,目前酵母体内生物合成甾体药物仍然处于一个低水平状态。
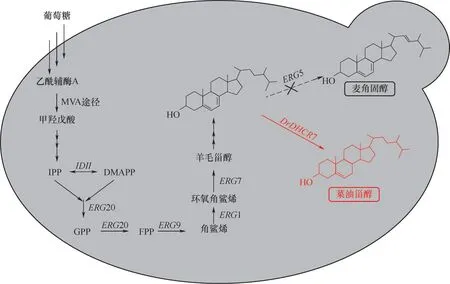
图1 酿酒酵母体内菜油甾醇生物合成途径Fig.1 The biosynthetic pathway of campesterol in Saccharomycescerevisiae
本研究中,首先采取了多样性酶来源的筛选策略,通过同源性分析和序列比对,得到了75种不同来源的DHCR7,再从中随机挑选了10种来源的DHCR7采用CRISPR/Cas9基因编辑技术将ERG5基因替换成DHCR7基因来构建菜油甾醇合成途径的同时解除麦角固醇竞争途径,进而构建一条高效的菜油甾醇合成途径。然后,结合启动子优化以及增加DHCR7表达盒在基因组中的拷贝数的方式,提高DHCR7在酵母体内的表达水平以构建一株高产菜油甾醇的酵母细胞。最终采用补料分批发酵策略,菜油甾醇产量达到了916.88 mg/L。本实验结果,为后续的甾体类药物的生物合成提供了一个很好的平台,也为其他化学药物的生物合成提供了科学理论参考。
1 实验材料和方法
1.1 材料
1.1.1 菌种、质粒及培养基 本研究使用的所有菌株和质粒均列在表1中,大肠杆菌所用的培养基为Luria-Bertani(LB):蛋白胨10 g/L、酵母粉5 g/L、氯化钠10 g/L。酵母细胞的生长培养基为YPD:10 g/L酵母膏、20 g/L蛋白胨、20 g/L葡萄糖。诱导培养基为YPG:10 g/L酵母膏、20 g/L蛋白胨、20 g/L半乳糖。营养缺陷型筛选培养基为SC-URA。配制固体培养基时加入2%的琼脂粉。5 L发酵罐发酵培养基:10 g/L酵母膏、20 g/L蛋白胨、50 g/L葡萄糖。补料培养基:5 g/L酵母膏、10 g/L蛋白胨、400 g/L葡萄糖。
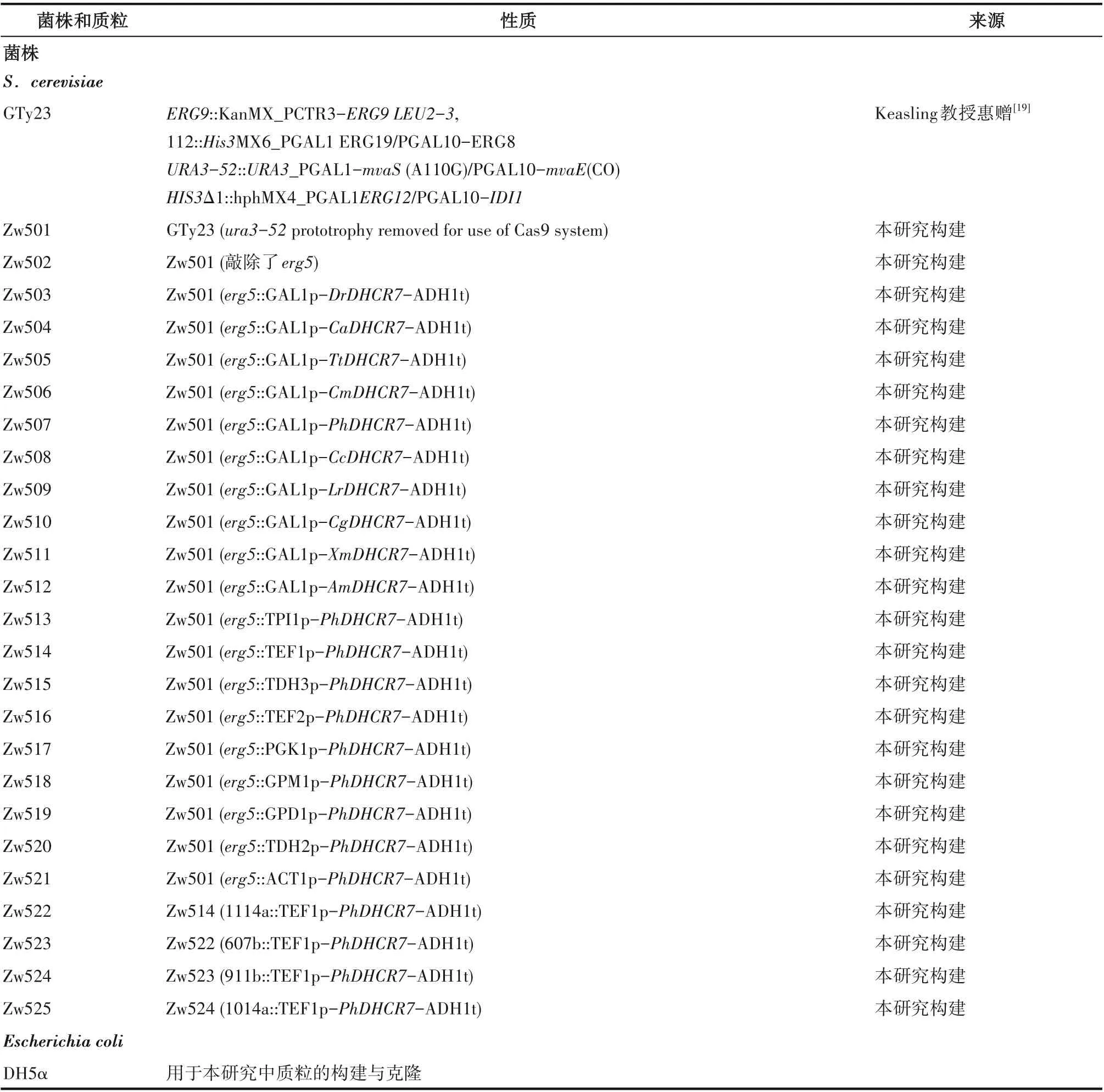
表1 本研究所有菌株和质粒Table 1 Strains and plasmids used in this study

续表1Table 1 continued
1.1.2 基因和引物 本实验中所使用的DHCR7基因分别来源于Carassius auratus(XP_026124274.1),Pangasianodonhypophthalmus(XP_026786162.2),Triplophysa tibetana(KAA0723749.1),Labeo rohita(RXN17635.1),Danio rerio(NP_958487.2),Cyprinus carpio(XP_018972396.1),Colossomamacropomum(XP_036442229.1),Astyanaxmexicanus (XP_007254692.2),Cottoperca gobio(XP_029284590.1)和Xiphophorus maculates(XP_005812111.1),分别经酿酒酵母密码子优化后,由苏州金唯智生物科技有限公司合成并连接到pET-28a质粒中,本实验中的扩增基因整合片段时所使用的引物序列均由网站软件工具CASDesigner(http://casdesigner.jbei.org)在线生成。所使用的引物如表2所示。
1.1.3 主要试剂 DNA聚合酶、T4DNA连接酶和限制性核酸内切酶购于大连宝生物生物工程有限公司;用于DNA片段纯化和质粒提取的mini DNA快速纯化试剂盒和质粒miniprep试剂盒购于上海捷瑞生物工程有限公司,Ultrapure RNA Kit超纯RNA提取试剂盒购自康为世纪。菜油甾醇、胆固醇、麦角固醇以及正己烷均为色谱纯购于Sigma公司;其他试剂购自于国药集团。
1.1.4 主要仪器 PCR仪,德国Eppendorf公司;UVP凝胶成像仪,上海天能;核酸电泳系统,北京市六一仪器厂;蛋白电泳系统,美国Bio-Rad公司;赛默飞U3000高效液相色谱仪,美国赛默飞世尔科技有限公司;恒温振荡金属浴,上海一恒科技有限公司;氮吹仪,杭州米欧仪器有限公司。
1.2 方法
1.2.1 遗传操作方法 根据先前报道的酵母基因编辑方法,在Cas9蛋白辅助作用下同源重组整合或者敲除指定基因[20]。通过使用CASdesigner生成的引物来PCR扩增供体DNA片段,以构建一个整合的表达盒(通常包含两个1 kb侧翼同源区,启动子,基因序列和终止子),该盒包含靶向所选基因组位点的1 kb侧翼同源区域,然后与靶向该基因的Cas9-gRNA质粒(pCut)共转化进入酵母细胞。此外,CASdesigner所设计的引物在片段之间会提供30~60 bp的同源臂,因此,在酵母体1~5个单独的片段可以进行同源重组自组装。靶向基因组基因座的pCut质粒是从线性骨架和包含新gRNA序列的线性PCR片段体内组装而成的。新的sgRNA由在线sgRNA设计工具(http://yeastriction.tnw.tudelft.nl/#!/)所产生。
1.2.2 酿酒酵母细胞感受态的制备和转化 酿酒酵母转化根据先前报道描述的方法进行[20]。将新鲜过夜培养的酵母细胞接种到2×YPD培养基至OD600为0.2,在30℃,200 r/min条件下培养至OD600为1.0。然后,收集5 ml培养液于8000 r/min离心5 min,加入2.5 ml的H2O洗涤两次。使用含有供体DNA片段(2μg)和pCUT质粒(0.25 ng)的50μl水溶液对细胞沉淀进行重悬,加入至转化反应液(260μl 50%PEG3350、36μl 1 mol/L LiOAc,10μl ssDNA,4μl H2O)中混合。将混合液在42℃温育40 min,并通过以6000 r/min离心1 min收集沉淀。细胞沉淀重悬于500μl H2O中,然后取100μl H2O在选择性琼脂平板(SC-U)上涂布均匀。通过测序验证整合的结果,挑取正确的菌落在消除质粒后用于下游实验操作。
1.2.3 产菜油甾醇重组酵母菌株的发酵培养 将甘油管中的重组酵母菌在YPD固体平板上划线活化,生长48 h后。挑取单菌落接入10 ml/50 ml的小瓶液体YPD种子培养基中,30℃、200 r/min条件下培养24 h。然后,以2%的接种量转接至50 ml/250 ml的液体YPD培养基中,30℃、200 r/min条件下发酵48 h,接着收集细胞转移至50 ml/250 ml的液体YPG培养基中进一步发酵96 h。收集细胞,进行菜油甾醇的提取与检测。
将单菌落接种于10 ml一级种子培养基中,30℃、200 r/min培养24 h,再以5%的接种量接入至100 ml二级种子培养基中,30℃、200 r/min培养24 h,10%的接种量接种于2 L发酵培养基中。控制5 L发酵罐中发酵参数,温度、pH、通气量及搅拌速率分别控制在30℃、5.5、2 m3/(m3·min)和500 r/min。监测发酵液中残糖量,待培养基中葡萄糖消耗完毕,开始补加半乳糖,待半乳糖快消耗完时立即补加至40 g/L,直至发酵结束。葡萄糖含量用生物传感分析仪SBA-40E进行测定,半乳糖含量用HPLC法进行检测:视差检测器RID,色谱柱为氰柱,柱温80℃,流动相为超纯水,流速0.6 ml/min,检测温度55℃。
1.2.4 菜油甾醇的提取与检测 取1 ml菌液离心收集细胞,加入2 ml皂化反应液(20%KOH-50%C2H5OH)且加入100μl 1 g/L胆固醇作为内标,置于85℃温浴2 h。待反应结束后,加入6 ml正己烷充分振荡萃取,取上层萃取液于氮吹仪中用氮气吹干,加入1 ml色谱级甲醇复溶。经0.22μm膜过滤后,通过ThermoFisher HPLC分析,色谱柱为Diamonsil C18,5μm,250 mm×4.6 mm,检测器为紫外检测器。在205 nm处检测到菜油甾醇和胆固醇,流动相纯甲醇组成;流速为1 ml/min,柱温为30℃。
1.2.5 RNA提取和实时荧光定量PCR分析 取1 ml菌液离心收集细胞,加入600μl山梨醇缓冲液(以0.1 mol/L磷酸钠缓冲液配制1.2 mol/L山梨醇溶液)并加入10μl蜗牛酶,进行30℃破壁处理30 min。然后再根据相应的RNA提取试剂盒(CW2581s)提取酵母RNA。将已提取好的mRNA反转录成cDNA,再将cDNA的浓度稀释至20 ng/μl作为模板,利用SYBR®Green I试剂进行Real Time PCR,内参基因选择ACT1。RT-qPCR所用引物如表2所示。

表2 本研究所用引物Table 2 Primers used in this study
2 结果与讨论
2.1 菜油甾醇生产菌株的构建
2.1.1 脱氢胆固醇还原酶DHCR7生物多样性分析DHCR7作为菜油甾醇合成途径的关键酶,可还原于麦角甾-5,7-二烯醇的C7~8位的双键生成菜油甾醇。目前已有文献报道,根据来自Methylomicrobium alcaliphilum20Z的同源蛋白Δ14-甾醇还原酶(MaSR1,PDB登录号4quv)的晶体结构,建立了Human,Rallus norvegicus和Oryza saliva等多种来源的DHCR7的结构模型[17,21]。DHCR7包含十个螺旋,其中九个(1~9螺旋)据报道是跨膜片段[22],在MaSR1和DHCR7两种蛋白与NADPH结合的残基是完全保守,基于该模型可知,DHCR7的第6~10个螺旋分别包裹了两个相互连接的口袋,被认为是用于NADPH和疏水性甾醇底物的结合[17,23]。
酵母细胞体内构建异源途径时,从多样性来源筛选高效酶是提高异源途径生产力的有效策略。据目前文献报道,来自D.rerio的DHCR7已被证明是目前最高效的菜油甾醇作用酶[18]。在本研究中,为了能够进一步筛选出更加高效的作用酶,以DrDHCR7为基础进行了生物信息学分析以及同源性比对(图2)[24]。发现DrDHCR7与来源于C.auratus等75种物种中的DHCR7高度同源,同源性高达78.83%~93.10%。因此,本研究从中选择了C.auratus(同源性92.68%),C.carpio(同源性93.10%),T.tibetana(同源性91.37%),L.rohita(同源性92.26%),P.hypophthalmus(同源性82.64%),C.macropomum(同源性86.40%),A.mexicanus(同源性85.77%),C.gobio(同源性80.71%),X.maculatus(同源性79.87%)9种不同物种来源的DHCR7进行本研究的后续实验,以期筛选出最佳的DHCR7用以构建高效菜油甾醇生产菌株。
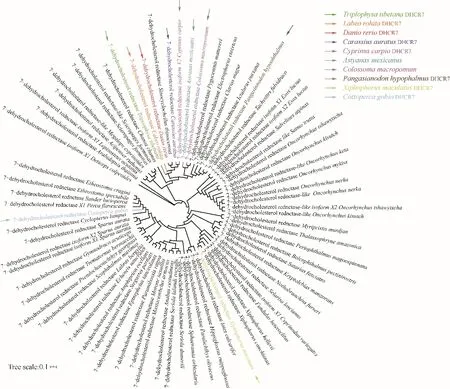
图2 多样性来源的DHCR7进化树Fig.2 DHCR7 evolutionary tree fromdiverse sources
2.1.2 菜油甾醇合成途径的构建 在酵母细胞整个甾醇的合成途径中,角鲨烯是极为重要的前体物质(图1),对后续甾醇物质的合成起着至关重要的作用[25-26]。因此,在本研究中,选择了角鲨烯高产菌株GTy23作为本实验出发菌株,由先前文献所报道该菌株是S.cerevisiaeBY4742经基因改造所获得的,该菌株提供了丰富的角鲨烯前体,这也为菜油甾醇的高水平合成提供了良好的前提条件[19]。在酵母体内,内源麦角固醇合成途径是外源菜油甾醇合成途径的竞争分支途径(图1),为了减少分支途径的竞争,本研究采用了CRISPR/Cas9技术,将S.cerevisiae内源ERG5基因替换成不同来源的DHCR7基因[图3(a)],最终构建得到整合有不同来源DHCR7的菜油甾醇生产菌株。经YPD摇瓶发酵验证,结果如图3(b)所示,含有PhDHCR7的菌株Zw507表现出了最高的菜油甾醇的产量216.93 mg/L,比菌株Zw503(整合了DrDHCR7)的产量167.91 mg/L提高了29.2%(**p≤0.01)。另外,菌株Zw506(整合了CmDHCR7)和Zw509(整合了LrDHCR7)也表现出了较高的菜油甾醇产量,但相比于菌株Zw507仍然存在很大的差距,因此,菌株Zw507被选择作为后续实验操作的起始菌株。
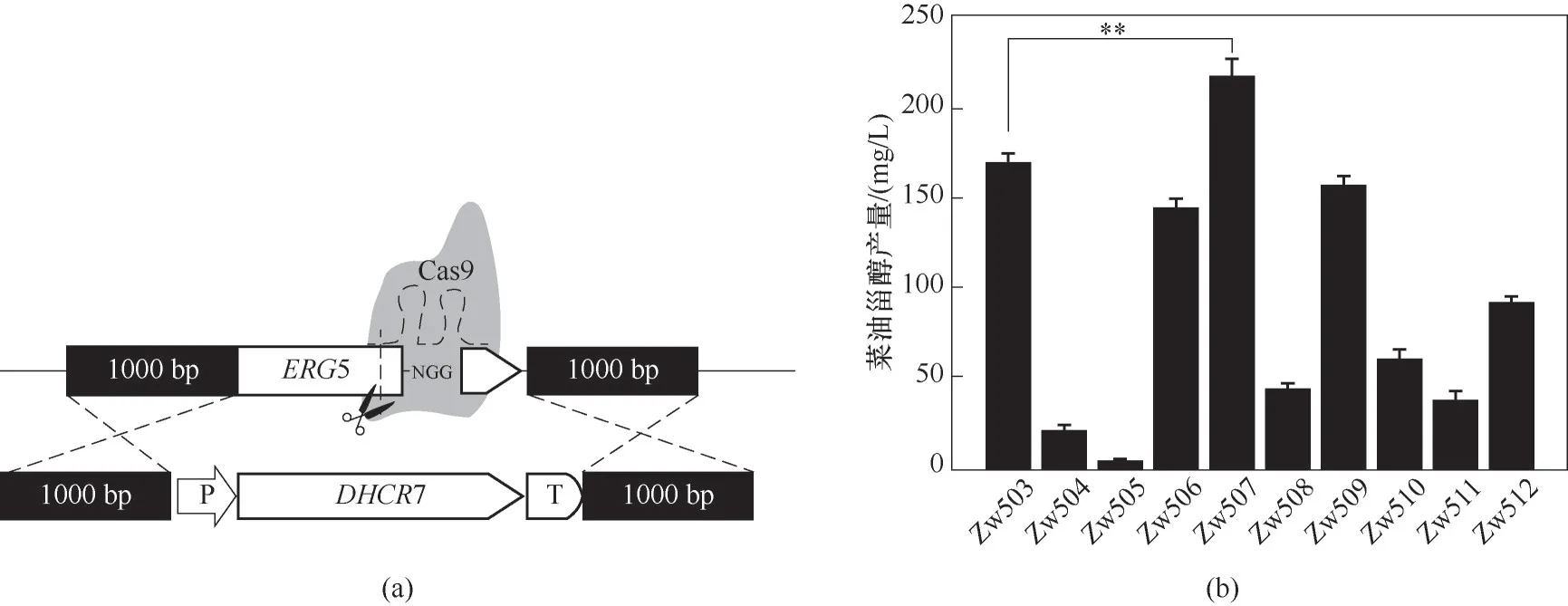
图3 重组菌株的构建(a)以及不同物种来源的DHCR7菜油甾醇产量(b)(**与对照菌株比较p≤0.01;由t检验确定,下同)Fig.3 The construction of recombinant strains(a)and the production of DHCR7 campesterol from different species(b)(**p≤0.01 compared with the control strain;as determined by t test.The same below)
2.2 酵母细胞体内DHCR7表达水平的优化
2.2.1 通过筛选不同启动子来增加菜油甾醇的产量 在异源基因表达过程中,启动子是转录调控的重要组成部分,其活性会显著影响异源基因转录的起始、持续时间和表达程度,从而影响外源基因在宿主中的转录效率,同时对细胞中mRNA的总体丰度和蛋白质含量起着决定性作用,最终影响目标产物的合成[27]。为了能够精准调控DHCR7的相对表达水平以进一步提高菜油甾醇的合成水平,本研究筛选了10种启动强度较强的酵母内源性启动子(PGK1p、GPM1p、TDH3p、TEF1p、TPI1p、GPD1p、TEF2p、ACT1p、GAL1p和TDH2p)与DHCR7基因进行组合[图4(a)][28-30]。通过荧光定量PCR技术对其进行转录水平监测,发现原始启动子GAL1p控制下的DHCR7表现出相对较高的转录水平,但在TEF1p启动子控制下表现出了最高的转录水平,比GAL1p启动子控制下的转录水平提高了1.21倍(**p<0.01),是TDH2p启动子和GPD1p启动子控制下表达水平的14.7倍和6.42倍[图4(b)]。摇瓶发酵检测,DHCR7的转录水平与菜油甾醇的产量大体趋势一致,菌株Zw514(TEF1p启动子控制的PhDHCR7基因)的菜油甾醇产量能够达到253.35 mg/L,比对照菌株Zw507(GAL1p启动子控制的PhDHCR7基因)的产量高出了16.8%(**p<0.01)[图4(c)]。此外,比菌株Zw520(TDH2p启动子控制的PhDHCR7基因)和菌株Zw519(GPD1p启动子控制的PhDHCR7基因)的菜油甾醇产量分别高出了400.13%和322.2%。因此,菌株Zw514被选择来进行后续的实验操作。

图4 不同启动子与PhDHCR7基因组合的示意图(a)、PhDHCR7表达量(b)以及菜油甾醇产量(c)Fig.4 Schematic diagram(a),PhDHCR7 expression(b)and campesterol production(c)of combinations of different promoters and DHCR7 genes(**p<0.01)
2.2.2 增加DHCR7在酵母基因组上的拷贝数来提高菜油甾醇的产量 据上述结果分析,菜油甾醇的产量与PhDHCR7表达量大致呈正比,因此,猜想PhDHCR7的表达量可能是菜油甾醇高产的一个限制性因素。为了进一步提高其表达量,本研究通过图5(a)所示的方法来增加PhDHCR7表达盒在酵母基因组中的拷贝数,进而提高菜油甾醇的产量。摇瓶发酵结果显示[图5(b)],随着PhDHCR7表达盒的拷贝数增加,菜油甾醇的产量也在逐渐提高,但当拷贝数增加至3个拷贝时,菌株Zw523达到了最高的菜油甾醇产量302.27 mg/L,比菌株Zw514的产量提高了19.31%(**p<0.01),且再增加其拷贝数也对菜油甾醇的产量并无影响。同时,虽然PhDHCR7表达盒拷贝数不断地增加,但这并没有对细胞造成显著伤害。因此,PhDHCR7的过表达并未对酵母细胞造成过重的负担,限制菜油甾醇产生的很大可能因素是中间前体供应不足。虽然所选的出发菌株能够高产角鲨烯,但是甾醇后期合成途径中反应酶共计13个[31-32],一方面由于中间部分酶属于限速酶(如ERG1、ERG6和ERG11等)导致部分甾醇中间体积累不足[33-35];另一方面,酿酒酵母体内甾醇后期合成途径中存在其他的竞争分支途径也会消耗部分中间体[31]。因此,选择了菌株Zw523进行后续的发酵优化。
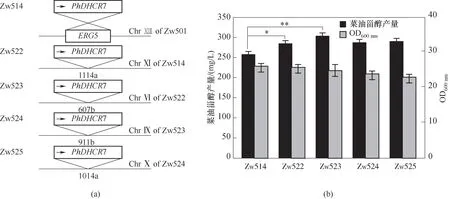
图5 PhDHCR7表达盒的多重拷贝数菌株的示意图(a)以及菜油甾醇产量(b)Fig.5 Schematic diagram(a)and campesterol production(b)of the multiple copy number strain of PhDHCR7 expression cassette(**p<0.01,*p<0.05)
2.3 重组酿酒酵母菌株的高密度发酵
本研究中,通过代谢工程手段构建了高产菜油甾醇的重组菌株Zw523,该菌株比原始生产菌株Zw503的菜油甾醇产量提高了80.02%。为了进一步提高菜油甾醇的产量,本研究在5 L生物反应器中,根据补料分批发酵的策略对菌株Zw523进行高细胞密度发酵。Zw523菌株的发酵分为两个阶段,在第一阶段以葡萄糖作为生长碳源。初始的葡萄糖浓度为50 g/L,在发酵30 h后,葡萄糖几乎被消耗完全。此时,开始进入第二阶段,由于葡萄糖可以抑制半乳糖的诱导,因此在葡萄糖耗尽后添加半乳糖以诱导Zw523菌株中MVA途径中内源酶的高表达进而促进菜油甾醇高效合成。在30 h后,开始往发酵罐中投加半乳糖补料培养基,并当半乳糖快消耗完时不断补加半乳糖,持续发酵144 h,最终菜油甾醇的产量达到了916.88 mg/L(图6),其生产强度为6.37 mg/(L·h)。
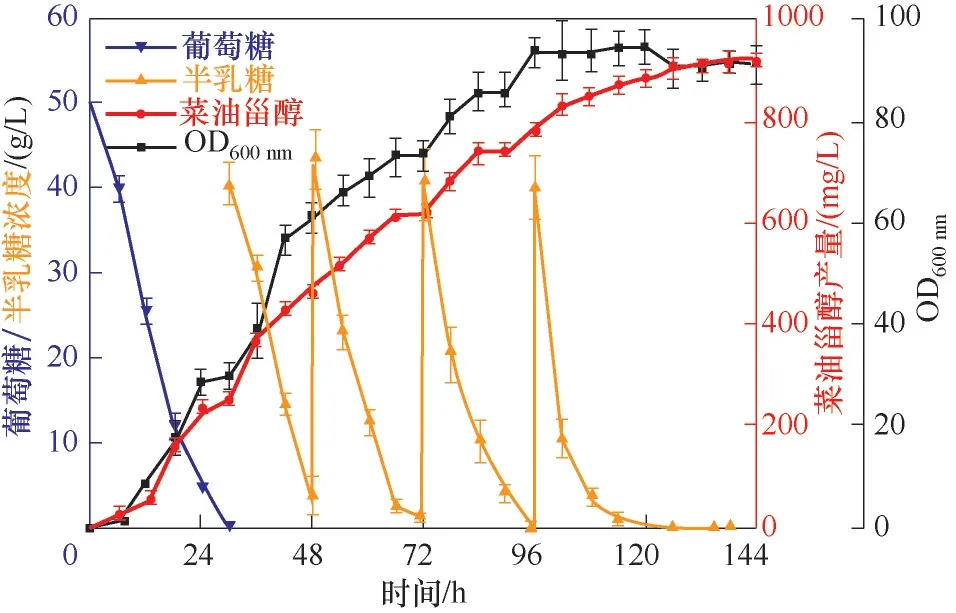
图6 重组酿酒酵母Zw523的补料分批发酵Fig.6 Fed-batch fermentation of recombinant Saccharomyces cerevisiae Zw523
3 结 论
本研究中,通过生物信息学分析及同源性比对,获得了75种不同来源的DHCR7,并从中随机筛选了10种不同物种来源的DHCR7。利用CRISPR/Cas9技术将内源ERG5基因替换成多种来源的DHCR7基因,敲除内源麦角固醇分支合成途径,成功构建了高效的菜油甾醇合成途径。通过摇瓶发酵,筛选出了最佳物种来源P.hypophthalmus的DHCR7。菌株Zw507达到了216.93 mg/L的菜油甾醇产量,比目前文献中所报道的携带Danio reriol来源DHCR7的菜油甾醇生产菌株Zw503的产量提高了29.2%。ⅩⅢ
然后,为了提高DHCR7在酵母细胞中的表达水平,选择了10种酵母内源性启动强度较强的启动子来组合PhDHCR7。通过摇瓶发酵以及荧光定量PCR分析,发现启动子TEF1p表现出最强的启动能力,菌株Zw514能够达到最高的菜油甾醇产量253.35 mg/L。为了进一步提高DHCR7在酵母体内的表达水平以提高菜油甾醇的产量,本研究增加了DHCR7基因表达盒的拷贝数。结果显示,当拷贝数增加至3时,菌株Zw523达到最高的菜油甾醇产量302.27 mg/L。最终,通过5L发酵罐对重组菌株Zw523进行补料分批发酵,菜油甾醇的产量达到了916.88 mg/L,其生产强度为6.37 mg/(L·h)。
本研究成功构建了一株高产菜油甾醇的酿酒酵母重组菌株,该菌株可作为后续的其他甾体药物(孕烯醇酮、孕酮、氢化可的松)生物合成的底盘细胞。同时,本研究也为其他化学药物的生物合成提供了理论指导。

