可降解神经套接管制备及临床试验流程专家共识*
中国医学装备协会医用增材制造专业委员会
李慈1# 齐大虎2# 张蒙1# 袁博3# 朱皓2# 肖骏2* 康皓2* 方忠2* 赵宇4* 胡懿郃5* 戴红莲6* 周钢7* 张培训1*
周围神经损伤是一种常见的临床疾病,创伤、肿瘤以及先天性疾病都可以导致不同程度的感觉和运动功能障碍[1-3],且患者恢复缓慢。此外还有诸如神经性疼痛等继发性并发症,导致患者生活质量下降,从而给患者造成巨大的生理、心理和经济负担[4]。如何有效治疗周围神经损伤是目前我国健康领域亟待解决的重大公共卫生问题。
寻求更优的神经修复方法,是提高周围神经损伤修复效果的关键因素之一。为解决这一难题,众多研究热点关注应用组织工程学方法制成神经套接管对损伤神经进行桥接修复,以期替代延续近百年的神经外膜缝合方法,从而降低供体部位出现的并发症和对免疫抑制剂的需求[5]。但是周围神经套接管临床研究尚在摸索阶段,缺乏相应的临床科研应用流程和使用规范。因此,北京大学人民医院联合华中科技大学同济医学院附属同济医院、中国医学科学院北京协和医院、中南大学湘雅医院、武汉理工大学、天津市医疗器械质量监督检验中心等多单位和多学科的专家合作,针对“可降解神经套接管制备及临床试验流程”达成本共识。本共识以现有国内外研究证据和临床实践经验为依据,建立合理和规范的神经套接管修复周围神经损伤(横断伤、切割伤,以及<2 mm的神经缺损)的临床科研应用流程,为临床医师研发和使用神经套接管修复周围神经损伤提供建议和指导。本专家共识将整个流程分为两个部分,分别为可降解神经套接管修复周围神经损伤的“制备流程”和“临床试验流程”。
1 制备流程
可降解周围神经修复套接管的制备流程可以分为了解临床需求、植入物设计、植入物制备、产品相关法规要求4个环节。作为临床应用的特殊产品,需要对这4个环节进行相应的质量控制。其具体流程如图1所示。
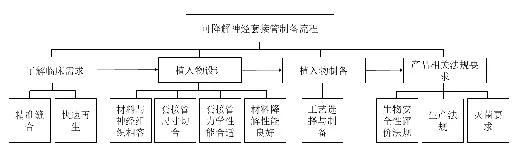
图1 可降解神经套接管制备流程
1.1 了解临床需求
周围神经损伤后神经纤维发生断裂,术后神经功能恢复有赖于同类神经纤维有效对接[6]。目前,神经外膜缝合是临床上治疗神经横断伤、切割伤、微小缺损的最常用手术方式,但在此手术方式应用过程中,很难确保吻合部位感觉、运动神经纤维的准确对接,进而影响手术修复神经损伤的效果[7]。神经损伤后近端再生轴突能够识别远端神经,并与自身神经类型相匹配的远端轴突趋向性选择连接,进而向相应的靶器官生长。研究证明,使用周围神经生物套接管进行小间隙套接缝合可以有效地减少断端神经瘤的发生,并在近端神经的选择性再生、不同类型神经纤维的准确对接、远端靶器官的功能恢复方面,均取得了良好的效果。同时不需要对供体神经进行电缆式缝合或对受体端进行过度修剪,减少了操作难度及手术时间[8]。在此基础上设计开发周围神经套接管产品,满足提供神经选择性生长微环境的同时,待神经修复后可在患者体内逐渐降解吸收。
1.2 植入物设计
周围神经套接管的设计应满足以下要求:①植入材料的生物安全性;②能保证周围神经套接管两端与损伤神经的有效缝合,并保留适当间隙;③与植入部位周围神经组织相近的力学性能;④在神经复原之后可以被降解吸收。
周围神经套接管的制作材料应具有良好的生物相容性。壳聚糖由于具有良好的生物相容性和和可降解性[9],符合作为可降解周围神经套接管的主要基材标准。为了使产品具有更好的生物相容性,建议选择动物源性材料壳聚糖作为产品的主要原材料。壳聚糖本身并无免疫原性,只存在残留蛋白质引发的免疫原性风险,通过检测蛋白残留量的方法控制产品免疫原性。
由于本产品应用于横断伤、切割伤、微小缺损的神经损伤,产品应可以提供神经选择性生长的间隙距离。神经套接管的规格应切合人体周围神经实际尺寸,并在达到缝合标准的同时,尽量减小套接管的尺寸。因此将神经套接管直径设计为2 mm、3 mm、4 mm、5 mm、6 mm共5种不同规格,同时神经修复时断裂神经近端和远端需要保留2 mm间隙,以及应保留足够的缝合空间(两端各4 mm),因此神经套接管长度为10 mm。
周围神经套接管为神经恢复提供所需的相对稳定的三维空间,要求神经套接管在神经复原之前既要保证合适的刚度以抵御周围组织的压迫、在神经再生过程中能维持形状不塌陷,又须具有合适的弹性与韧性以保证能适应一定的活动范围。神经套接管在缝合过程中与体内受到的机械力主要是轴向神经牵拉的力量和径向软组织的挤压力,故而套接管的刚性与韧性是套接管设计力学层面的主要考量指标。
周围神经再生速度为1~2 mm/d,完成缝合后,近端再生神经再生至靶器官并恢复至最佳功能一般需要约3个月。体内植入的神经套接管要求在3~6个月内应该维持较完整的外形、韧性和强度,因此神经套接管的50%降解周期应大于6个月。
1.3 植入物制备
现有的周围神经套接管制备工艺多样,常见的制备工艺有增材制造工艺、编织工艺以及铸造工艺。根据既往研究与临床经验,本专家共识以铸造工艺为例,以壳聚糖为神经套接管制备材料,在神经套接管的多工艺制备以及应用方面,提供实用性建议。
首先,在制备周围神经套接管时,根据YY/T1699-2020《组织工程医疗器械产品 壳聚糖》[10]对原材料进行质量控制,使壳聚糖具有合适的黏度和乙酰化程度。壳聚糖溶液需注入到模具中进行定型,将定型后的壳聚糖溶液进行固化和乙酰化(见图2)。

图2 壳聚糖乙酰化反应过程
制备出的周围神经套接管具有较为光滑的表面轮廓、结构完整,可弯曲、形变后可复原的性能(见图3)。其力学性能与神经套接管内壁直径有关,如图3所示套接管长度为10 mm,内壁直径为5 mm,其断裂强力不低于20 N。

图3 周围神经套接管示意图:A.周围神经套接管表面光滑,结构完整;B.周围神经套接管具有一定弹力性能;C.周围神经套接管中空
乙酰化后的壳聚糖在体内降解是通过酶的作用实现的[11]。酶降解乙酰化的壳聚糖时,使产品分子中的1,4糖苷键断裂,生成寡糖,进而被机体吸收、代谢。本产品设计肌肉间隙植入降解50%的时间大于6个月。
1.4 产品相关法规要求
1.4.1 生物安全性评价法规
植入物需要对产品的生物相容性进行评价。按照《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》[12]中的系统方法框图及《食品药品监管局印发医疗器械生物学评价审查指南》(国食药监械〔2007〕345号)[13]中的审查要点进行风险评价,当缺乏相关数据时,应进行必要的生物相容性试验。建议内容包括但不限于:体外细胞毒性、遗传毒性、急性全身毒性、皮肤致敏反应、皮内致敏反应、亚慢性刺激等[14-19]。
1.4.2 生产法规
周围神经套接管生产厂家应满足《医疗器械生产质量管理规范》[20],具有CMA/CNAS认证检测资质的第三方机构对每批次的产品进行抽样检测,包括外观、尺寸、力学性能(断裂强力、裂伸长率、缝线牵拉强度和径向抗压力)、有机助剂残留量、灰分、酸碱度、还原物质(易氧化物)、重金属总含量、蒸发残渣、紫外吸光度、细菌内毒素、无菌试验、热原试验、乙酰化程度、干燥失重、吸水率、溶解性、体外降解、蛋白质残留量、傅立叶变换红外吸收光谱(FTIR)。认为产品合格并出具相应检测报告后,该批次的产品方可进入临床使用。周围神经套接管内植物应满足生产法规包括:YY/T 0287-2017《医疗器械 质量管理体系 用于法规的要求》[21]。
1.4.3 灭菌要求
植入物材料需达到无菌标准。在神经套接管生产期间,根据《动物源性医疗器械注册技术审查指导原则》[22]的要求,选用原核、真核病毒对两步生产工艺进行病毒灭活有效性验证,证明生产工艺可以使病毒滴度下降超过6 Log。
植入物制成后,需要对其进行灭菌处理。环氧乙烷灭菌法是一次性医疗器械的主流灭菌方法[23],但由于可降解套接管需在保护液中储存,故不适用于环氧乙烷灭菌法。根据产品特点对产品及包装适用性进行研究,选用60Co射线灭菌。60Co射线灭菌剂量范围应在15~25 kGy,具体选择方法《消毒与灭菌效果的评价方法与标准》[24]。所有周围神经套接管消毒灭菌后均单独包装,外包装标记尺寸、型号,术中根据需求单独拆包即可使用。灭菌有效期根据包装方式确定。
2 临床试验
临床试验是验证临床适用性的第一步。临床试验可以促进以临床为导向的科研开发,并将科技成果转化和使用过程中遇到的共性问题反馈给相关部门,形成“实验室到临床”和“临床到实验室”的双向反馈环境,以解决成果转化所遇到的问题,完善转化机制。临床试验可以通过对比观察周围神经损伤患者在经过不同缝合修复方式后自身的肌力及感觉变化,得到客观的临床疗效结果,从而评估不同修复方式对周围神经损伤的影响。
临床试验是临床研究中的关键环节,是连接产品或材料设计与实际运用的重要桥梁。为保障临床试验的顺利进行,建议对临床试验的周围神经套接管进行伦理审批、保险申请。
可降解神经套接管临床试验流程可概括为3个部分,依次为临床试验伦理申请、临床试验保险购买和临床试验开展,其具体流程如图4所示。
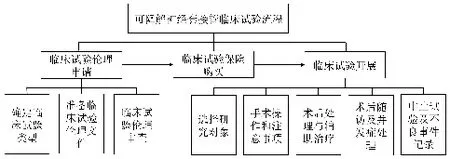
图4 可降解神经套接管临床试验流程
2.1 临床试验伦理申请
2.1.1 确定临床试验类型
根据我国有关法律法规规定,新研发出来的产品或材料应用于临床试验时,应遵循人道主义原则、自主与尊重原则、有利原则、不伤害原则以及公正原则[25]。临床试验开展之前,必须要通过医学伦理委员会的同意,获得临床试验批件。首先明确该临床试验项目是由研究者(医生/科研人员)发起的临床试验(investigator-initiated clinical trial,IIT),还是医药企业发起的临床试验(industry-sponsored clinical trial,IST)。IIT产品以科学研究为目的,伦理申请适用的法规是《医疗卫生机构开展临床研究项目管理办法》,按照科研部门的医学伦理程序进行伦理申请;IST产品以上市为目的,适用的法规是《药物临床试验质量管理规范》和《中华人民共和国药品管理法》,按照临床药理中心的规定执行[26-28]。
2.1.2 准备临床试验伦理文件
确定临床试验类型后,应根据要求准备详细的临床试验伦理文件。各个医院、研究中心的伦理制度可能不完全一致,但主要的临床试验伦理申请文件包括伦理审查申请表、项目研究方案和受试者知情同意书三个部分。伦理审查申请表的主要内容包括项目负责人的信息、临床试验项目涉及的研究信息。项目研究方案包括但不限于:研究背景,研究目的,研究设计、方法和步骤(包括研究对象、试验流程、样本量估算等内容)。还应考虑疗效评价指标的选择。此外,关于该产品的安全性评价和不良事件及报告也应根据需要在研究方案中明确叙述。知情同意书主要面向受试者,重点说明分组标准、受试者承担的风险与收益、自由退出的权利、有关费用和补偿、个人信息保密等问题。
2.1.3 临床试验伦理审查
伦理审查一般由临床试验单位伦理委员会审批,内容主主要包括试验方案的设计与实施、受试者的招募、试验流程、试验评价、风险管控等。若进行临床植入物试验,还应对植入物的材料成分、安全性进行详细汇报。经过伦理委员会同意并获得伦理批件后,研究者方可开展临床试验。
2.2 临床试验保险购买
为保障受试者的权益,遵照《药物临床试验质量管理规范》提出“申办方应对参加临床试验的受试者提供保险”意见,在确定临床试验课题符合购买临床试验保险标准,建议将受试者作为被保险人购买临床保险。
研究者需在有临床试验保险从业资质的保险公司购买保险,并签署“保密协议”。保险公司根据临床试验方案和知情同意书确定“免赔额”“每人赔偿限额”“累计赔偿限额”“保险年限”和“特别约定”等附加条款内容。
建议在付款程序完成之后(且在保险生效期内)再进行临床试验。如果支持购买,一般保险费用是从“其他经费”的条目中列支。
2.3 临床试验开展
临床研究是通过科学且严格的设计、操作和客观的评价,获取真实有效的临床试验数据,对进一步的临床应用取得扎实的基础。
2.3.1 选择研究对象
选择研究对象应遵循以下步骤:①入院患者排除手术禁忌证。②入院患者满足试验适应证:a.受试者年龄在18~65岁(含),性别不限;b.外伤性周围神经损伤;c.具有神经损伤的典型临床症状;d.受试者愿意并且能够签署知情同意书。③签署知情同意书及病情告知,告知患者及家属周围神经套接管的置入过程、术中及术后情况。告知其他可替代的治疗方案,取得患者及家属的同意。根据实验设计进行随机分配或其他分配方案决定患者入组情况。④完善术前检查:a.实验室检验,如血常规、凝血功能、血生化、传染病相关检验;b.12导联心电图检查;c.其他有必要的实验室检验或检查。
2.3.2 手术操作
手术操作过程遵循标准的小间隙套接缝合术操作方式,以正中神经损伤修复为例,具体操作如下:患者麻醉满意后,取仰卧患肢外展位,患肢上止血带。以神经损伤为中心,按正中神经走行显露。切开皮肤,充分显露正中神经。显露正中神经时,手法应轻柔,避免损伤其他重要的血管和神经。刀片或显微剪修剪正中神经断端,切除可能存在的假性神经瘤等组织,暴露正常神经束。使用周围神经套接管桥接神经断端(见图5、图6)。

图5 小间隙套接缝合示意图[29]

图6 小间隙套接缝合术中图像[8]:A.箭头所指断裂的正中神经;B.箭头所指周围神经套接管桥接正中神经断端
神经与套接管桥接吻合后,观察神经在套接管内有无扭转、褶皱,将缝合后的套接管与神经置于健康组织中,止血、冲洗,逐层缝合切口,必要时留置引流条。
2.3.3 术中注意事项
①神经断面出血应妥善处理;②神经缝合后应置于血液供应丰富的软组织中,避免将神经缝合处置于瘢痕或骨骼处;③建议手术在显微镜下进行;④手术过程中保持创面及神经湿润;⑤尽量减少对神经纤维的伤害,缝线选用6-0~10-0无创缝线。
2.3.4 术后处理与辅助治疗
术后处理:①石膏或者支具固定保持关节屈曲位,避免神经缝合部位张力过大;②术后适当抬高患肢,密切观察伤口肿胀程度,以及渗出液状态;③术后注意保持肢体远端温度,促进末梢循环;④糖尿病患者应注意术前控制血糖,降低术后伤口感染的发生;⑤根据术后患者病情变化及时对症处理;⑥石膏或者支具固定保持关节屈曲位,避免神经缝合部位张力过大;⑦术后3~5周去除石膏或者支具,逐渐练习伸直关节和适度的功能锻炼;⑧定期复查,通过临床检查和肌电图检测评估神经功能恢复情况。
辅助治疗:术后即刻开始使用药物进行神经营养治疗。同时可配合多种物理疗法共同治疗,如冷热水交替刺激手部皮肤;超短波无热量或微热量治疗;激光治疗;被动活动相邻的关节等。
2.3.5 术后随访
根据周围神经损伤修复时间及实际情况,专家组建议在术后3 d、2周、6个月、12个月对周围神经套接管的安全性及有效性进行随访。
安全性评价指标主要包括:一般情况(包括体温、心率、血压、脉搏、呼吸);皮肤情况(包括皮疹、瘙痒、风团、红肿、渗出液性质);实验室检查(血、尿常规,血生化,电解质,凝血功能检查,肝功能检查,肾功能检查)
有效性评价指标主要包括:疼痛VAS评分;运动功能评价(Lovett法或BMRC法);感觉功能评价(包括痛觉、触觉、温度觉及实体感觉等);植物神经功能评价(包括茚三酮试验);电生理检测(感觉运动电位、感觉运动传导速度)
术后3 d出院前,每隔2~3 d观察患者患处局部情况,包括患处是否红肿,渗出,判断患肢血运情况。患者出院前进行实验室检查(包括血常规,凝血功能,血生化)。根据患者病情恢复状态判断是否满足出院标准。患者出院前,培训患者如何进行功能锻炼。术后6个月及12个月临床复诊,指导患者功能锻炼,对患者运动功能、感觉功能、植物神经功能进行检查和评定。判断患者神经恢复情况。
以上时间点均需填写研究病历,内容包括患者生命体征、各项检查报告和评分表、不良事件及新的合并用药等。
2.3.6 并发症处理
术后并发症主要有感染、过敏及神经套接管断裂等。
局部伤口感染:术中注意无菌操作,术后应用预防剂量抗生素3~5 d,早期发现感染征兆,及时引流,拆除部分缝线,必要时取出内置物。
过敏反应:极其个别的患者会对甲壳质过敏,加强观察,一旦发现局部或者全身过敏现象,及时取出神经套接管并采取合理的抗过敏治疗。
神经套接管粘连或断裂:术中尽量做到微创操作,减少局部创伤,保障局部良好的血供;术后适当制动;在康复医师指导下循序渐进进行功能恢复锻炼。若发生神经套接管断裂,则立即手术,根据术中情况决定下一步治疗方案。
2.3.7 中止临床试验标准和原因记录
如中止临床试验需遵循以下标准:①受试者主观退出临床试验;②试验期间发生不良事件而导致试验中止;③受试者失访或出现影响试验数据评定的情况则中止临床试验。临床试验结束后需记录受试者结束研究的日期,若提前退出,记录退出的原因。
2.3.8 临床试验不良事件处理
临床试验期间,受试者的所有不适主诉、主观和客观症状(包括有明确临床意义的实验室检查结果)、在治疗期间新发生的疾病及意外事故均属于不良事件[30]。不良事件发生时,研究者及相关团队应及时对受试者进行干预,直至不良事件得到控制。无论不良事件是否与试验有关,关于不良事件的名称、发生和终止的时间、严重程度、与临床试验的关系、采取的措施和转归,都应如实详细记录,最后进行统计学分析。当不良事件判定为严重不良事件时,无论与试验产品有关,在立即采取适当治疗措施的同时,24 h内应向医院伦理委员会进行相关情况汇报。不良事件发生期间所产生的费用根据保险条款规定进行相应赔偿。
3 结语
可降解神经套接管具备良好的生物相容性、力学性能和降解性能,并在减少手术时间、减少神经瘤形成和提高神经纤维对接准确性方面具有巨大优势,未来有望在临床中得到广泛应用。本共识以甲壳质神经套接管为例,着重讨论其制备和临床试验的规范化流程,为国内外各临床试验中心可降解神经套接管的制备和临床试验提供参考。今后仍需不断规范神经套接管的设计、制备和临床试验流程中的原则和标准,以期实现神经套接管制造及临床试验流程的有效性和统一化,加速其临床转化进程。
本专家共识仅为可降解神经套接管修复周围神经损伤的临床科研应用流程提供学术性指导意见,实施时需根据临床试验设计、患者具体伤情,以及医疗、技术条件而定。

