人工合成骨修复材料的临床应用及展望*
王子瑞 朱金亮 何志敏 宋天喜 崔孟龙 崔云 胡艳丽 胡刚 仇志烨*
1 骨修复材料的临床需求现状
因外伤、退行性病变、先天畸形、骨肿瘤、种植牙、牙周疾病、开颅手术等各种原因导致的骨缺损在临床十分常见,尤其在骨科、口腔科、神经外科等领域的患者较为集中。以骨科领域为例,据中国药品监督管理局南方医药经济研究所统计研究表明,我国每年因各种原因导致的骨缺损或功能障碍患者已超过600万人。其中约有2/3的患者,即约400万人需要进行植骨治疗[1]。然而,目前骨科临床在处理骨缺损时大多数还是选择取患者自体骨(常见部位有髂骨、肋骨、腓骨等)的“拆东墙补西墙”方式进行植骨治疗,使用各类植骨材料的病例数仅为约133万例/年[1]。
尽管自体骨被临床认作植骨的“金标准”,但这仅仅是针对自体骨的骨缺损修复效果做出的评价,取自体骨存在造成患者二次损伤、供区并发症、延长手术时间、增加出血量、骨量有限等一系列问题,并非完美的临床解决方案[2]。有研究对1990―2010年间的临床文献进行统计分析,发现临床取自体髂骨后各类并发症发生率高达19.37%[3];颅骨、颌骨等部位取自体骨也同样存在较高的并发症发生率[4]。随着患者对术后健康生活质量要求的提升、患者的医疗支付能力的提高,以及骨修复材料技术和产品的日益成熟和发展,使用骨修复材料进行植骨填充以及引导骨组织再生修复已逐渐成为临床常用的骨缺损治疗手段。据南方医药经济研究所统计,在医疗水平和国民经济均相对发达的美国,骨科临床自体骨的使用比例由2007年的约67%下降到2017年的约46%;而在我国,2007年至2017年间骨科临床自体骨的使用比例已由约81%下降到约62%,总体趋势与美国一致[1]。由此不难看出,减少术中取自体骨,更多选择骨修复材料,是国际上临床植骨的主流发展趋势。
迫切的临床需求孕育了巨大的骨修复材料产品市场。在骨科领域,2018年我国骨修复材料的实际市场规模已达到约20.2亿元/年,预计到2023年将达到53.4亿元[1]。然而,我国每年需要进行植骨手术治疗的潜在患者人群约2 000万人,对应骨修复材料的潜在市场规模约300亿元人民币[1]。正是由于临床需求的日益显著和行业的快速发展,骨修复材料已成为骨科医疗器械领域不可忽视的细分领域之一,与运动医学一道成为近年来骨科医疗器械发展最快的两大门类。
2 骨修复材料的发展特点和我国产品现状
有医学文献记载,早在1668年,人们便尝试使用动物骨骼进行植骨治疗[5]。1880年,人尸体来源的同种异体骨首次被用于临床植骨[5],并逐渐发展成为临床常用的骨修复材料[6]。由于其本身就取材和加工自人类骨骼,同种异体骨的理化性质和骨传导性较好,但也存在免疫排异、疾病传播等临床风险[7]。此外,同种异体骨的来源有限,也存在法律、医学伦理,甚至宗教信仰方面的一些问题。
生物医用材料的发展普遍经历了从工业材料,到组织相容性材料,再到仿生自组装材料,直至目前领域前沿的功能性组织修复材料的发展历程[8]。与生物医用材料的普遍发展历程相似,人工合成骨修复材料也经历了同样的发展历程。人工合成骨修复材料是最近一百余年间逐渐发展起来的新兴交叉学科领域,经历了从简单到复杂、从工业材料到仿生材料、从单一到复合、从缺损填充到再生修复的迅速发展,先后开发出硫酸钙、丙烯酸类树脂、生物陶瓷、生物玻璃、磷酸钙骨水泥、可降解聚合物、胶原/羟基磷灰石仿生复合材料等种类丰富的产品[9-11]。如图1所示为骨修复材料的发展历程概览,并列出了主要种类骨修复材料出现的年代。随着生物材料科学和技术的发展,人工合成骨修复材料的性能和临床效果日益提升,这类产品也逐渐被越来越多的临床医生了解和认可,在临床各类骨缺损的填充和再生修复中获得使用。
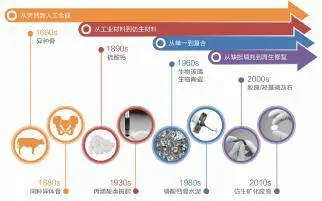
图1 骨修复材料的发展历程概览
根据在国家药品监督管理局网站对关键词“骨修复”“骨移植”“骨替代”“骨充填”“骨填充”“骨基质”“人工”“人工骨”“异种”“同种”“脱钙”“生物陶瓷”的检索,截至2021年7月15日,我国适用于骨科领域的各类人工合成骨修复材料的三类医疗器械产品注册证共有35项,同种异体骨产品注册证为20项,异种骨产品注册证仅为4项。需要说明的是,以上部分产品注册证在适用范围的描述中未对使用部位做特别限定。此外,我国还有11项仅被批准用于口腔领域植骨的骨修复材料产品注册证,包括6项人工合成骨修复材料产品和5项异种骨产品;以及4项仅被批准用于颅骨和颅颌面植骨的骨修复材料产品注册证,均为人工合成材料。从我国已获批上市的骨修复材料产品种类及注册证数量来看,人工合成材料产品的数量在各个细分领域普遍多于同种异体骨和异种骨产品,这也展现出我国人工合成骨修复材料蓬勃发展的生机和活力。
3 人工合成骨修复材料的分类和性能特点
根据材料组成成分的不同,人工合成骨修复材料主要可分为金属材料、生物陶瓷、磷酸钙/硫酸钙骨水泥、生物玻璃、高分子材料、复合材料、组织工程材料几类。不同材料具有各自的理化性质和生物学性能特点,为不同领域、不同应用场景下的临床植骨需求提供了丰富多样的选择。表1按照材料组成成分进行分类,列出了临床主要使用的人工合成骨修复材料,并简要归纳了各类材料的性能特点和主要优劣势。

表1 临床主要使用的几类人工合成骨修复材料
4 人工合成骨修复材料的临床应用
人工合成骨修复材料的种类较多,已被广泛应用于骨科、口腔颌面外科、神经外科、整形外科等领域的植骨手术中,主要起到填充骨缺损、引导骨再生、促进骨愈合的作用。
目前,在骨修复材料的选择上,我国临床尽管还是以天然来源的同种异体骨或异种骨为主,但人工合成骨修复材料已经占据了不低的临床使用比例。在骨科领域,人工合成骨材料占骨修复材料临床使用的40%左右,约53万例/年[1]。在口腔颌面外科领域,临床使用较多的还是以煅烧牛骨为代表的异种骨材料,人工合成骨修复材料的使用比例仅有10%~15%[1]。在颅骨和颅颌面骨修复领域,大面积缺损主要使用钛网、聚醚醚酮(polyether-ether-ketone,PEEK)、高密度聚乙烯等不可降解人工材料进行修补,对于创伤、囊肿切除、开颅手术等原因导致的小面积缺损,各类人工合成骨修复材料近年来逐渐得到临床的接受和使用,部分代表性材料(如羟基磷灰石、矿化胶原等)已被纳入相关专家共识中[12]。总体而言,人工合成骨修复材料的临床接受程度和使用量较天然来源骨修复材料还存在一定差距,在具备充足发展潜力的同时,也面临着从各方面赶超天然来源骨修复材料的巨大挑战。
4.1 生物陶瓷材料
生物陶瓷类材料是临床常见的人工合成骨修复材料,主要模拟人体天然骨基质的主要无机成分,以羟基磷灰石、-磷酸三钙,以及它们的复合材料为主。这类产品出现年代较早,临床产品数量也相对较多。目前,在我国共有22项人工合成骨修复材料产品的主要成分是生物陶瓷,应用领域涵盖骨科和口腔颌面外科。
20世纪90年代,四川大学张兴栋院士团队完成了骨诱导磷酸钙生物陶瓷的研发和产业化工作,是我国较早的生物陶瓷类骨修复材料产品[13]。该产品具有羟基磷灰石和磷酸三钙的复合相组成,已被临床应用于创伤、先天畸形、骨肿瘤、股骨头坏死、开颅钻孔等多种手术治疗中[14]。张院士团队还通过大量基础研究,证明了具有一定组成和结构的“无生命的”磷酸钙生物陶瓷也具有一定的成骨诱导能力[15]。这一观点也逐渐获得国际学术界的认可,陆续有研究发现,多孔羟基磷灰石陶瓷、-磷酸三钙陶瓷、羟基磷灰石陶瓷/-磷酸三钙复合陶瓷等均有异位诱导骨组织形成的能力[16]。我国上海、湖北、湖南、台湾等地区还有多家企业从事生物陶瓷类骨修复材料的产品研发工作,进口产品主要来自日本、韩国、美国、德国、法国等地。
4.2 无机骨水泥材料
无机骨水泥材料是临床常见的人工合成骨修复材料,主要包括硫酸钙骨水泥、磷酸钙骨水泥、磷酸钙/硫酸钙复合骨水泥,具有术中调制使用、可塑性、可注射、可固化等特点[17-18]。硫酸钙骨水泥的主要原理是调制过程中形成结晶水合物并固化,其临床使用较早,约130年前便被用于骨缺损填充[19];而磷酸钙骨水泥则是20世纪80年代逐渐发展起来的可注射钙磷骨修复材料,其主要原理是不同种类磷酸钙盐在调制过程中反应形成难溶的羟基磷灰石[20]。相对于骨缺损的再生速率而言,硫酸钙材料的降解过快,而磷酸钙材料则降解过慢,因此,人们还开发出降解速率适中的磷酸钙/硫酸钙复合骨水泥[21]。在我国,中国科学院院士刘昌胜教授团队较早开展磷酸钙骨水泥材料研究和产品开发,产品于2000年获批上市,现已在临床使用了20余年,材料的安全有效性获得了业界一致肯定。
无机骨水泥材料已被广泛应用于骨科、口腔颌面外科、神经外科等领域的植骨治疗中[22]。在骨科领域,磷酸钙、硫酸钙骨水泥被用于创伤性骨缺损、椎体成形术、良性骨肿瘤刮除、椎间融合术、股骨头坏死等需要进行植骨治疗的手术场景中。有临床报道称这类材料的临床骨修复效果与同种异体骨近似[23];还有临床研究对比了硫酸钙/脱钙骨基质(demineralized bone matrix,DBM)复合材料与自体骨分别用于股骨头坏死的植骨治疗效果,认为两者的临床效果相似[24]。此外,磷酸钙、硫酸钙材料还被用作抗生素、药物、生长因子等的载体。例如,硫酸钙骨水泥在术中混合抗生素,制备成载药颗粒,用于慢性骨髓炎、感染性骨不连、开放性骨折清创后骨缺损的治疗,取得了良好的临床效果,并被认为优于不可降解且需要二次手术取出的传统PMMA载体[25]。在口腔颌面外科领域,磷酸钙、硫酸钙骨水泥的临床应用相对较少[26],并且有临床研究指出磷酸钙骨水泥产品在上颌窦底提升术后的成骨效果不甚理想,无法满足后续的种植要求[27]。在神经外科领域,磷酸钙骨水泥被用于颅骨修补术[28]。美国匹兹堡医学中心一项纳入672例患者颅骨修补术病例的回顾性临床研究表明,使用磷酸钙骨水泥比用传统钛网能够降低脑脊液渗漏及伤口感染的发生率[29]。美国约翰霍普金斯大学医学院一项涉及211例患者微血管减压颅骨修补术病例的回顾性临床研究表明,与使用内嵌钛网的多孔聚乙烯材料相比,使用磷酸钙骨水泥进行颅骨修补的患者脑脊液渗漏的发生率显著降低[30]。
目前,我国已批准1项磷酸钙骨水泥[含载重组人骨形态发生蛋白(recombinant human bone morphogenetic protein,rhBMP)的规格型号产品]、2项硫酸钙骨水泥、3项磷酸钙/硫酸钙复合骨水泥,用于骨科和口腔科的植骨治疗。其中,部分产品同时获批了预成形的规格型号,临床使用时无需再调制和塑形,可直接进行植骨。
4.3 仿生复合材料
羟基磷灰石、磷酸钙生物陶瓷,以及磷酸钙骨水泥在物质组成上与人体骨基质的无机成分具有一定的相似性。然而,天然骨基质还具有以I型胶原蛋白为主的有机成分,且胶原和羟基磷灰石具有高度有序的分级自组装结构[31-32]。天然骨基质最基本的结构单元是由I型胶原蛋白和纳米羟基磷灰石按照特定空间位置排列所形成的矿化胶原(mineralized collagen)[33-34]。为了在成分和结构上更加接近天然骨基质,人们对胶原蛋白矿化及自组装机理进行了深入探索,并采用多种技术手段在体外构建出组成成分和分级结构与天然骨基质高度相似的仿生复合骨修复材料[35-37]。相关研究也引起了产业界的高度关注,并引导着新型人工合成骨修复材料的产品设计。21世纪以来,全球范围内有十多种胶原/羟基磷灰石复合成分的骨修复材料获批临床使用,极大丰富了人工合成骨修复材料的临床选择。表2列出了各国的胶原/羟基磷灰石复合骨修复材料产品,以及这些产品的材料组成和结构特点。

表2 世界各国的胶原/羟基磷灰石复合骨修复材料产品
清华大学崔福斋教授团队研发的仿生矿化胶原人工骨修复材料是一种在组成成分和微观结构上均与天然骨基质高度相似的人工骨修复材料,并已实现产业化和临床转化,在骨科、口腔整形外科、神经外科等领域的植骨手术中有着广泛应用[38]。在骨科领域,矿化胶原被用于脊柱融合、骨折骨缺损的填充和修复、人工关节翻修、小关节融合、良性骨肿瘤刮除后植骨等的手术治疗中[39-40]。在口腔颌面外科科领域,仿生矿化胶原材料被广泛用于各类植骨治疗中,如拔牙位点保存/牙槽嵴保存、牙周骨缺损修复、颌骨畸形整复、囊肿刮治等[41-42]。在神经外科领域,颅脑外伤、开颅手术、微血管减压术、经鼻颅底手术等原因均会导致颅骨、颅底骨缺损,需要合适材料进行修复。特别是对于头围尺寸增速明显的生长发育期儿童而言,传统钛合金、聚甲基丙烯酸甲酯(PMMA)骨水泥等不可降解材料因限制周围骨生长而存在导致颅骨畸变,甚至颅脑损伤等风险。近年来,矿化胶原人工骨修复材料被用于上述神经外科各类骨缺损的填充和再生修复,包括儿童颅骨缺损的修复,取得了良好的临床效果[43-44],并得到广大神经外科专家的一致认可,已被列入颅底重建技术相关专家共识[12]。
4.4 其他材料
临床使用的人工合成骨修复材料还有生物玻璃、聚酰胺66/羟基磷灰石、金属等。生物玻璃具有良好的软硬组织键合能力和促成骨活性,在骨科、口腔科的植骨治疗中有较多的临床应用报道[45]。聚酰胺66/羟基磷灰石具有与天然皮质骨相似的力学性能,在椎间融合、椎体重建等人体负重部位的植骨应用中取得了良好的临床效果[46]。金属较少被用作骨修复材料,目前我国仅有1项多孔钽金属获批临床用作骨修复材料。
5 人工合成骨修复材料的技术发展路径
美国骨科医师协会生物植入物委员会主席、美国圣路易斯大学医学院Watson教授[47]撰文提出,较为理想的骨修复材料除了需要有良好的生物相容性,还应具有良好的可降解吸收性、骨传导性、骨诱导性,以及与天然骨结构相似、易于使用、成本划算、材料相关并发症风险低等特点。近年来,人工合成骨修复材料也正朝着实现以上技术特征的方向不断发展,新理论、新技术、新材料、新方法不断涌现,为了获得具有更优越理化性质和生物活性的人工合成骨修复材料,人们研究出多种技术路径的材料功能化改性和生物活性改性策略,研发出复合骨修复材料、元素掺杂骨修复材料、载生长因子组织工程材料、提取和利用血小板浓缩物技术等[48-49]。这些新产品和治疗方法陆续从基础研究走向临床应用,为各类骨缺损修复需求提供着日益丰富且效果更佳的功能化、差异化、个性化临床解决方案。
5.1 复合骨修复材料
材料复合改性将两种或多种材料结合在一起,是进行材料改性及构建新型人工合成骨修复材料的常见策略。复合改性获得的新材料能够兼具各组分材料的特性,改善单一组分材料的不足,并可能产生组分材料不具备的新特性。前文介绍人工合成骨修复材料的临床应用部分已列举了几种复合骨修复材料。例如,将降解过慢的磷酸钙和降解过快的硫酸钙进行复合,获得降解速率与骨缺损再生修复过程更加匹配的磷酸钙/硫酸钙复合骨水泥产品;又如聚酰胺66/羟基磷灰石复合骨修复材料很好地综合了聚酰胺材料的强度和可塑性,以及羟基磷灰石材料的生物相容性和骨整合能力。
PMMA骨水泥在骨科已经有六十多年的临床使用历史,已被广泛用于人工关节固定、椎体成形术、骨肿瘤刮除后植骨、椎弓根螺钉增强等诸多临床应用,并在未来较长时间内依然具有大量临床需求。PMMA骨水泥在体内不可被降解吸收,且因其生物惰性而无法与植入部位骨组织形成骨整合,存在一定的并发症风险[50]。将可降解吸收的组分(如:透明质酸钠、矿化胶原、磷酸钙)引入PMMA骨水泥体系,构建的新型复合骨水泥能够随着可降解组分的消失引导骨组织向骨水泥内部部分长入,增强骨水泥的骨整合能力[51]。一定比例矿化胶原材料的复合还能使得PMMA骨水泥在维持抗压强度的同时,固化体弹性模量得到显著下调,从而使复合骨水泥具有更优越的生物力学性能[52]。
在复合骨修复材料产品开发和使用时应特别注意的是,复合材料的产品体系相对复杂,需充分考虑不同组分材料间的交互作用,避免对产品的安全性和有效性产生不利影响。
5.2 元素掺杂骨修复材料
在骨骼生长发育及骨缺损再生修复的研究中,人们发现多种微量元素能够促进骨骼生长发育及骨缺损愈合[53]。因此,对人工合成骨修复材料进行元素掺杂改性,能够赋予材料特定的生物学功能,有望在骨修复过程中更好地促进骨再生、加速骨愈合、提高成骨质量[54-55]。
华中科技大学张胜民教授团队对元素掺杂钙磷生物材料进行了系统研究和产品开发工作,包括含硅、硒、氟、锌、镁、锶等多种元素掺杂的功能化骨修复材料[56-59]。在硅掺杂钙磷材料中,硅元素主要以原硅酸根的形式进入羟基磷灰石晶格,并通过在粗面内质网上解除Al3+对脯氨酰-4-羟化酶(prolyl-4-hydroxylase,P4H)活性的抑制作用,间接促进胶原的生物合成,从而增强骨缺损修复效果[60-61]。硒掺杂钙磷材料能够在细胞内释放Se元素,并诱导细胞内产生活性氧(reactive oxygen species,ROS),协同激活内源和外源两条Caspase依赖的细胞凋亡途径,导致骨肿瘤细胞的凋亡,从而在引导骨缺损再生修复的同时抑制骨肿瘤复发,尤其适用于骨肿瘤切除后植骨,以及其他部位恶性肿瘤患者的植骨手术治疗[57]。张胜民教授团队在元素掺杂钙磷生物材料产业化实施和临床转化方面也走在了行业前沿[62]。目前,我国第一个硅基高活性骨修复材料产品已完成全部临床试验,进入NMPA注册阶段。全球首款针对恶性骨肿瘤切除术后再生修复的人工骨产品――含硒人工骨产品也已完成了生物安全性评价,进入体内试验阶段。
5.3 3D打印个性化骨修复材料
3D打印技术是20世纪80年代后期开始逐渐兴起的一项新兴制造技术,它以数字化、个性化、定制化为主要特点,已被应用于包括骨修复材料在内的诸多医疗器械产品的个性化设计和制造。3D打印技术制备的骨组织工程支架在个性化、患者匹配度、精确性、机械强度、孔隙调节、空间结构复杂性等方面具有独特优势。通过3D打印技术制备与天然骨结构和生物力学性能相似、高孔隙率和连通孔结构、有利于细胞增殖和诱导细胞分化的可降解材料成为了骨修复材料在个性化及高性能制造方面的研究前沿。
骨修复材料3D打印的具体实现有多种技术手段。对于粉体原料而言,主要技术手段包括选择性激光烧结、选择性激光熔融、电子束熔融等。其中,选择性激光烧结是最适合于制造三维多孔骨修复支架材料的3D打印技术,其加工过程是将一层层粉体材料堆叠起来,并在每一层制造过程中通过选择性投射在特定区域的大功率激光使粉体材料烧结成型,最终将许多层二维平面图形堆叠成三维立体结构的支架材料。在树脂材料的3D打印制造中,光聚合成型是常见的技术手段;而对于热塑性材料,挤出成型也是一种常用的3D打印技术。此外,分层实体制造、激光熔覆、静电纺丝等技术也为骨修复材料的3D打印制造研究和产品开发提供了丰富多样技术手段。相应生物墨水的研发也为骨修复材料提供了更多的材质选择[63]。
然而,由于技术、政策、临床使用规范等多方面原因,目前我国获批临床使用的骨修复材料还没有3D打印个性化产品。随着临床需求的不断提出、医工结合研究的持续深入、产业政策的日益完善,3D打印个性化骨修复材料必将在临床上发挥其独特优势,精准、高效地治疗骨缺损。
5.4 组织工程材料
自“组织工程”(tissue engineering)一词出现40余年来,形成了包括支架材料、细胞、生物活性因子在内的组织工程三要素。近年来,外部物理因素的刺激(如力、电、磁、光、热等)作为组织工程的“第四要素”也获得越来越多的实践证明和学界认可[58]。就骨组织工程材料产品开发而言,当前比较实际和有效的策略是将生物活性因子(如生长因子)和支架材料结合在一起,供临床植骨使用,我国和国外现有相关产品的策略也主要如此[64]。目前,国内外已获批临床使用的生长因子骨修复产品所含的生长因子均为rhBMP[65]。我国现已批准2项载rhBMP-2的生长因子骨修复产品在临床使用,产品的适用范围均较广,基本涵盖了骨科的各类植骨应用场景。近十几年来,我国的生长因子骨修复产品已被用于椎间融合、椎体成形术、股骨头坏死、各类骨折等的植骨治疗,取得了良好的骨修复效果[66]。
在美国,生长因子骨修复产品有含rhBMP-2和rhBMP-7的两种,但获批的适应范围均较严格:rhBMP-2产品被批准用于腰2至骶1椎间单个节段的椎间融合、髓内钉固定后的胫骨骨干新鲜开放性骨折,以及口腔领域的上颌窦提升和拔牙位点保存相关的牙槽嵴骨增量[64];rhBMP-7产品仅被批准用于长骨不连,且需在自体骨移植和其他方法均无效的情况下使用[67]。然而,美国FDA陆续收到关于这些产品在临床使用中的不良事件,问题包括肿胀/积液、骨溶解、神经根病变、异位成骨等20余种,累计数量已超过千例[68-69]。2008年,美国FDA在官网发布公共卫生事件通报,表示已收到38起rhBMP-2产品用在颈椎融合术中引起并发症的报告,强调该产品并未被批准用于该部位,并要求医生们规范产品的临床使用[70]。这也引发了学术界和公众对于这类产品安全性及潜在风险的极大担忧。2015年,美国FDA在官网发布安全通讯,建议对于18岁以下未成年人慎用含重组蛋白、合成多肽的骨修复产品[71]。
生长因子骨修复产品拥有较先进的设计理念,是骨修复材料的技术发展路径之一。然而,关于生长因子尚有许多重要方面未研究透彻,如生长因子在骨愈合过程中的作用机理、剂量设计、载体材料的选择、缓控释方式设计等还有待进一步深入研究和产品优化[72]。并且在骨愈合过程中,起作用的生长因子远不止骨形态发生蛋白,还包括碱性成纤维生长因子(basic fibroblast growth factor,bFGF)、血小板源性生长因子(platelet derived growth factor,PDGF)、转化生长因子(transforming growth factor,TGF)、胰岛素样生长因子(insulin-like growth factor,IGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等非常多种,各种因子的作用发挥也有一定的时序规律[73]。因此,生长因子骨修复产品的研究和设计开发需要改进和完善的方面还有很多。
5.5 提取和利用血小板浓缩物
鉴于目前生长因子骨修复材料存在多方面不足而导致许多临床问题,且人体的骨再生修复过程需要多种细胞因子的共同参与,术中收集患者血液并制备自体血小板浓缩物(autologous platelet concentrates,APCs)为骨修复材料的活性赋能提供了新的技术路径和临床解决方法[74]。APCs是术中采集患者外周血液,经过离心、浓缩、分离等步骤提取的生物活性成分,呈胶冻状凝块,富含多种生长因子,以及血小板、纤维蛋白、免疫细胞等成分,有益于包括骨组织在内的多种组织的再生修复[75]。经过近三十年发展,APCs经历了第一代的富血小板血浆(platelet-rich plasma,PRP)、第二代的富血小板纤维蛋白(platelet-rich fibrin,PRF),目前已发展出第三代的浓缩生长因子(concentrate growth factors,CGF),这些技术已被广泛用于骨、关节软骨、牙周、牙体牙髓、肌腱、韧带、肌肉、皮肤创面等多种组织损伤治疗和再生修复的临床应用中[76]。第三代的CGF通过静脉血变速离心获得,与PRP和PRF相比,CGF中的纤维蛋白凝块体积更大,密度更高,并含有浓度更高的生长因子,组织再生修复能力更强[77]。CGF凝块可单独作为支架材料,也可以与其他植骨材料结合使用。然而,单独使用CGF在体内降解吸收仅1~2周,过快的材料代谢速度与新骨再生不匹配[78]。
将CGF与人工合成骨修复材料相结合,将能够综合CGF的组织修复活性和骨修复材料的支架作用,同时解决CGF体内降解代谢过快和骨修复材料成骨活性不足的问题,有利于进一步加速骨缺损愈合,提高骨修复质量。目前,CGF在口腔植骨领域使用较多,但也正在向其他骨修复的临床应用方向渗透。山东省立医院黄圣运教授将CGF与矿化胶原在术中进行混合,用于口腔即刻种植手术中牙种植体周围的骨增量。观察随访结果表明,与单纯使用矿化胶原骨修复材料的患者相比,CGF复合矿化胶原组患者的术后疼痛、肿胀情况均得到较快缓解;术后3个月和6个月的影像学检查显示,CGF复合矿化胶原组患者的颊侧骨板厚度较单纯使用矿化胶原骨修复材料的患者更厚,成骨效果更佳[41]。
CGF中富含bFGF、PDGF、TGF-1、IGF-1、VEGF等人体骨愈合过程必须的多种生长因子,且提取自患者静脉血,其安全性和有效性均应优于单一种类生长因子骨修复产品。充分利用源自患者自身的CGF,与骨修复材料相结合,在术中构建具有良好成骨活性的组织工程骨修复体,且不会对患者造成新的伤害,不失为一种合理有效的临床骨修复技术路径。
6 总结
经过百余年的发展,人工合成骨修复材料经历了从简单到复杂、从工业材料到仿生材料、从单一到复合的迅速发展,先后开发出硫酸钙、丙烯酸类树脂、生物陶瓷、生物玻璃、磷酸钙骨水泥、胶原/羟基磷灰石仿生复合材料等种类丰富的产品。不同材料具有各自的理化性质和生物学性能特点,为不同领域不同应用场景下的临床植骨需求提供了丰富多样的选择。未来,人工合成骨修复材料的将沿着多种技术路径向功能化和生物活性方向发展,复合骨修复材料、元素掺杂骨修复材料、载生长因子组织工程材料、提取和利用血小板浓缩物技术等新产品和治疗方法陆续从基础研究走向临床应用,将为各类骨缺损修复需求提供着日益丰富且效果更佳的功能化、差异化、个性化临床解决方案。

