半水-二水稀磷酸工艺流程探讨
马思全,李成伟,蒲中云
(四川宏达股份有限公司 磷酸盐实验室,四川 德阳 618400)
1 磷酸萃取工艺现状
磷酸萃取工艺根据磷石膏的结晶状态分为二水、半水、半水-二水、二水-半水工艺。目前,我国湿法磷酸生产中二水工艺应用最广泛,大约占85%,半水工艺大约占10%,半水-二水工艺不到5%,二水-半水工艺很少见,只有个别试验装置。
1.1 二水工艺特点
1.1.1 二水工艺的优点
(1)产能大,工艺简单,易操作。国际上,二水工艺于20世纪30年代开发,20世纪50年代发展成熟;我国起步于1980年,成熟于1990年。1990年我国磷酸产能只有数百万吨,到2020年折纯产能已经达到2 350万t,并建设了数十套1 000 t/d的装置。全球最大的单套磷酸装置位于印度古吉拉特邦,设计产能2 650 t/d,摩洛哥有数套2 000 t/d的磷酸装置。二水工艺容易实现大型化、自动化,工艺简单,易操作。全球磷酸装置中二水工艺占80%以上,超大型磷酸萃取装置均采用二水工艺。
(2)对磷矿适应性强。用于二水法萃取磷酸的磷矿指标:w(P2O5)≥28%,m(CaO)/m(P2O5)≤1.6,w(R2O3)(倍半氧化物)≤7%,w(MgO)≤2.5%,w(SiO2)≤12%。我国磷矿经过脱镁后,都能适应二水工艺。
1.1.2 二水工艺的不足
1)产品磷酸浓度较低
二水工艺有很多优点,但二水工艺制得的产品磷酸浓度较低,通常为w(P2O5)20%~25%,为了能适应杂质含量高的矿种,产品磷酸的浓度可能更低;需将磷酸浓缩到w(P2O5)40%~50%后才能用于磷铵和重过磷酸钙等高浓度磷复肥的生产,因此,需增加一套浓缩装置。浓缩磷酸P2O51 t成本大约为500元/t。
2)P2O5收率低
二水法产品P2O5的收率较低,即使在最好条件下也很少超过96%,主要磷损失包括:磷石膏中的水溶磷、共晶磷,未分解的磷矿石。磷石膏中水溶磷残留是不可避免的,国家标准是w(P2O5水溶)≤0.5%,一般企业控制在0.3%~0.5%。共晶磷也是磷酸萃取工艺不可避免的,主要原因是磷酸属于三元酸,溶液中始终存在HPO42-,其化学性质与SO42-相似,几何尺寸也与SO42-相近,在形成硫酸钙结晶过程中,HPO42-取代部分SO42-形成共结晶的现象是肯定存在的[1]。CaHPO4包裹在硫酸钙结晶中,形成共结晶,磷石膏共晶磷质量分数平均不低于0.8%。根据调查,目前二水法生产的磷石膏中,水溶磷和共晶磷两项合计w(P2O5)≥1.2%。
我国是缺硫国,20世纪90年代,制取硫酸以硫精砂为主,硫酸价格高,磷酸成本中硫酸成本占主导地位,磷矿成本相对较低。到2020年,我国硫酸生产以硫黄制酸和有色金属冶炼酸为主导,逐步实现自给,而随着高品位磷矿的枯竭,磷矿开采和洗选成本升高,国际上磷矿石价格已经达到120美元/t,目前,磷酸成本以磷矿石成本为主导。以年产磷酸20万t,产生磷石膏100万t计算,磷石膏中的P2O5损失大约为1.2万t/a,这是一个不容忽视的数字。
3)磷石膏中杂质制约了其应用
磷石膏中存在可溶性磷、共晶磷、难溶磷,其中可溶性磷危害最大。磷酸会以H3PO4、H2PO4-、HPO42-形式存在,经过洗涤过滤后,一般有残留磷吸附在磷石膏表面,这些磷在石膏炒制过程中不挥发,而是形成焦磷酸和其他磷酸盐。当石膏水化时,可溶性磷会与活性强的Ca2+反应生成Ca3(PO4)2,这种难溶物覆盖在磷石膏表面,阻碍石膏继续溶出和水化,从而延长磷石膏及其制品的硬化时间,降低水泥制品早期强度,降低石膏制品的强度[2]。共晶磷是一些HPO42-代替硫酸根离子进入晶格内形成的,并以CaSO4·2H2O·CaHPO4·H2O的共晶形式存在。在应用时,磷石膏水化的同时,共晶磷将从晶格中溶出,共晶磷的影响规律类似于可溶性磷,但影响程度要弱于可溶性磷。难溶磷对磷石膏的影响可以忽略不计[2]。
1.2 半水工艺的特点
1.2.1 半水工艺的优点
半水工艺最大的优点在于,生产的磷酸w(P2O5)一般在42%~45%,不经过浓缩就可以生产磷酸一铵、磷酸二铵、重过磷酸钙,可以省去磷酸浓缩装置,可以回收50%的氟并制成氢氟酸,具有比二水工艺更好的经济性。
1.2.2 半水工艺的不足
半水流程必须在硫酸不足的条件下才能完全分解磷矿,而硫酸钙要成长为过滤、洗涤所需的结晶尺寸需要在硫酸过量的条件下才能实现,于是,将半水流程严格分为预混槽、分解槽、结晶槽、养晶槽,不同槽内工艺参数不同,不仅过程烦琐,也影响自动化、大型化连续生产。在大约100℃的温度条件下生产,杂质在磷酸中的溶解度最大,过滤、洗涤降温后,杂质析出,堵塞管道和设备,是制约半水工艺推广的主要原因。
1.3 半水-二水工艺的特点
将半水工艺生成的磷石膏转入磷酸w(P2O5)10%、硫酸w(H2SO4)15%的溶液中,半水石膏会快速溶解重结晶成二水石膏,同时释放半水石膏中的共晶磷。在该溶液中重结晶的条件发生了变化,溶液中磷酸浓度降低,磷酸电离出的HPO42-减少,同时SO42-过量,增加了与Ca2+的碰撞频率,也有效阻止了磷酸的电离,最大限度减少共晶取代现象;有利于晶核成长,有利于洗涤、过滤,降低磷石膏中的水溶磷和共晶磷[3]。
2 半水-二水稀磷酸流程简介
一个单槽多室的萃取设备内,在与二水工艺相似的工艺条件下,同样可以实现半水结晶,半水结晶比二水结晶更容易控制,因为硫酸钙的半水结晶要求的晶格能最小,结晶首先形成半水石膏[1]。
半水-二水稀磷酸工艺的其他关键参数还有温度和液固质量比,理论上磷酸w(P2O5)在33%,温度80℃是界限[4],超过这个值就能得到稳定的半水结晶。由于磷酸中杂质的影响,这个限值会更低,根据实验结果,在磷酸w(P2O5)低于30%的情况下,同样,可以获得稳定的半水硫酸钙晶体。
半水-二水稀磷酸流程需要经过2次过滤、2次结晶,为了严格控制整个系统的水平衡,二水流程的洗水需要控制,一部分返回用作半水过滤的洗水,半水过滤后,可只进行一次粗略的洗涤,降低和控制转化槽的磷酸浓度。
半水-二水稀磷酸流程可以得到w(P2O5)为30%~35%的磷酸,以及w(P2O5)≤0.3%、w(P2O5枸溶)≤0.2%的磷石膏,既提高了磷的利用率和磷酸浓度,又降低了磷石膏中的水溶磷、枸溶磷;在相对低温和稀磷酸条件下过滤、洗涤,克服了半水工艺的缺点,充分体现了经济性、可靠性。半水-二水稀磷酸工艺流程见图1。

图1 半水-二水稀磷酸工艺流程
3 半水-二水稀磷酸流程的工艺条件
3.1 磷矿分解
1)硫酸分解磷矿
理论上称硫酸分解磷矿为磷酸萃取工艺,表述为:
Ca5(PO4)3F+5H2SO43H3PO4+HF+5CaSO4↓。 (1)
在磷酸溶液中,硫酸钙的溶解度很小,反应一经开始,就达到过饱和状态,形成沉淀析出;反应终止,磷矿中90%的CaO呈硫酸钙固相析出,经固液分离、洗涤,固相物中含有不溶于酸的惰性物质、磷矿杂质与酸反应生成的不溶性磷酸盐,以及枸溶磷、游离水、结晶水,固相物称为磷石膏,液体称为萃取磷酸。
一般情况下,硫酸分解磷矿过程如下。
①硫酸的离子化,硫酸分散入料浆后,离解为:

②H+与加入料浆中的磷矿发生反应,分解磷矿:

③溶液中SO42-与Ca2+发生碰撞,生成硫酸钙。
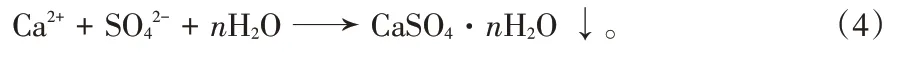
2)磷酸分解磷矿
在磷酸萃取实际过程中,采取大量的返还料浆(20~25倍料浆),在反应过程中来自H3PO4的H+浓度大约是来自H2SO4的25倍,真实的分解磷矿是来自磷酸的H+在起作用,初始磷酸是由硫酸制取,实际上是磷酸分解了磷矿。
实际反应分为两步,第一步是磷酸分解磷矿:

第二步为磷酸二氢钙与硫酸反应:

在料浆溶液中,H+质量最轻、反应活性强,扩散速度最快,是SO42-扩散速度的3~4倍。H+分解磷矿后产生了Ca2+,磷矿颗粒附近被磷酸浸透,充满了H2PO4-,Ca2+与H2PO4-接触首先生成磷酸二氢钙,磷酸二氢钙作为溶质传递层,扩散Ca2+离子。任何复杂反应过程的反应速率,都取决于速率最慢的步骤,在伴生化学反应的溶解过程中,进行得最慢的步骤是液相层的扩散。化学反应很快,而反应产物的扩散速度很慢,在固相物附近的扩散层,反应产物的离子浓度很高,达到饱和或过饱和,因此,在扩散层界限内,或者在它毗连的区域内,建立起来稳定的交换条件应为:反应产物的流出量等于反应物质的流入量。
磷矿的分解大约在5 min内完成,硫酸钙要成长为过滤需要的尺寸,至少需要120 min,如果硫酸过量,越过过饱和浓度,硫酸钙结晶就会产生自发成核,结晶成为细小的颗粒,无法进行有效的过滤和洗涤,在生产操作中称为“拉稀”,达不到工艺要求,磷矿回收率小于90%。因此,硫酸钙的结晶是整个萃取工艺的核心。
3.2 半水结晶
根据参考文献[4],湿法磷酸生产过程中硫酸钙状态见图2。由图2可知,在Ⅲ区域内可以得到稳定的半水结晶。
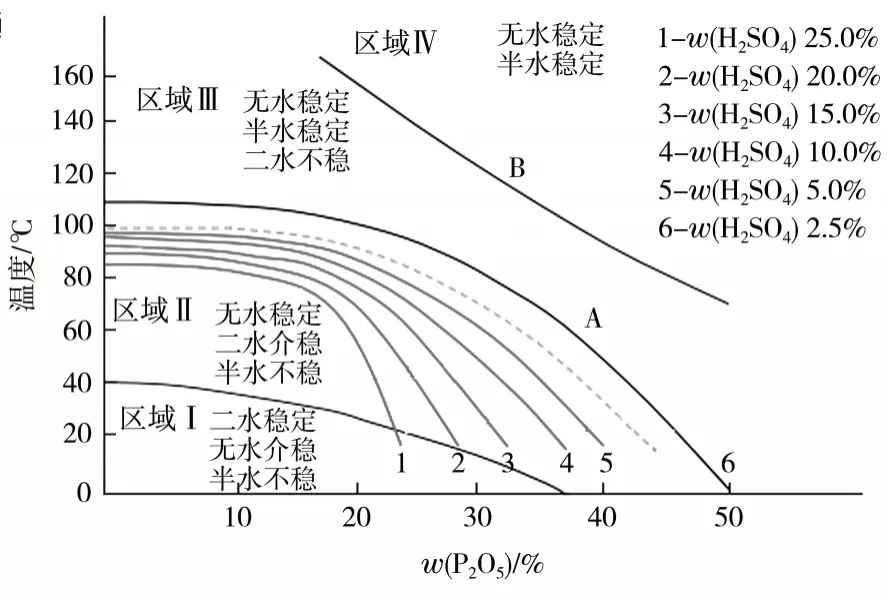
图2 湿法磷酸生产过程中硫酸钙状态
(1)CaSO4·1/2H2O向CaSO4转化时,温度位于曲线B上方的Ⅳ区域。TB=265.4-6.032w+0.050 6w2,其中w为P2O5质量分数,下同。
(2)当发生CaSO4·1/2H2O向CaSO4·2H2O转化时,温度位于曲线A下方的Ⅱ区域。TA=107-0.513w+0.006 7w2-0.000 533w3。
通过A曲线可以计算出,半水硫酸钙和二水硫酸钙的转化参数:温度为80℃,磷酸w(P2O5)为33%。这个点是纯磷酸溶液中,半水硫酸钙和二水硫酸钙的溶解度拐点,高于这个参数区域内半水硫酸钙的溶解度比二水硫酸钙小,半水结晶比二水结晶稳定;低于这个参数点,二水硫酸钙的溶解度小于半水硫酸钙,二水硫酸钙结晶比半水硫酸钙结晶稳定。半水和二水工艺参数就是参考这个拐点来确定的。但是,这个参数是纯磷酸溶液中的数据,在实际生产过程中,有两个因素可以修正这个参数,一个是料浆溶液中都有过量的硫酸根存在,硫酸根会影响这个拐点向下调整;另一个是磷酸中的杂质含量,也会影响拐点向下调整。
根据实验室经验,半水工艺因为磷酸杂质的影响,在温度70℃,磷酸w(P2O5)27%的条件下,仍然能得到稳定的半水结晶,与二水工艺相比较,应该这样认为:半水工艺的参数选择范围更大,操作管理更容易。
3.3 硫酸钙结晶动力学
在溶液中,当溶质的当量一定时,晶核数量越多,晶体就越细小,就不能满足过滤和充分洗涤的要求。实验证明在恒定的过饱和溶液中实现均相结晶,是形成粗大、均匀硫酸钙晶体的前提条件,如何保证硫酸钙结晶成长的条件,是磷酸萃取工艺的核心,因此,可以说,磷酸萃取化学就是硫酸钙的结晶化学。

图3 硫酸钙结晶的饱和与过饱和曲线
硫酸钙结晶的饱和与过饱和曲线见图3。假如料浆中各个组分的含量处于均衡的情况下,从饱和线的A点加入硫酸,假设硫酸加入量为3%,溶液的饱和点将从A点向右移至B1点,而B1点已经超过了SS(过饱和线),将发生自发成核结晶,消除溶液的过饱和度,而组点会回到B点,处于过饱和临界状态。如果继续加入SO42-,使之超过B点,组点将不再沿B1方向移动,而移动到C点,因为,越过了SS,硫酸钙会自发成核析出,降低过饱和度。C点是SS与CaSO4理论沉淀线的交点,SS的斜率是CaO与SO42-的质量比(56/96)。
到达C点后,理论上溶液最终需要停留在饱和线D点,溶液的过饱和度全部消除。在D点料浆中的Ca2+和SO42-组分达到平衡,随着磷矿的加入,对应D点的CaO浓度应该是假想的E1点,其间穿越饱和区,由于自发成核的原因,实际停留于E点,并将沿SS从E点回到F点,并伴有自发成核,溶液将继续消除过饱和,最终按照硫酸钙的沉淀角回到S上的A点,而完成整个过程中加入的SO42-的沉淀。析出量以E点和F点的w(SO42-)计算。
根据硫酸钙的沉淀曲线,如果不让自发成核过程发生,每次加入的SO42-,都应该在SS以下,在S与SS之间完成循环。根据这一原理,实际生产过程中,一般采取25倍的返还料浆,其目的就是稀释SO42-的加入浓度,让每一个循环都在SS内完成。为了更彻底地消除SO42-局部过浓现象,加入稀释硫酸更加科学。
在萃取槽内硫酸需要从第2槽以后加入,加入的硫酸为经过稀释后的硫酸,稀释热通过石墨换热器吸收后回收利用,同时加热返还料浆,控制温度达到工艺要求。硫酸加入2~6区,渐进式分散加入,第7区为料浆抽出和返回1区的过渡区,这个区硫酸w(H2SO4)达到2.5%。
4 结语
半水-二水稀磷酸流程在技术上可行,并具有良好的经济效果,是磷化工企业从粗放型向精细型转型的契机,尤其是在促进磷石膏综合利用和提高磷酸品质方面是值得科技工作者认真研究的课题。

