人参实时荧光定量PCR 快速鉴别方法
李忠华,杨宝,马宁,岳静怡,郝娟,赵丽红
(1. 太原市食品药品检验所,山西 太原 030031;2. 山西国新晋药集团有限公司,山西 太原 030006)
0 引言
人参为五加科植物人参(Panax ginseng)的干燥根和根茎。人参具有大补元气、复脉固脱、补脾益肺、生津养血、安神益智等功效[1-3]。目前,人参产业发展势头迅猛,人参市场除正品外,尚有代用品、伪品、混淆品,以假乱真的现象屡屡发生,人参饮片市场情况尤其严重,给药用市场管理带来极为不利的影响[4]。因此,急需一种能够快速、准确地鉴别人参的方法,从而确保人参的临床疗效,这对于药品、食品、保健品的质量保障具有十分重要的意义。
DNA 分子鉴定技术因其准确性、客观性,在中药材鉴定中的应用越来越受到人们重视。Shaw 等采用RAPD 法明显地区分开人参属的3 种药材及4种伪品[5],AP-PCR、PCR-SSCP 法也被应用在人参属药材的鉴定中[6-7]。崔光红等利用多重等位基因特异PCR 鉴别人参、西洋参[8];王雪松等采用PCRRFLP 鉴定人参真伪[9];徐凤娇等设计3 条引物多重PCR 方法鉴定人参和西洋参[10],上述三种方法均需要扩增后电泳,所需检测设备多,检测时间长,电泳毒性大。侯双利等基于β-actin 基因实时荧光定量PCR 鉴别人参真伪。黄林杰等运用qPCR 技术对蕲蛇、浙贝母进行了鉴别研究,该方法采用SYBR Green I 染料,染料毒性大,该方法较Taqman 探针法特异性差,且人参鉴别还需经溶解曲线确定是否为目的产物,检验过程耗时长[11-12];黄永辉等建立了qPCR 技术鉴别西洋参的方法[13];吴迪等使用qPCR技术准确地鉴别了紫河车掺伪品中的猪、牛、羊物种[14]。因此从分子生物学准确、快速鉴别中药材的真伪成为研究热点。
实时荧光定量PCR(qPCR)是在定性PCR 技术基础上发展起来的核酸定量技术,具有灵敏度高、定量准确、特异性强、重复性好、无污染等特点,已被广泛用于基因的表达分析。本研究基于人参ITS 序列的特异性位点设计引物,并引入了Taq⁃Man 荧光探针,它是一种寡核苷酸探针,其5′端携带荧光基团,如FAM、HEX 等,3′端携带淬灭基团,如TAMRA、BHQ 等,在探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR 扩增时,TaqMan 酶的5′-3′外切酶活性将探针酶切降解,使报告荧光基团和淬灭基团分离,从而荧光监测系统可接收到荧光信号。实现了荧光信号的累积与PCR 产物形成完全同步。此方法不仅实现了人参的快速鉴别,还能区分人参和替代品及仿冒品,而且可以对人参样品进行相对定量测定,大大提高了人参鉴别的准确度和灵敏度,为规范人参的市场管理提供了技术支撑。
1 材料与方法
1.1 材料
香港力康Neofuge 13R 高速冷冻离心机;eppen⁃dorf 微量核酸分析仪;美国热电ABI7500fast 荧光定量PCR 仪;BIO-RAD C1000 TOUCH 梯 度PCR仪;Power Pac Basic 电泳仪;美国伯乐凝胶成像系统;TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver. 5.0(Tkara,Cat#9765);上海生工生物公司合成的引物、探针;TaqMan™Fast Uni⁃versal PCR Master Mix(2X)(ABI,NO.4366072)。
共收集人参药材及其易混伪品11 个物种36 份样,样品产地及来源于河北安国、安徽亳州、广西玉林、吉林通化及太原市药店医院和生产企业等地。样品经山西省食品药品检验所主任药师崔宇宏鉴定,保存于太原市食品药品检验所详见表1-表2。
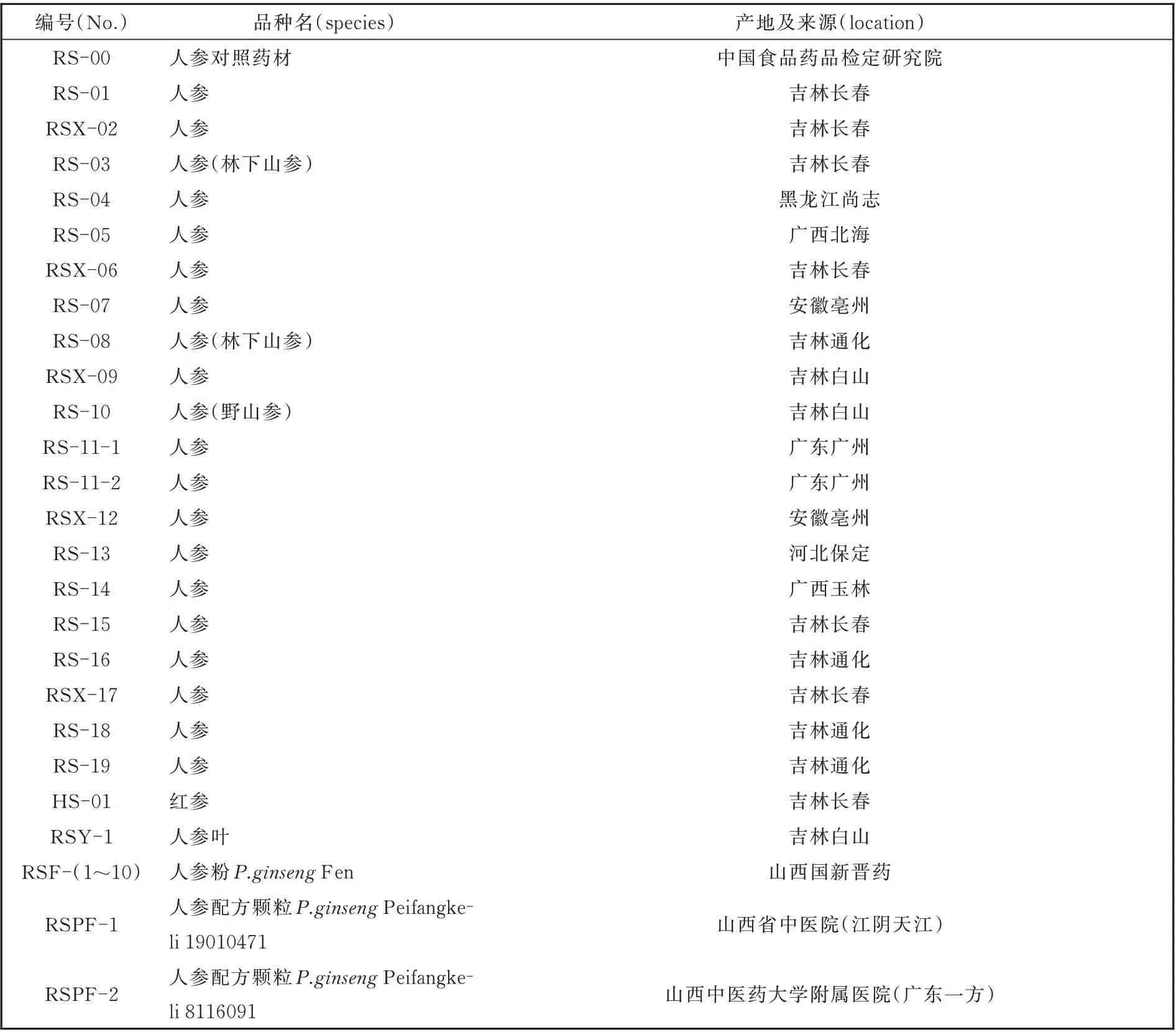
表1 人参样品信息Table 1 Sample information of Panax ginseng
1.2 方法
1.2.1 样品DNA 提取
为了避免污染,样品用体积分数为75%酒精棉球将表面擦拭干净,晾干,干品用球磨仪粉碎成细粉状,鲜品用洁净的剪刀剪碎,混匀,称取20 mg 置于灭菌的2 mL 离心管中。用Tkara 提取试剂盒提取样本DNA,用核酸分析仪测定DNA的纯度及浓度,将OD260/OD280在1.7~1.9 之间,且浓度达到10 ng/μL~100 ng/μL的DNA 溶液作为模板DNA,-20 ℃保存备用。
1.2.2 样品DNA 质量确定
按照1.2.1 方法提取人参对照药材(121591-201602)、人参、人参叶及其他中药材样品(见表2)共计13 个样品DNA,水作为空白对照,以13 个样品的DNA 为模板,使用通用引物

表2 其他中药材样品信息Table 2 Sample information of the other Chinese herbal medicine
ITS5F: 5′-GGAAGTAAAAGTCGTAA⁃CAAGG-3′,
ITS4R: 5′-TCCTCCGCTTATTGATAT⁃GC-3′[15]
进行PCR 扩增。反应条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s,40 个循环;72 ℃延伸10 min,观察实验扩增结果。
1.2.3 引物的设计与扩增
引物的设计:通过查阅文献后获得人参、西洋参及其他常见近源物种序列,首先用Snapgene 软件比对出保守序列,再经过Oligov7.0.1 和NCBI 的Primer-Blast,设计出能够用于人参真伪鉴别的实时荧光PCR 检测引物和探针,由上海生工生物公司合成。
正 向 引 物:5′-AGTTGCGCCCGAAGCCAT⁃TA-3′;
反 向 引 物 : 5′-ATCACTCCTTTGC⁃GGGAGTCGA-3′;
探针:FAM5′-CTATTACCGGAGGGCACA⁃GA-3′TAMRA。
扩增反应体系配制如表3。反应条件为:50 ℃2 min;95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火1 min,40 个循环。

表3 反应体系配制表Table 3 Preparation table of reaction system
1.2.4 特异性实验
将1.2.2 提取的人参样品和其他样品的DNA作为模板。按照上述反应体系和条件进行扩增,以水作为空白对照,验证引物和探针对人参样品扩增的特异性。
1.2.5 样品覆盖度实验
以表1 中34 批人参DNA 为模板,按照1.2.3 进行扩增,以水作为空白对照,进行覆盖度试验。
1.2.6 灵敏度实验
将100 ng 的人参DNA 模板10 倍递减稀释,稀释至10-5,每个梯度做4 个平行实验,按照1.2.3 中反应体系和条件扩增,测试该方法的灵敏度。
2 结果与分析
2.1 特异性实验样品ITS 片段扩增结果
13 个样品DNA 扩增后的PCR 产物经凝胶电泳均得到700 bp 左右ITS 片段(图1),说明13 个样品均能获得到高质量的DNA。
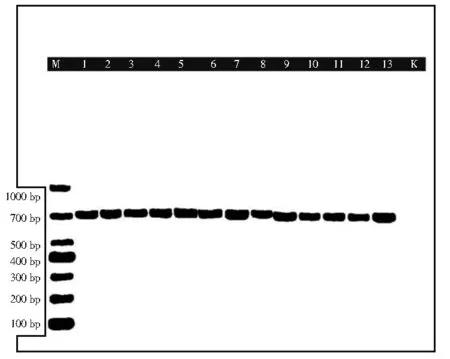
图1 ITS 片段扩增产物电泳图谱Fig. 1 Electrophoresis pattern of ITS fragment amplified products
M、marker 1、人参对照药材2、人参3、人参叶4、西洋参5、黄芪6、三七7、苦参8、太子参9、玄参、10、桔 梗11、沙 参12、丹 参 13、党 参K、空 白 对 照(ddH2O)
2.2 特异性引物与探针序列
中药基源、近源物种和伪品DNA 序列完全的比较研究是中药DNA 分子鉴别标准中引物设计是否科学的关键[16]。通过对人参、西洋参、三七常见近源物种和伪品序列检索NCBI 的数据库,首先用Snapgene 软件比对出保守序列,再经过Oli⁃gov7.0.1 和NCBI 的Primer-Blast,设计出能够用于人参真伪鉴别的实时荧光PCR 检测引物和探针(见图2),探针序列将测序后获得的发现所有人参与西洋参的5.8S 和ITS2 片段上在位点116、127 处都有2 个碱基的差异,并且所有的人参5.8S 和ITS2 片段上位点116 均为碱基“C”,位点127 均为碱基“T”,而所有西洋参5.8S 和ITS2 片段上位点116 均为碱基“T”,位点127 均为碱基“C”。比对结果同时显示人参与三七在5.8S 和ITS2 片段在112、118、127、130 处有4 个碱基的差异,更容易区别。基于以上差异,设计人参检测特异性探针。

图2 人参、西洋参和三七5.8S 和ITS2 片段上序列的SNP 位点特征Fig. 2 Characteristics of SNP loci on 5.8S and ITS2 fragments of Panax ginseng,P. quinquefolium and P. notoginseng
2.3 特异性实验
图3 为空白对照无FAM 荧光对数扩增曲线;阴性对照非人参类样品无明显的FAM 荧光对数扩增曲线,Ct 值均大于35;阳性对照人参对照药材有FAM 荧光信号检出,且出现典型的扩增曲线,Ct值小于35 实验有效。人参、人参叶样品在40 个循环内有FAM 荧光信号检出,且出现典型的扩增曲线,Ct值小于35。
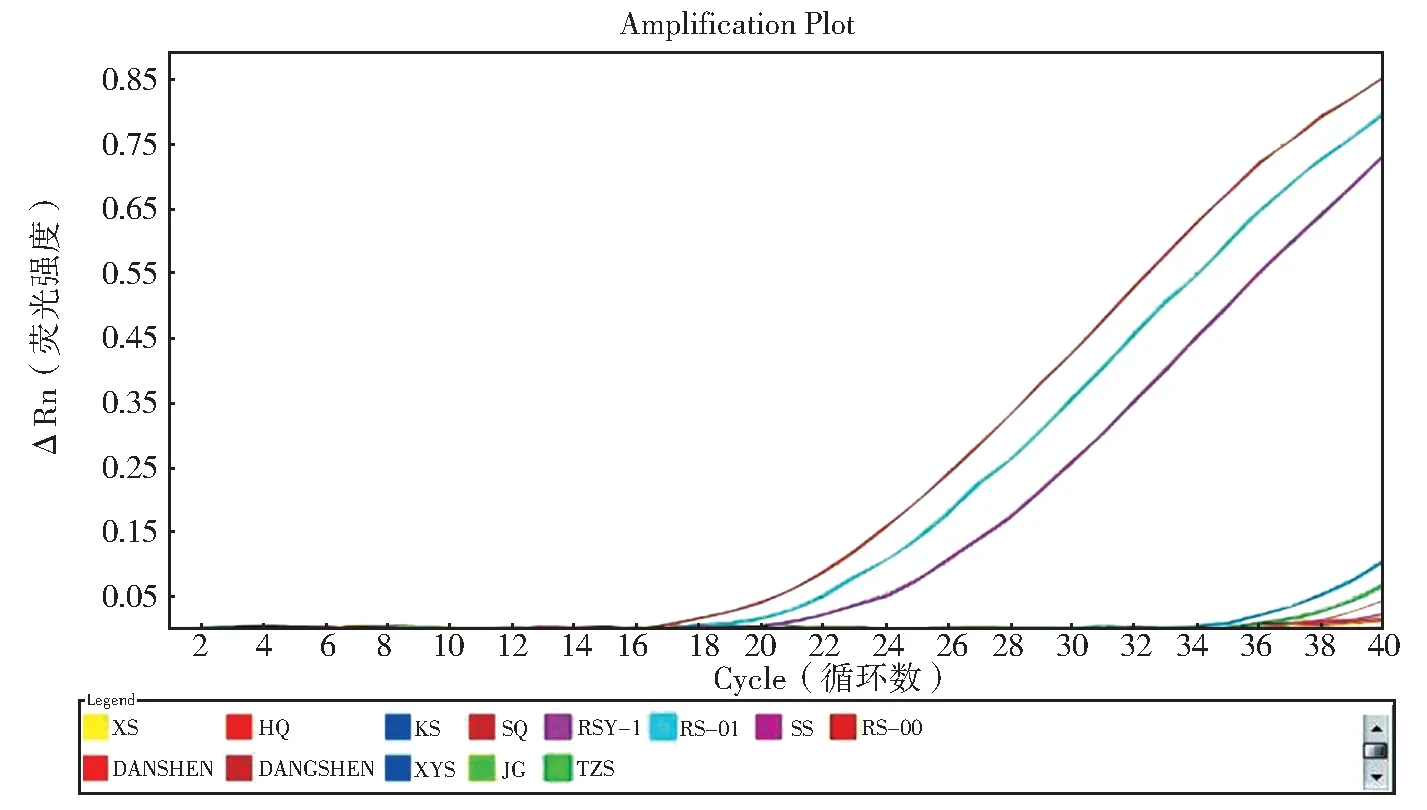
图3 人参特异性扩增图谱Fig. 3 Specific amplification map of P. ginseng
2.4 样品覆盖度实验
图4(A)为人参对照药材和20 批人参样品扩增结果,图4(B)为1 批红参、10 批人参粉、2 批人参配方颗粒样品扩增结果,由结果可知,34 批样品在40个循环中均有明显的荧光对数扩增曲线,Ct值均小于35。所以此方法适用于人参药材、饮片、粉、配方颗粒和红参的鉴别。
图4 样品扩增图谱Fig. 4 Amplification map of sample
2.5 灵敏度实验
图5 为样品在稀释度10-5~100时,Ct值均<35,且曲线有明显的对数增长,扩增结果具有良好的重复性,相对标准偏差RSD 均<3.5%。以稀释度量值对Ct值作图,其线性关系如图6 所示,线性相关系数R²=0.993,线性方程为y=-3.99×lgx+16.021,线性范围为0.001 ng~100 ng,即1×10-3ng/反应~100 ng/反应,该方法具有良好的线性相关度。本方法灵敏度高达1×10-3ng/反应。
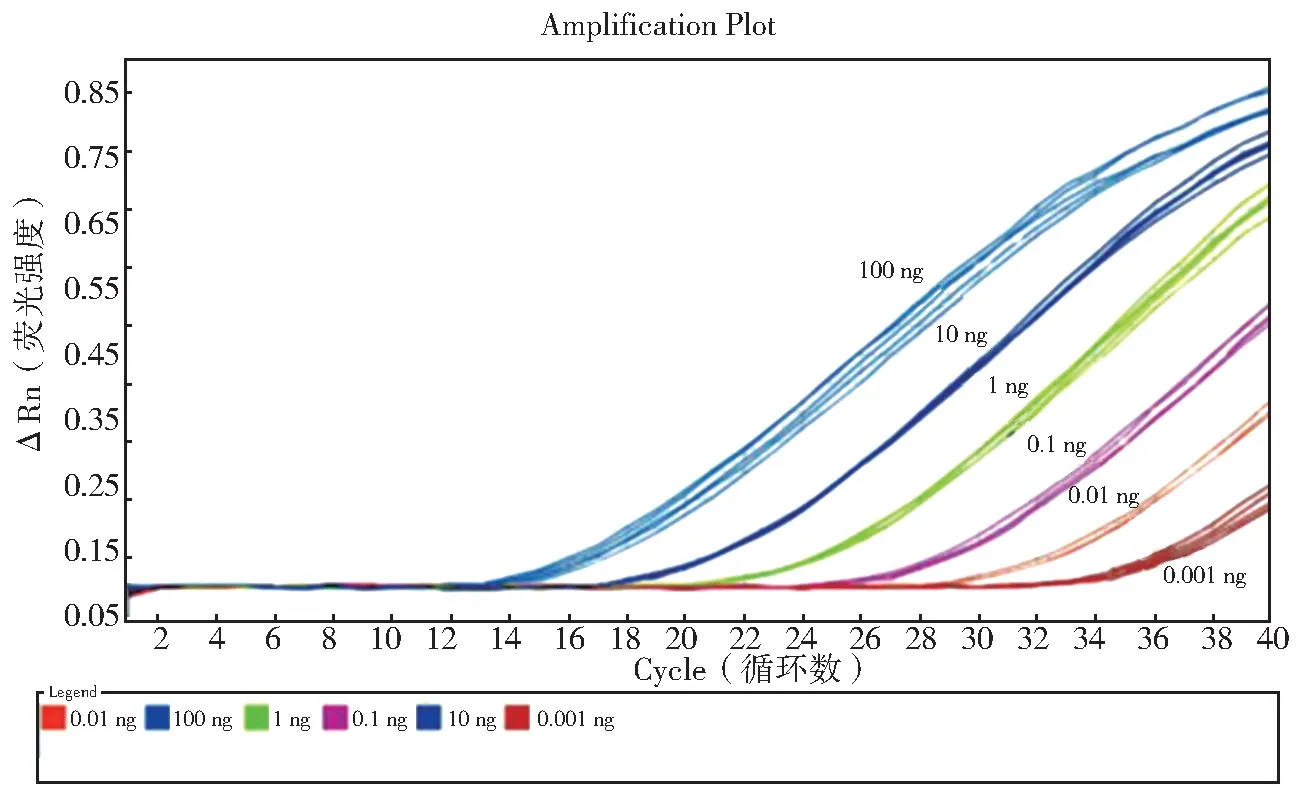
图5 人参样品灵敏度扩增图谱Fig. 5 Sensitivity amplification map of P. ginseng sample
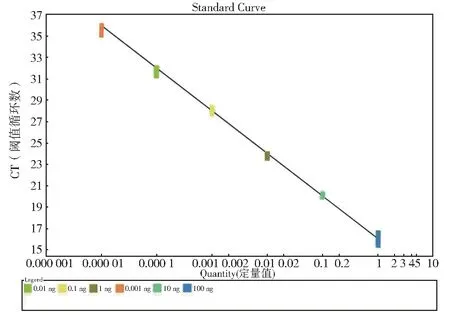
图6 人参样品灵敏度扩增标准曲线Fig. 6 Standard curve of sensitivity amplification of P.ginseng sample
3 讨论
人参质量鉴定方法很多,但有其局限性和专属性。传统鉴别方法往往是通过外观性状,如眼观、手摸、鼻闻、口尝等,必要时借助显微观察和薄层鉴别,这种鉴别方式对检验人员的专业素质要求较高,而且存在主观差别,不适用于快速、准确、广泛的推广。目前光谱法也用于人参的鉴别,且不破坏样品,但必须由经验丰富的实验人员对图谱进行解析[17-18]。而高效液相色谱法操作烦琐、耗时长、检测分析成本较高,且近缘品指标成分相近较难确证[19]。双反应体系测定3 种样品的非线性化学指纹图谱、基于中药质量标志物的超高效液相色谱-串联质谱法近几年也运用于药材和中成药的质量控制[20-21]。现行国家药品标准2015 年版中国药典首次采用PCR-RFLP 方法鉴别川贝母、PCR 方法鉴别乌梢蛇和蕲蛇及金钱白花蛇,也首次制定了中药材DNA 条形码分子鉴定法指导原则,这也是中国中药国家标准划时代迈向分子时代。
ITS 作为真核生物核糖体DNA 的非编码区,承受的选择压力较小,物种间变异较大,遗传信息较丰富,而且长度适宜,有利于后续扩增实验,所以ITS 分子标记被广泛应用于中药材的鉴定。本文依据中国药典2015 年版四部[22]和陈士林对中药材DNA 条形码分子鉴定指导原则[23]、基于ITS 分子标记,设计了特异性鉴别人参的引物和TaqMan 探针,在40 个循环内人参对照药材、人参药材饮片、人参粉、人参配方颗粒、人参叶、红参有荧光对数扩增曲线,其他非人参样品无荧光对数扩增曲线,整个实验2 h~3 h 左右用时较短;灵敏度较高,达1×10-3ng/反应;整个过程闭管操作,减小了出现假阳性的概率,同时避免了电泳时荧光染料对身体及环境造成损害的可能;人工操作较少,业务不熟练的检验人员也可快速掌握,与形态学生药鉴定结果完全吻合,也验证了实时荧光定量PCR 方法鉴别人参真伪的可靠性和稳定性。
4 结论
本实验建立的引物和TaqMan 探针与模板的特异性PCR 扩增可有效鉴别人参,也可有效区分混淆品和代用品,并且完全闭管检测,无须PCR 后处理,避免了交叉污染和假阳性,实验结果由仪器通过数字方式给出,较为准确,减小了检验人员判读时的主观误差,而且可以实现相对定量;具有准确、快速、灵敏度高、易掌握、便利等特点,作为人参鉴别的新技术,可以在实际应用中推广。

