1~20 eV低能电子对DNA的多重损伤及其瞬态阴离子机制
庄浦祥 董艳芳 邵 宇 郑 宜
(福州大学化学学院光催化研究所能源与环境光催化国家重点实验室 福州 350116)
高能电离辐射对生物分子的作用是环境与人类相互影响体系中的重要部分。高能粒子(α-、γ-、X-射线等)与物质相互作用时,70%~80%辐射能量导致电离,由此产生数目众多的二次电子(约5×104MeV)[1-2]。由于其分布与电离辐射的初始能量和类型无关,皆为能量小于30 eV、平均能量约为10 eV的低能电子,二次电子(低能电子)是电离辐射过程中导致化学、生物反应的最关键介质[3-5]。DNA是细胞内最重要的生物分子,由于传递了大部分高能辐射能量的低能电子能直接导致各种遗传变异或潜在致命性的DNA破坏,50%以上的辐射损伤是由低能电子(LEE)作用导致[6],因此,低能电子与DNA分子作用是细胞内辐射保护和辐射致敏机制的基础,对其作用机制的理解是辐射生物学最本质的研究命题。2000年,Boudaïffa等[7]在Science上首次发表了5~20 eV电子通过解离共振能有效导致DNA的单链、双链破坏的重大发现。近年来,发现能量(甚至低于0 eV)位于水分子导带上的预溶剂化电子也能够导致DNA损伤[8]。迄今为止,已揭示的低能电子与DNA相互作用机制表明:(1)低于25 eV的低能电子可以通过解离电子吸附(DEA)过程对质粒DNA作用产生交联(Crosslink,CL)、单链断裂(Single strand break,SSB)、双链断裂(Double strand break,DSB)[6,8];(2)0~4 eV的电子只能引起SSB[9];(3)电子被DNA捕获并导致损伤的程度取决于DNA的形态与环境,如水、离子、蛋白质、氧气等[4,6]。其中针对碱基损伤(Base damage,BD)及由链断裂和碱基损伤组成的多重损伤(即集簇损伤,Clustered damage),由于检测困难,研究较少。DNA多重损伤是通过单一的辐射轨迹在DNA的一个或两个螺旋内(少于20个碱基对)产生的两个或两个以上的链断裂、氧化嘌呤、氧化嘧啶或脱碱基位点损伤的组合,可有效地导致细胞的基因突变及其他潜在的致死效应,是导致细胞死亡的决定因素[10-13],因此亟待开展低能电子导致DNA多重损伤的研究。
针对低能电子导致的DNA链断裂损伤已有较多研究。Boudaïffa等[7]在超高真空条件下用3~20 eV的电子对DNA辐照,单链断裂、双链断裂和超螺旋损失的产率结果表明:SSB的量子产率曲线在8~12 eV有一个宽峰,并在10 eV产率达到最大值,且在5.5~6.0 eV有一个肩峰;DSB产率的峰值出现在10 eV,提出可能原因是入射电子被DNA的分子碎片(碱基、糖、磷酸等)捕获导致共振的形成,产生的瞬态阴离子通过自我脱附或者解离导致特定键的断裂。3~100 eV电子辐照质粒DNA产生SSB和DSB的有效产率与入射电子的能量关系显示[14]:SSB的产率在4~5 eV有明显的上升,而DSB的产率开始于5~6 eV附近;SSB和DSB的有效产率都在10 eV附近有一个宽峰;在14~15 eV SSB的产率有最小值,DSB的产率接近于0;15~30 eV二者的产率都有一个快速的升高,高于30 eV,直至100 eV,二者的产率都趋于恒定。Martin等[9]研究了低于4 eV能量的电子辐射质粒DNA产生链断裂的产率及能量关系,结果发现,LEE对质粒DNA产生的SSB产率有两个最大值出现在0.8 eV和2.2 eV,归因于单电子共振的形成,但该能量范围电子不能导致DNA双链断裂。Chen等[15]研究了真空中5~25 eV低能电子对质粒DNA膜的辐射损伤,也显示低能电子导致SSB和DSB的峰值在10 eV,与核激发共振有关。Luo等[16]以2 eV为间隔调控2~20 eV的低能电子辐照五分子层厚度的质粒DNA膜,获得交联和链断裂的有效量子产率与低能电子的能量关系:SSB的有效量子产率在4.6 eV和9.6 eV有两个峰,DSB在6.1 eV和9.6 eV出现峰值;提出产率出现峰值的原因是电子被碱基捕获形成核激发共振瞬态阴离子,通过DEA过程或自解离导致链的断裂。
除了低能电子对质粒DNA膜的研究,5~30 eV的电子导致两种不同序列的水合P14双链超螺旋质粒DNA的链断裂与电子能量关系的研究表明:SSB和DSB产率的两个峰值移到了比5 eV、6 eV和10 eV更高的能量处,峰值能量的转移是由于水的存在,而峰值的出现同样归因于核激发瞬态阴离子[17]。Sahbani等[18-19]采用0.5~22.0 eV的低能电子辐射质粒DNA,将辐射后质粒DNA样品转染至大肠杆菌(JM109),并在富含氨苄青霉素的环境中培育,因质粒DNA中带有该抗生素抗体序列,大肠杆菌依靠质粒的完整性来生存,由此获得细胞的存活率与低能电子能量的直接关系。结果显示,细胞的存活率在5.5 eV和9.5 eV处出现两个峰值(最低值),揭示了低能电子导致的DNA损伤与细胞存亡的直接关联性。但究竟是哪种损伤才是辐射导致细胞死亡的最致命原因仍是未知。
目前,针对LEE对质粒DNA的辐射研究主要是基于单一或大范围电子能量下的损伤研究,尤其对于LEE诱导产生的碱基损伤和多重损伤的研究更是缺乏,LEE导致DNA多重损伤分子机制的阐明亟待高精度、系统的能量关系研究[9,14-15,20-21]。本研究以1 eV为间隔、用1~20 eV的单能量低能电子对五分子层厚度质粒DNA膜进行辐照,通过琼脂糖凝胶电泳表征DNA交联和链断裂损伤,利用碱基切除修复核酸内切酶III(Nth)和甲酰胺基嘧啶N-糖基化酶(Fpg)将碱基损伤转化成链断裂揭示碱基损伤和多重损伤。通过DNA交联、链断裂、碱基损伤和多重损伤等的单电子损伤产率与低能电子的能量关系,揭示瞬态阴离子对DNA多重损伤的作用,进而阐明单电子导致DNA多重损伤的机制。
1 材料与方法
1.1 质粒DNA的提取
含有3 197个碱基对的质粒DNA(pGEM-3Zf(-))是从大肠杆菌(E.coli DH5)中提取,并用HiSpeed plasmid Maxi kit(QIAGEN)试剂盒进行纯化,纯化的质粒DNA由96%超螺旋结构(Supercoiled)、1%的交联(CL)、1%单链断裂(SSB)和2%的Concatemeric形式构成。用交联葡聚糖凝胶柱(Sephedex G-50)移除DNA中的盐。
1.2 低能电子辐射
基底材料为(450±50)nm的钽,表面分别用纯乙醇和超纯水(ddH2O)清洗,清洗后用干燥的氮气吹干备用。将15个320 ng/7μL DNA样品滴加在洁净的钽表面,放入含有99%纯度干燥氮气的手套箱中,在−65℃的条件下冷冻7 min,冷冻的DNA样品转移至无烃涡轮分子泵的抽干装置中,在0.93 Pa压力下抽干2 h,将抽干的DNA直接转移至低能电子发射装置内的样品架上,关紧腔门,在环境温度下抽真空,约24 h后真空度达到2.66×10−6Pa,即可对DNA样品进行辐照。DNA的密度为1.7 g/cm3[22],沉积在钽表面的DNA样品均匀分布在半径为(2.0±0.5)mm的范围内,可得到5个分子单层的DNA膜,平均厚度为15 nm。在发射电流时,检测到发射电子的灯丝和样品基底之间的电势为+0.4 V,低能电子枪的电子能量可以设定为1.4~20.4 eV,对应的绝对电子能量为(1±0.3)~(20±0.3)eV[16]。在1 eV时的入射电子束的电流控制为3 nA,2~20 eV的能量范围的入射电流设定为6 nA,辐射时间设定为5~30 s。制备4个样品作为未辐照对照样品,11个样品进行不同时间辐照实验。辐照后每次用10μL ddH2O从钽表面回收DNA膜,每个样品回收两次,回收率约为95%。回收后的DNA溶液分成三等份:一份不加酶,另两份分别用Fpg和Nth酶反应。
1.3 酶处理
用大肠杆菌Nth和Fpg来处理DNA。DNA修复酶Nth和Fpg可以通过糖苷键的水解分别特异性识别和去除受损的嘧啶和嘌呤,从而形成链断裂,可通过电泳分析检测[23-25]。根据链断裂的酶响应曲线,分别用1 unit Fpg和0.5 unit Nth酶对DNA进行酶处理。将Fpg和Nth酶分别与辐照后的DNA样品混合,并在37℃下反应60 min,最后加入0.5 mol/L EDTA缓冲液来终止酶反应。对辐照后未经酶处理的DNA样品也在37℃加热60 min,以获得相应的热效应引起的损伤。
1.4 DNA损伤和碱基损伤的单电子损伤产率
超螺旋DNA、SSB、DSB和交联形态的DNA可用琼脂糖凝胶电泳表征,用Bio-Rad激光扫描仪(Molecular dynamics)扫描凝胶,利用ImageQuant 5.0软件分析凝胶上不同的DNA条带。单电子损伤产率定义为每个入射电子作用到一个DNA分子所引起的交联、单链断裂、双链断裂增加的量和超螺旋减少的量,以辐射-反应曲线的初始斜率(%/electron)除以未辐照的超螺旋DNA的百分含量计算获得。通常用它来衡量单个入射电子对DNA的损伤量,计算见式(1)。

式中:Y代表单电子损伤产率;S代表辐射-反应曲线的初始斜率;Q代表未被辐照的各DNA样品中超螺旋态DNA的百分含量,%。
由于Nth和Fpg两种酶识别的位点分别是受损的嘧啶碱基和嘌呤碱基,对酶敏感位点的交叉反应性低,因此认为它们之间是相互独立的[26],可以通过简单的求和来计算碱基损伤的单电子损伤产率,见式(2)。被辐射DNA的总的损伤单电子损伤产率计算见式(3)。
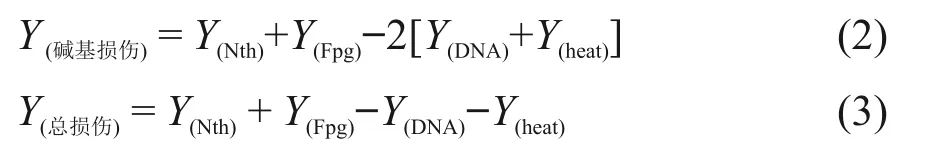
式中:Y(Nth)和Y(Fpg)定义为用Nth或Fpg处理的被辐照DNA损伤的产率(即每入射电子每DNA分子的损伤);Y(DNA)表示未经酶处理的辐照DNA损伤的产率;Y(heat)是DNA样品在37℃下1 h后的热损伤。
2 结果与讨论
2.1 低能电子对DNA的交联、单链断裂、双链断裂的损伤量子产率
1~20 eV低能电子对DNA造成的交联、SSB、DSB和超螺旋形态的DNA损伤的辐射-反应曲线表观类似[16,27-29]。以10 eV电子为例,10 eV的低能电子辐照五分子层厚度的DNA膜产生损伤(CL、SSB、DSB、SC)的辐射-反应曲线见图1。图1中也包括辐照后的DNA分别用Nth和Fpg酶处理后的结果。在未辐照时(即0点处),SC DNA的百分含量大于95%,说明钽基底表面对DNA的损伤极小,是优良的基底材料。随辐照时间延长,入射电子数增多,DNA膜内积累的负电荷会造成荷电效应,故CL、SSB、SC DNA辐射-反应曲线属于指数函数;DSB的辐射-反应曲线呈线性函数,是因为超螺旋DNA和SSB都可经辐射作用产生DSB,从而不受荷电效应影响。将辐射-反应曲线的初始直线斜率进行拟和,可计算出交联、单链断裂、双链断裂、超螺旋减少在该能量下的电子有效损伤量子产率,即每入射电子每DNA分子中的损伤量。

图1 10 eV低能电子辐照五分子层厚度的DNA膜产生交联、单链断裂、双链断裂和超螺旋损失的辐射-反应曲线Fig.1 Exposure-response curves for crosslinks,SSBs,DSBs,and loss of supercoiled induced by 10 eV electrons in five monolayer DNAfilms
图2总结了1~20 eV的低能电子诱导DNA产生CL、SSB、DSB、SC的单电子损伤产率,误差来自0点的初始斜率的线性拟合分析。经Fpg和Nth酶处理后DNA损伤的单电子损伤产率都有增强,且Fpg酶处理后单电子损伤产率高于Nth酶,这是由于两种酶分别特异性识别嘌呤、嘧啶碱基,说明低能电子造成的嘌呤损伤可能大于嘧啶损伤。超螺旋的减少绝大部分转化为SSB的增加,较少部分转化为CL和DSB,因后者产率比SSB的产率小一个数量级[16,27]。此外,低于4 eV的电子不能产生DSB,这与之前的研究结果一致[9]。

图2 1~20 eV低能电子辐照五分子层厚度的DNA膜造成CL、SSB、DSB、SC DNA减少的损伤的单电子损伤产率Fig.2 Single-electron yields of the loss of supercoiled,CL,SSB,DSB induced by 1~20 eV low-energy electrons impact on 5-monolayer DNA films
2.2 电子对DNA的碱基损伤、非DSB多重损伤的量子产率
被辐照后的DNA样品用Fpg和Nth酶处理将碱基损伤转化为链断裂,并通过电泳分别检测与碱基损伤有关的交联、单个的碱基损伤和非DSB的多重损伤[30]。表1列出了由1~20 eV的电子辐照产生的与碱基损伤相关的单电子损伤产率。
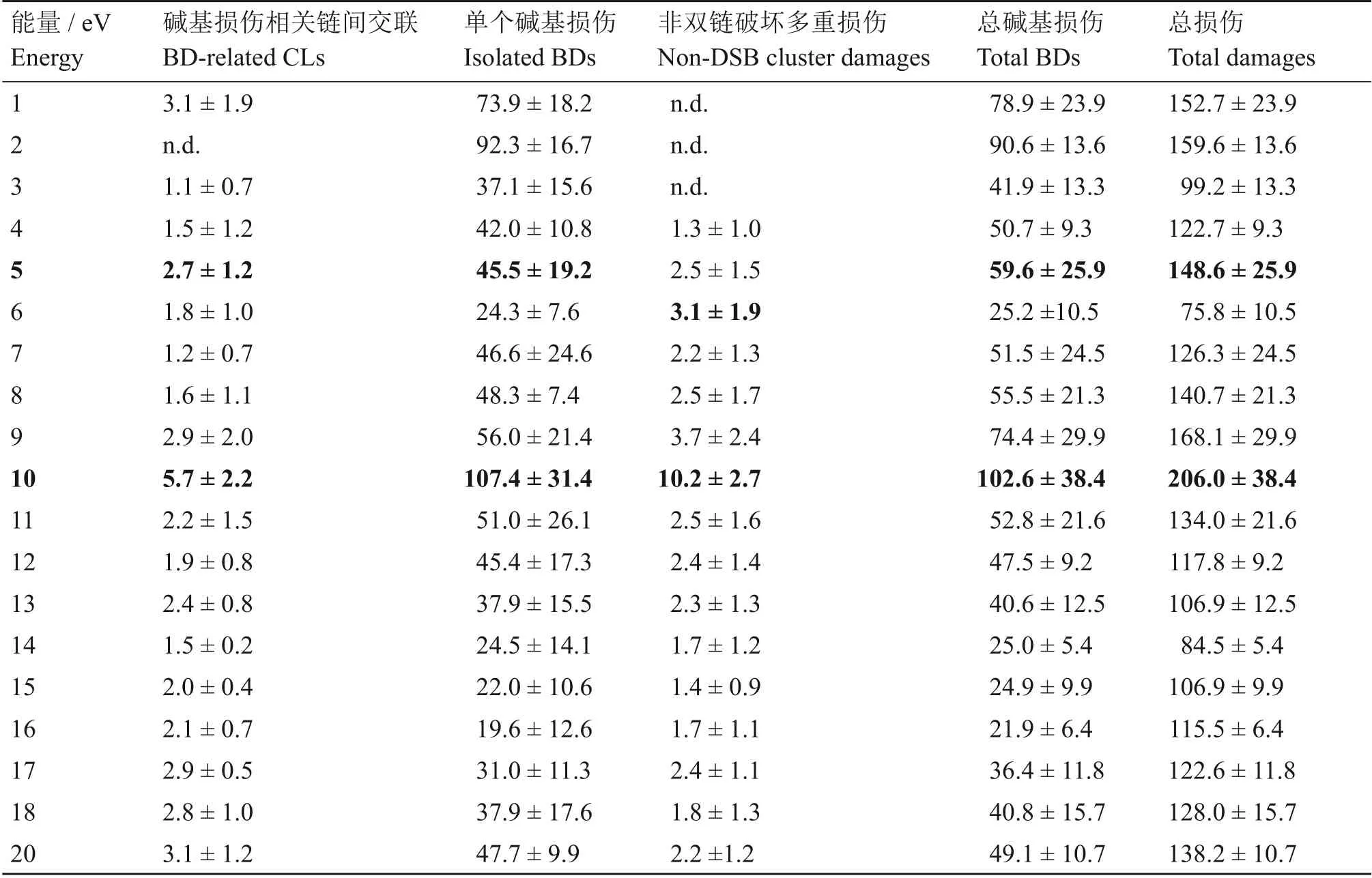
表1 1~20 eV的电子对15 nm厚度的DNA辐射产生与碱基损伤有关的交联、孤立碱基损伤、非DSB的多重损伤,碱基损伤和总DNA损伤的单电子损伤产率(×10−15电子−1分子−1);加粗部分对应峰值Table 1 Single-electron yields of BD related CLs,isolated BDs,non-DSB cluster damage,BDs,total DNA damage induced by 1~20 eV low-energy electrons impact on 5 monolayer DNA films(×10−15 electron−1 molecule−1);the peak values are marked in bold
经碱基切除酶处理后,SC的增加全部转化为孤立的碱基损伤、非DSB的多重损伤以及与碱基损伤有关的交联。孤立的碱基损伤是在DNA链上产生单个的碱基损伤;酶处理后DSB的增加对应于非DSB多重损伤,即在20个碱基对内、对链上两个以上的碱基损伤,或是由一个碱基损伤+对链上的SSB组成的多重损伤。与碱基损伤有关的交联可能是受损的鸟嘌呤被移除后与邻近DNA分子的胸腺嘧啶或胞嘧啶发生反应导致[31]。结果表明:非DSB的多重损伤和与碱基损伤有关的交联的产率至少比孤立的碱基损伤的产率小一个数量级;碱基损伤是电子导致DNA损伤的重要部分,在1~20 eV能量范围其约占总损伤20%~56%。
2.3 DNA多重损伤与低能电子的能量关系
图3显示了CL、与碱基损伤有关的交联、SSB、孤立的碱基损伤、碱基损伤、DSB和非DSB的多重损伤的单电子损伤产率与1~20 eV低能电子的能量关系。最一致的特征是各种损伤的单电子损伤产率在10 eV处都有最高的峰值。CL、与碱基损伤有关的交联、SSB、孤立的碱基损伤,及孤立损伤的单电子损伤产率在5 eV、10 eV有最大值;DSB、非DSB的多重损伤,即多重损伤产率的峰值在6 eV和10 eV;与单个损伤相比,多重损伤的共振峰从5 eV转移到6 eV,可能是因在20个碱基对内产生至少两个损伤,需要更高能量才能导致多个化学键的断裂。损伤-能量关系表明:在5~6 eV和9~11 eV能量区域核激发瞬态阴离子的形成。低于4 eV的电子不能产生DNA的多重损伤,应与在该能量范围内无法形成核激发共振有关;4~15 eV范围内核激发共振形成瞬态阴离子;大于15 eV各种损伤产率都逐渐增长,则与电子的直接散射有关。SSB、单个碱基损伤在低于4 eV电子能量还有一个在2 eV的峰值,应为单电子共振(Shape resonance),这与Martin等[9]发现SSB的产率在2.2 eV处出现峰值一致。能量关系明确证明了低于4 eV电子无法产生DSB,也无法导致非DSB的多重损伤。

图3 交联、与碱基损伤有关的交联、单链断裂、孤立的碱基损伤、碱基损伤、双链断裂和非DSB的多重损伤的单电子损伤产率与低能电子的能量关系;虚线表示共振峰的能量是2 eV、5 eV、6 eV和10 eVFig.3 Single-electron yields of interduplex cross-links,BD-related interduplex,SSBs,isolated BD,BDs,DSBs and non-DSB clustered damage,as a function of electron energy;the dotted lines indicate the energy of the resonance peaks at 2 eV,5 eV,6 eV,and 10 eV
3 低能电子导致DNA多重损伤机制
交联、链断裂、碱基损伤和多重损伤的单电子损伤产率与低能电子的能量关系表明:5 eV、6 eV和10 eV是3个主要的核激发共振能量。在5 eV、6 eV和10 eV,入射电子被电子激发态的碱基所捕获,形成DNA核激发瞬态阴离子。采用碱基的电子能量损伤谱,以及寡聚核苷GCAT的电子激发脱附谱也都证明了DNA组分瞬态阴离子的形成[32-35]。DNA瞬态阴离子(TA)可通过式(4)途径反应。

途径I:电子解离吸附(DEA)导致键的断裂,产生损伤;途径II:自电离过程,脱附的电子(能量小于初始能量E0)可进一步转移至DNA的同链或对链上,同时形成碱基上的解离电子激发态(DNA*),后者可通过n→π*、π→σ*和π→π*跃迁导致碱基损伤[33]。
基于4~20 eV电子可导致在DNA上形成瞬态阴离子,我们提出在20个碱基对内的单个电子导致多重损伤之机制。如图4所示,大于4 eV的低能电子被DNA上的碱基捕获形成瞬态阴离子(TA*−),即形成核激发共振阴离子TA*−(图4(a));TA*−通过DEA过程产生碱基负离子,导致一个碱基损伤(BD)(图4(b)),或图4(a)通过自电离产生激发态碱基和更低能量的电子[36-37];更低能量的电子可迁移至对位链上碱基,产生位于20 bp以内由多个碱基损伤组成的局部多重损伤(图4(c));若自电离的电子进一步转移到互补链的磷酸基团通过DEA过程导致C−O键断裂产生SSB,即形成由一个碱基损伤+互补链上的SSB组成的局部多重损伤,称为非DSB的多重损伤(SSB+BD)(图4(d));若瞬态阴离子解离导致链上C−O的断裂[38-39],即SSB,或生成碱基自由基通过氢消除反应转化为SSB,最终产生对链上的两个单链断裂—DSB(图4(e))。因此,单个电子被碱基捕获电子形成的核激发共振解离,并进一步通过电子转移导致20个碱基内的多重损伤,多重损伤的类型取决于电子受体的位置(即碱基或者磷酸基团),以及碱基损伤转化为链断裂的可能性[40-41]。
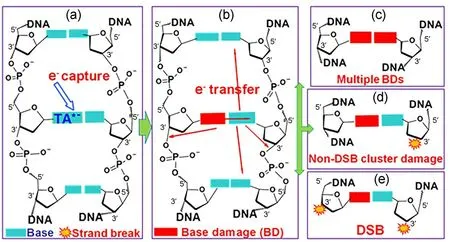
图4 单个LEE导致DNA多重损伤的分子机制[41]Fig.4 Molecular mechanism of a single LEE causing all types of DNA clustered damage[41]
E<4 eV的电子被未填充的碱基π*轨道捕获形成单电子共振,通过DEA过程形成碱基负离子,导致碱基损伤;或电子转移到磷酸基团,通过DEA过程导致C−Oσ键的断裂,形成SSB[36-38,42]。因此,低于4 eV的电子可产生SSB和碱基损伤,但不足以发生核激发共振,故无法产生多个碱基损伤、DSB和非DSB的多重损伤。
4 结论
在超高真空的条件下,1~20 eV低能电子对五分子层厚度的质粒DNA膜进行辐照,通过DNA各种损伤产率与电子能量关系,表明CL、SSB、与碱基损伤有关的交联、孤立的碱基损伤的电子量子产率共振峰在5 eV和10 eV;DSB、非DSB的多重损伤产率的共振峰在6 eV和10 eV;低于4 eV电子无法产生20个碱基对内DNA的多重损伤。DNA损伤产率与低能电子的能量关系揭示了瞬态阴离子的形成及电子转移过程,在分子水平上阐明了单个低能电子导致DNA多重损伤机制,证明瞬态阴离子在导致DNA多重损伤中的重要作用。碱基损伤和多重损伤是DNA损伤的重要组成部分,值得一提的是,电子辐射导致细胞死亡的‘指纹’[18]与图3中的DSB、非DSB的多重损伤完全相符,即在6 eV和10 eV处,证明了低能电子导致DSB和非DSB的多重损伤是细胞死亡最致命的原因。低能电子可有效导致DNA的多重损伤,是构成电离辐射过程中导致细胞死亡的本质原因,因此,低能电子导致遗传分子DNA损伤作用机制的阐明将对揭示辐射致敏机制、靶向放射治疗的应用等都具有重要的科学意义。

