辐照降解黄芪多糖及其抗氧化活性研究
倪茂君 王静霞 张晓彬 彭朝荣,2
1(四川省原子能研究院 成都 610101)
2(辐照保藏四川省重点实验室 成都 610101)
黄芪是中国传统中药材之一,素有“十药九芪”之称,应用十分广泛。黄芪多糖(Astragalus polysaccharide,APS)作为黄芪主要有效成分之一,含量高达10%,主要包含葡聚糖、中性及酸性杂多糖等成分,糖苷键类型以α型为主,β型较少,具有免疫调节、双向血糖调节、抗肿瘤、抗氧化、抗菌及抗病毒等药理作用[1-2]。近年来,低分子量多糖的生物活性受到越来越多的关注。李红法等[3]和刘雅欣等[4]通过分级醇沉方法获得不同分子量黄芪多糖,对其结构组成与生物活性研究发现,低分子量黄芪多糖具有较高的生物活性。王瑞昙[5]研究发现黄芪粗多糖的肠代谢物具有抗S180小鼠肉瘤作用,大分子量的黄芪多糖酸水解产物——小分子量多糖具有增强免疫功能的作用,而高分子多糖类化合物在肠内不易被直接吸收,因此提出“中药多糖是前药”这一假设。
此外,不少研究者发现,通过降解天然大分子多糖,可以获得具有更高生物活性的多糖成分,降解方法亦主要采用微波法[6,8]、超声波法[9,11-13]及氧化法[7,10,14]等自由基降解反应中的一种或两种复合,以提高降解速率和降解产物收率。辐照降解是一种利用高能射线作用于物质,通过引发康普顿效应、电子对效应及自由基等物理化学效应而对物质产生降解作用的方法。已有研究表明,通过辐照技术可以有效降解天然多糖,提高多糖生物活性[15−18],具有操作简单、降解效率高等优势。本研究采用60Coγ射线辐照处理黄芪多糖,重点对15%和30%醇沉所得黄芪大分子多糖部位的辐照降解分子量、抗氧化活性及多糖结构组成变化进行研究和阐述,以期实现大分子黄芪多糖的有效降解,提高黄芪多糖的生物利用度。
1 材料与方法
1.1 原料与试剂
黄芪:产地甘肃省,北京同仁堂健康药业(福州)有限公司;三氯乙酸、正丁醇、三氟乙酸:分析纯(AR),成都市科龙化工试剂厂;无水乙醇、无水甲醇:AR,成都市科龙化工试剂厂;乙腈:优级纯(GR),成都市科龙化工试剂厂;磷酸二氢钠、磷酸氢二钠:AR,成都市科隆化学品有限公司;单糖标准品:纯度99%,上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):AR,美 国Sigma公司;超纯水:18.25 MΩ·cm,实验室自制。
1.2 黄芪多糖的制备
取100 g黄芪片粉碎后过孔径0.425 mm筛,加入500 mL 95%乙醇回流提取2 h,过滤脱去色素及小分子物质,相同条件再提取1次,滤渣于50℃挥干乙醇备用。将脱脂处理后的黄芪粉末分别按10∶1(mL/g)和8∶1(mL/g)水料比,于90℃回流提取两次,每次2 h,过滤合并滤液,浓缩至400~500 mL,按体积比1∶1加入5%三氯乙酸-正丁醇溶液,快速搅拌1 min,静置1 h后离心收集多糖溶液,将多糖溶液继续浓缩至200 mL,加入无水乙醇调醇浓度为80%,收集沉淀,冷冻干燥得黄芪粗多糖。将粗多糖复溶至200 mL,离心除去不容物,加入乙醇,调醇浓度为15%,收集沉淀,冷冻干燥得白色APS 1;剩余溶液继续加入乙醇,调醇浓度为30%,收集沉淀,冷冻干燥得淡黄色APS 2。
1.3 辐照降解
将APS 1和APS 2分别配置成不同浓度溶液装入安倍瓶,封口后采用60Coγ射线辐照不同剂量,辐照后多糖溶液浓缩至1/4体积,5倍乙醇量沉淀降解多糖,除去小分子降解产物后冷冻干燥备用,降解多糖得率(变量记为R)按式(1)计算。辐照源:四川省原子能研究院(29.6×1015Bq)60Co源,动态辐照;吸收剂量采用硫酸亚铁化学剂量计标定。

式中:Wt为不同辐照降解条件下沉淀所得多糖含量;W0为辐照前多糖含量。
1.4 黄芪多糖分子量测定
采用凝胶渗透色谱(Gel permeation chromatography,GPC)法[10]测定分子量。将窄分布的葡聚糖标准品(2 500~5 348 000)和待测样品配成5 mg/mL流动相溶液,经0.45μm滤膜后进样检测,根据保留时间和标准分子量校正曲线,由GPC软件计算样品分子量。检测条件:Waters 515液相色谱仪,检测器为Waters 2410示差检测器;色谱柱为Waters Ultrahyrdogel Linear凝胶色谱柱(300 mm×7.8 mm);流动相为0.2 mol/L硫酸钠(Na2SO4),流速0.60 mL/min;色谱柱柱温为40℃,进样体积20μL。
1.5 DPPH自由基清除能力
参照张宇[19]的方法测试样品的DPPH清除能力。取2 mL一定浓度的黄芪多糖溶液加入2 mL 0.2 mmol/L的DPPH-甲醇溶液,以2 mL DPPH溶液和2 mL双蒸水为底物对照样,混合均匀后避光于37℃反应30 min,在517 nm处检测吸光度A值。DPPH抑制率(变量记为I)按式(2)计算。

式中:Ac为2 mL DPPH溶液和2 mL双蒸水溶液的吸光度;Ai为2 mL多糖样品加2 mL DPPH溶液的吸光度值。
1.6 单糖组成分析
采用高效液相色谱法(High performance liquid chromatography,HPLC),1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)柱前衍生[19]分析黄芪多糖单糖组成。取单糖对照品(甘露糖(Man)、鼠李糖(Rha)、葡萄糖(Glc)、半乳糖(Gal)、木糖(Xyl)、阿拉伯糖(Ara)、葡萄糖醛酸(GlcA)、半乳糖醛酸(GalA))用双蒸水配置成物质的量浓度为40 mmol/L的标准单糖混合溶液,经PMP衍生,将水相稀释成5种不同浓度,经0.45μm滤膜过滤后经HPLC进样分析,以物质的量浓度对峰面积进行回归,制作回归方程。称取黄芪多糖样品5 mg经2 mol/L三氟乙酸(TFA)水解后进行PMP衍生,水相用0.45μm滤膜过滤后供高效液相色谱进样分析,根据回归方程计算各单糖含量。检测条件:色谱柱为Megres C18柱(250 mm×4.6 mm,5μm);流动相A为0.1 mol/L磷酸钠缓冲液(pH=6.8);流动相B为乙腈;检测波长254 nm;柱温30℃;流速1 mL/min;进样量10μL,进行梯度洗脱。
1.7 红外光谱检测
将降解前后多糖样品在真空干燥箱中低温干燥,分别取5~10 mg样品粉末,采用KBr压片,在4 000~500 cm−1进行傅里叶红外光谱扫描。
2 结果与讨论
2.1 吸收剂量对黄芪多糖分子量和得率的影响
图1为在1 mg/mL浓度下,不同吸收剂量对两种黄芪多糖分子量及其得率的影响。

图1 吸收剂量对APS分子量及其得率的影响:(a)APS 1;(b)APS 2Fig.1 Effects of absorbed doseon molecular weight and yield of APS:(a)APS 1;(b)APS 2
从图1看出,两种多糖降解趋势相似,随着吸收剂量的增大,多糖分子量在5 kGy下迅速降低而后趋于稳定。APS 1分子量从1.93×106降解至2.33×104,多糖回收得率随着吸收剂量的增大逐渐降低至44.7%;APS 2分子量从3.92×105快速降低至2.54×104,多糖得率同样随着吸收剂量的增大逐渐降低至39.2%。在水溶液的辐照降解中,γ射线除直接作用于大分子引发降解外,还可激发水分子形成高氧化性的·OH、·H等自由基,与周围的有机大分子RH相互作用,夺取大分子上的氢而促进大分子的降解。当多糖分子量相对较大时,分子链中暴露的活性位点较多[20];而当分子量相对较小时,糖链缩短,暴露的活性位点少,分子量变化幅度小,同时分子量过低会导致弛豫时间缩短,不利于继续降解[21]。在浓度1 mg/mL下,辐照对两种黄芪多糖均有较高的降解速率,但过高的降解速率导致多糖的过度降解,所得黄芪多糖的回收得率较低,应综合考虑多糖降解分子量及其得率,优选降解条件。
2.2 多糖浓度对黄芪多糖分子量与得率的影响
为有效实现多糖的逐步降解和高回收得率,在1 kGy低剂量下考察了不同溶液浓度下其分子量与得率的变化,结果如图2所示。从图2可以看出,在1 kGy低剂量辐照下,两种多糖均随着浓度降低分子量逐步降低,呈现梯度趋势,多糖回收得率均在85%以上,回收率较高。APS 1与未辐照样(Control)相比(a),其分子量逐渐降低至8.28×105,多糖回收率保持在85%以上。APS 2与未辐照样(Control)相比(b),分子量逐渐降低至1.95×105,回收率保持在88%以上。这是由于在相同剂量下,多糖浓度过高时,多糖高分子间易形成胶团且分子排列紧密,分子链不易断裂,从而影响降解效果[9]。表明该条件下辐照降解过程是以激发水分子产生自由基引起的降解为主,因此可以通过调整多糖浓度即含水量实现多糖在低剂量下的降解速率调控。但浓度过低,多糖降解增大,回收率亦逐渐降低。

图2 多糖浓度对APS分子量及其得率的影响:(a)APS 1;(b)APS 2Fig.2 Effects of polysaccharide concentration on molecular weight and yield of APS:(a)APS 1;(b)APS 2
2.3 单糖组成分析
本研究选择8种单糖(Man、Rha、GlcA、GalA、Glc、Gal、Xyl和Ara)作为黄芪多糖的单糖组成分析标准。混合标准单糖经PMP柱前衍生的HPLC分析结果见图3。根据8种单糖的保留时间,对其进行单糖标准品定性验证。8种单糖标准品在254 nm波长处的现行回归方程及相关系数见表1。该方法可有效分离8种单糖,且各单糖在该浓度范围内具有较高的线性关系。

表1 不同单糖的线性方程Table 1 Linearity of different carbohydrates

图3 混合标准单糖液相色谱峰Fig.3 Liquid chromatographic peaks of mixed standard monosaccharide
表2所示为不同降解条件下两种多糖的单糖组成与物质的量比。从表2结合红外光谱法分析可知,APS 1为α型葡聚糖,并含有少量的Man、GalA、Gal、Xyl和Ara,各单糖物质的量比为0.24∶0.19∶22.07∶0.36∶0.08∶0.51。随着分子量降低,Man、Glc物质的量含量逐渐降低,其余单糖几乎降解完全。这可能是由于分子量降低在酸解过程中Glc易被氧化使得副反应增大有关。APS 2为酸性杂多糖,主要含有Man、Rha、GalA、Glc、Gal、Xyl和Ara,各单糖物质的量比为0.37∶0.13∶2.89∶0.38∶0.52∶0.10∶1.22。辐照降解后,随着分子量减小,Xyl完全降解;Glc含量则先减小,后增大;其余各单糖物质的量含量则随着分子量减小呈现先增大后减小的趋势,当分子量为8.25×104时,各单糖物质的量含量较高。

表2 辐照降解对黄芪多糖单糖组成的影响Table 2 Effect sof irradiation degradation on monosaccharide composition of Astragaluspolysaccharide
APS 1与APS 2辐照降解后单糖组成与物质的量比的变化可能是由于体系中不同糖苷键类型、单糖本身在支链和主链分布不均[9]以及糖苷键断裂致使端基异构化等因素造成的。Gomez等[22]的研究发现,降解导致糖醛酸质量分数降低,表明其可能变化成内酯,与抗氧化活性变化有关。此外,APS 2纯度较APS 1低,在辐照降解过程中可能因杂质降解而使降解后APS 2纯度提高,各单糖物质的量含量增大,有利于多糖的纯化和生物活性提高。
2.4 降解黄芪多糖红外光谱分析
图4为APS 1及APS 2在质量浓度为1 mg/mL条件下未经处理的辐照冻干样品红外光谱图。从图4可以看出,APS 1在3 431 cm−1处为羟基伸缩振动,2 930 cm−1处为C−H键伸缩振动,1 645 cm−1处为羟基弯曲振动,1 425 cm−1处为−CH2和CH3基团,1 154 cm−1处为糖环上C−O−C伸缩振动,1 080 cm−1和1 024 cm−1为醇羟基变角吸收峰,930 cm−1弱峰为端基碳C−H弯曲振动峰,846 cm−1为α-型糖苷键,700~500 cm−1为环呼吸峰等。表明APS 1是α-吡喃型糖链结构,与单糖组成结构分析结果一致。经不同剂量辐照后,APS 1从5 kGy开始在1 726 cm−1出现吸收峰,并随着吸收剂量的增大而逐渐增大,930 cm−1和846 cm−1处逐渐减小消失。1 154 cm−1、1 080 cm−1和1 024 cm−1合并为一个峰,表明降解体系中糖苷键断裂,糖含量减少,有大量羰基和C−O结构的小分子化合物生成。
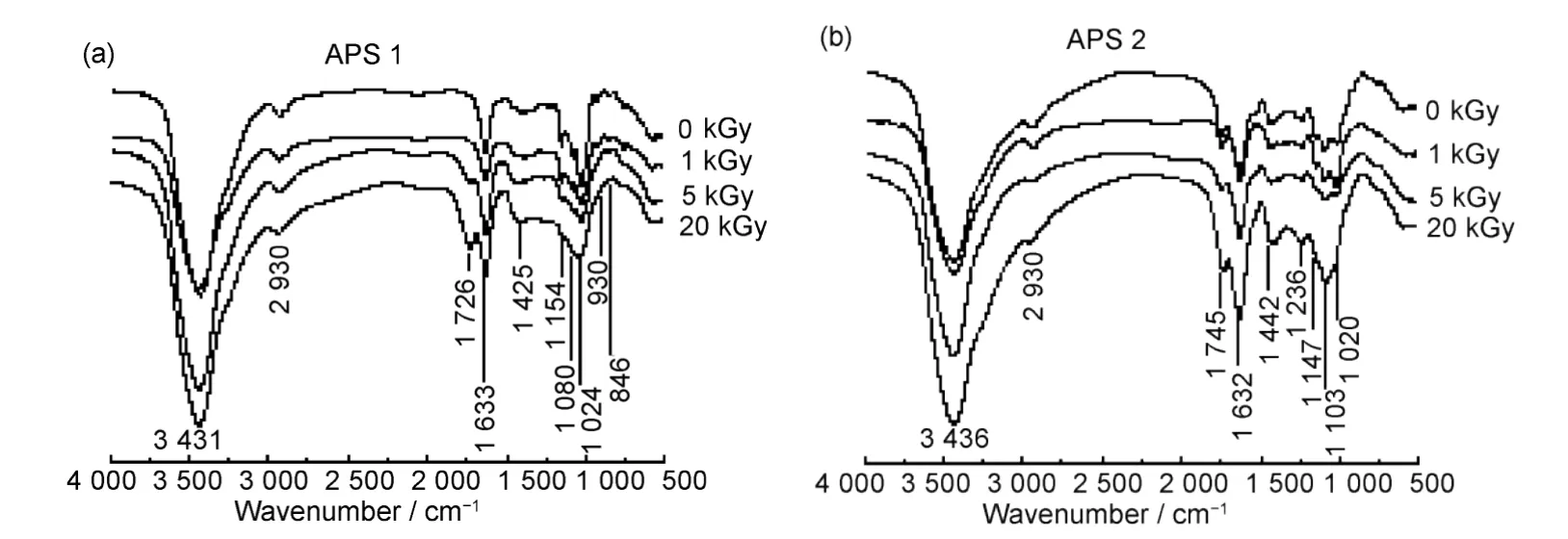
图4 APS及辐照降解多糖红外光谱分析:(a)APS 1;(b)APS 2Fig.4 FTIR-spectra analysis of APS and irradiation degradated APS:(a)APS 1;(b)APS 2
APS 2红外光谱中除多糖特征峰(3 436 cm−1、2 930 cm−1、1 632 cm−1、1 425cm−1、1 147 cm−1、1 103 cm−1、1 020 cm−1)外,在1 745 cm−1处有糖醛酸羰基特征峰,在1 238 cm−1处有硫酸酯S=O键特征峰,920 cm−1、887 cm−1和828 cm−1有微弱的特征峰,表明APS 2中可能含有α-糖苷键、β-糖苷键,如图3所示。APS 2为含糖醛酸的杂多糖,糖纯度较低导致其指纹图谱区特征峰不明显。随着吸收剂量增加,1 745 cm−1处特征峰逐渐增大,1 147~1 020 cm−1特征峰逐渐消失,合并到1 100 cm−1形成宽峰,900~700 cm−1指纹区特征峰基本消失,表明高剂量下小分子糖单元结构破坏,生成含C−O、C=O结构的小分子化合物,与APS 1结果一致。
不同辐照条件下APS 1及APS 2中羰基峰面积(1 726~1 745 cm−1)与羟基峰(1 632~1 645 cm−1)面积比列于表3。如表3显示,APS 1在5 kGy出现羰基峰,其峰面积比随着剂量而增大;APS 2中羰基峰面积比值在5 kGy下变化不大,而后逐渐增大,但其变化值较APS 1小。该羰基峰可能是由降解小分子多糖继续反应生成,与图1中分子量变化与回收得率结果相一致。武小芬等[17]通过研究木聚糖干粉辐照发现,当吸收剂量达到200 kGy以上时,木聚糖糖苷键断裂生成低分子糖,当剂量达到400~1 200 kGy,降解的小分子单糖在辐照作用下,进一步发生氧化、降解、异构和重排等反应,生成小分子醛、酮、酸类化合物及分子内脱水闭环、氧化等生成呋喃类化合物。本文所述黄芪多糖的辐照反应在水溶液中进行,如上所述,当吸收剂量达到5 kGy时,多糖分子量迅速降低至105以下,溶液中高氧化性自由基与小分子多糖反应,从而释放出羰基,经过分子重排、反应可能生成醛酮类化合物、糠醛化合物及不饱和糖基化合物等。APS 2中糖醛酸及杂多糖的存在可能导致其降解产物与APS 1的差异。

表3 不同吸收剂量下羰基峰面积与羟基峰面积比Table 3 Peak area ratio of carbonyl and hydroxyl group under different absorbed doses
辐照降解体系回收所得产物的红外光谱如图5所示。由图5可知,APS 1中回收所得降解多糖与降解混合体系相比,1 726 cm−1处特征峰消失,而930 cm−1和846 cm−1处特征峰增强,与未辐照样红外特征峰一致;APS 2辐照降解前后红外特征峰的结果一致。这一结果表明,通过辐照降解黄芪多糖,多糖以糖苷键断裂为主,分子量逐步降低,分子结构及活性基团无明显改变;采用醇沉回收可以有效去除小分子降解产物,回收方法可行。
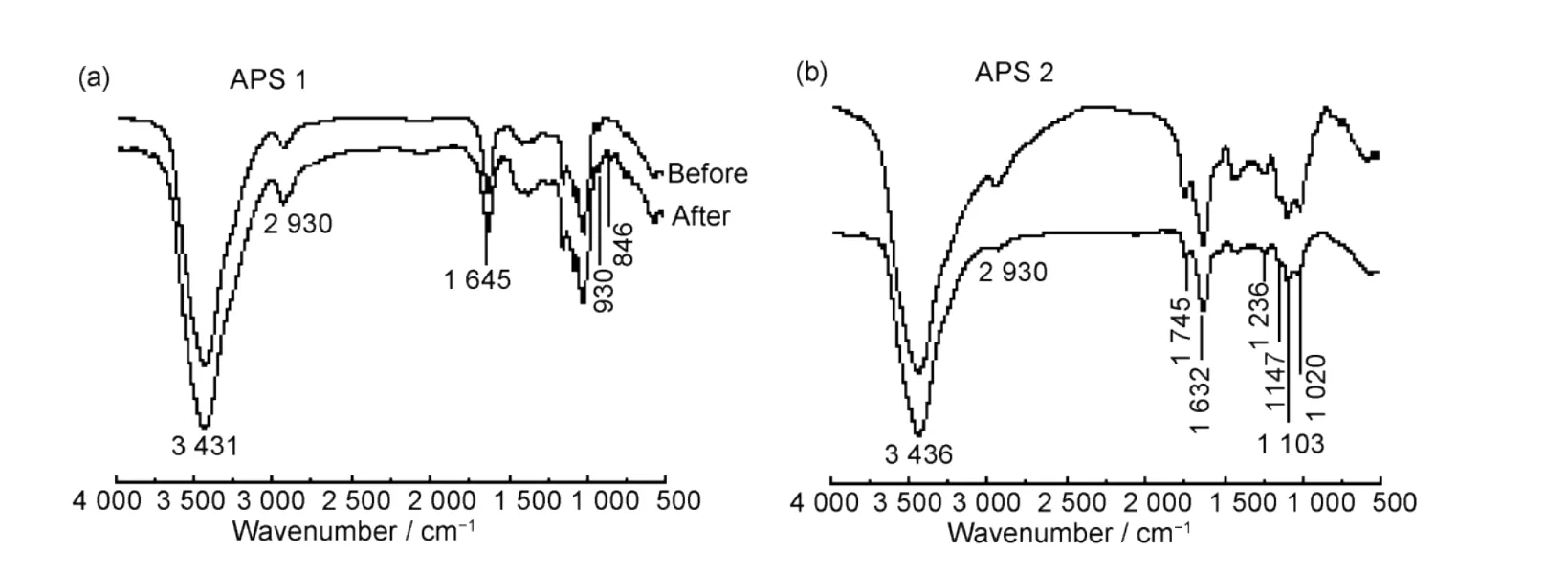
图5 辐照降解前后黄芪多糖红外光谱分析:(a)APS 1;(b)APS 2Fig.5 FTIR-spectra analysis of APS before and after irradiation:(a)APS 1;(b)APS 2
2.5 黄芪多糖的抗氧化活性
辐照降解条件下黄芪多糖对DPPH的抑制率结果如图6所示。APS 1对DPPH的抑制率随着分子量的降低从3.55%增大到20.53%,在分子量为23.3×104时具有最大值,随着分子量进一步降低抑制率下降。APS 2对DPPH的抑制率随着分子量降低从15.23%增大到29.61%,在分子量为8.25×104时具有最大值,随着分子量进一步降低抑制率同样下降。从自由基抑制结果可以看出,分离所得两种大分子多糖的抗氧化活性差异较大,APS 2抗氧化活性显著高于APS 1,这是由于两种多糖分子量及多糖结构组成造成的[3-5],在降解过程中APS 2对DPPH抑制率的提高率并未显著高于APS 1。

图6 APS 1(a)、APS 2(b)对DPPH的抑制活性Fig.6 Inhibitory activity of APS 1(a)and APS 2(b)on DPPH
已有相关研究表明,通过降解提高多糖抗氧化活性的可能原因是:具有更好水溶性,活性部位与自由基接触面积变大[11];分子柔韧性改变[11];空间结构发生改变,分子间作用力及氢键作用力减弱[14];更多羟基与自由基直接反应增强[13];供氢能力增强,通过提供氢与自由基形成稳定结构[10]等。APS 1分子量较大,溶解性和均一性较差,通过辐照降解后分子量迅速降低,有利于提高APS 1的水溶性,实现上述各因素的转变,因此其抗氧化活性提高较明显。APS 2为黄芪多糖主要活性成分,降解过程中可能导致其活性基团如糖醛酸含量的降低而使其活性降低。王凌等[23]相关研究表明,糖醛酸质量分数越高抗氧化活性越好。但多糖生物活性是多种因素的综合效应,因此其他因素包括化学组成、空间结构、侧链等的不同可能导致其活性的不同。
3 结论
初步分析了不同分子量和结构组成的黄芪多糖的辐照降解及其抗氧化性的相关性。结果表明:在5 kGy以下辐照即可显著降低多糖分子量,通过浓度控制可以在低剂量辐照降解黄芪多糖,回收得率高,多糖基本结构组成和活性基团无显著变化。降解多糖在一定范围内分子量与抗氧化活性呈负相关,在较低分子量下其抗氧化活性降低。因此,可通过低剂量辐照实现大分子多糖的适度降解,提高大分子多糖生物活性,但辐照降解对多糖空间结构造成的改变还有待进一步研究。此外,APS 1主要成分为大分子葡聚糖,在大多数中药材和植物中含量较高,但其溶解性差,生物活性低,通常在提取分离中基本作为低活性或无活性成分去除。通过辐照降解提高该部分多糖的溶解性和生物活性,将有利于天然多糖资源的利用和开发。

