UPLC-MS/MS分析京尼平苷酸在大鼠体内的组织分布研究
肖晓燕 冯果,2△ 李玮,2 许琴 周志容 黄侨宗 任晨晨 彭礼珍
(1.贵州中医药大学药学院,贵州 贵阳 550025;2.国家苗药工程技术研究中心,贵州 贵阳 550025)
京尼平苷酸为环烯醚萜类化合物,在车前子、杜仲中含量较高,为杜仲中主要有效活性成分之一。研究[1-4]表明京尼平苷酸具有保肝利胆、修复损伤脊髓、提高记忆力、抗炎等多种生物活性。京尼平苷酸为京尼平苷一相代谢产物,两者结构相似,前者有抗炎活性[5]。目前,京尼平苷酸的研究集中在含量测定、提取纯化、生物活性方面,而对其在大鼠体内的组织、血浆分布研究尚有欠缺。因此,本实验采用UPLC-MS/MS,初步探讨口服给药后,京尼平苷酸在大鼠各组织的分布情况,为京尼平苷酸的临床应用、剂型研制提供参考,同时也为其他中药(京尼平苷酸为主要活性成分)的研究提供参考意义。
1 材料与方法
1.1仪器与药品试剂及动物 仪器:超高压液相质谱联用系统Waters Quattro Premier XE/Acquity UPLC(沃特世公司),质谱联用系统API 4000 Qtrap,(购于美国应用生物系统公司,包含有ESI和APCI接口离子源,2台岛津LC-20AD泵,Analyst Software 1.5.2色谱工作站,SIL-20AC恒温自动进样器,CBM-20A控制器,CTO-20A柱温箱),LT1002E电子天平(常熟市天量仪器有限责任公司),DS113T超声波清洗机(天津市富城达科技有限公司)、JA2003电子分析天秤(上海舜宇恒平科学仪器有限公司)、H1650台式高速离心机(湖南湘仪实验室仪器开发有限公司,50Hz)。药品与试剂:京尼平苷酸(Geniposidic acid,北京博易汇科生物技术有限公司,批号:27741-01-1,纯度>98%),新绿原酸(博易汇科生物有限公司,批号:170304,纯度>98%),色谱纯甲醇(Fisher公司,批号:180920),色谱纯乙腈(Fisher公司,批号:187255),甲酸(北京迈瑞达科技有限公司,批号:185326),二甲基亚砜(DMSO,美国Tedia公司,批号:20180911),肝素钠(天津生物化学制药有限公司,批号:201805),生理盐水(贵州天地有限公司,批号:A18091203),其他试剂均为分析纯。动物:SPF级SD大鼠,雄性,体质量(200±20)g,购于湖南长沙市天勤生物技术有限公司,合格证号SCXK(湘)2018-0011。大鼠于室内保持12 h光照,12 h避光循环饲养,给予标准饲料和饮用水,控制室内温度(25.0±1.0)℃,相对湿度(50.0±10.0)%。
1.2方法
1.2.1标准溶液的配制 京尼平苷酸标准溶液的配制:精密称取京尼平苷酸对照品适量,少量DMSO溶解后,甲醇/水(20:80)配制成浓度为1.00 mg/mL的标准贮备液,临用时稀释,于4℃储存。内标溶液的配制:取新绿原酸对照品适量,少量DMSO溶解后,甲醇/水(20:80)配制成浓度为100 μg/L的溶液,于4℃储存。
1.2.2样品预处理 组织匀浆液的制备:取各组织样品加液氮研磨,加入3倍组织重量的生理盐水,涡旋混匀,制得组织匀浆液。组织样品的处理:移取组织匀浆液50 μL,加入5 μL甲醇溶液,加入200 μL甲醇/乙腈(1:1)溶液,涡旋混合2 min,8 000 r/min,离心15 min,取10 μL上清液,用UPLC-MS/MS进行测定。
1.2.3检测条件 色谱条件:Phexnomonex F5色谱柱(3.0 mm×50 mm,2.6 μm),流动相:0.1%FA水(A)-0.1%FA乙腈(B),梯度洗脱(0~0.50 min,10%B;0.50~2.00 min,60%B;2.00~2.10 min,90%B;2.10~3.50 min,90%B;3.50~3.60 min,10%B;3.60~5.00 min,10%~0%B),流速0.5 mL/min,进样量3 μL,进样器温度4℃,柱温为室温。质谱条件:采用电喷雾离子源(ESI),负离子模式,离子源参数雾化电压IS为-4 500.00/+5 500,辅助加热器GS2为60.0,离子源温度TEM设定600.0℃,气帘气CUR为30.0,雾化气GS1为50.0,扫描方式为多反应离子监测模式(MRM),检测离子对为京尼平苷酸m/z 373.0→123.1,新绿原酸m/z 353.2 → 179.0,碰撞能量分别为57,-24eV。
1.3方法学考察
1.3.1专属性试验 取空白组织液50 μL,加入适量京尼平苷酸和150 μL内标溶液,按1.2.2方法处理,在上述检测条件下,内源性物质不干扰京尼平苷酸及新绿原酸的测定, UPLC-MS/MS谱图见图1。
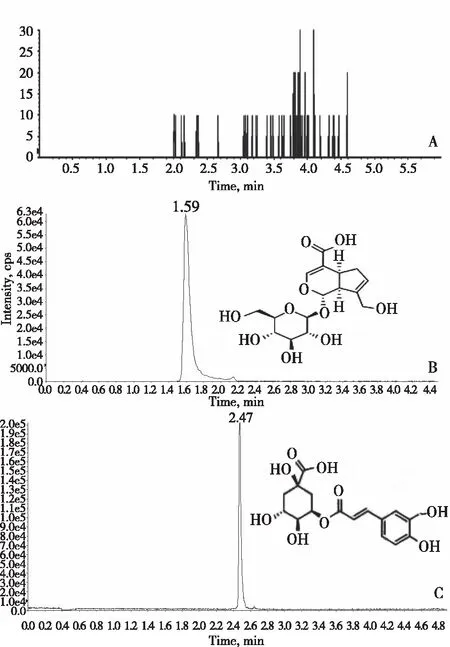
注:A.空白胃组织匀浆液;B.空白胃组织匀浆液+京尼平苷酸;C.空白胃组织匀浆液+内标。图1 大鼠胃组织匀浆液 UPLC-MS/MS图
1.3.2标准曲线和定量下限 取空白组织液50 μL,加入适量京尼平苷酸标准系列溶液、150 μL内标溶液,按1.2.2方法处理,配成浓度为0.1、0.2、0.5、1.0、2.0、5.0、10.0、20.0、50.0、100、150 μg/L组织样品。在上述检测条件下,记录峰面积,以京尼平苷酸、浓度(C,μg/L)为横坐标,京尼平苷酸面积和新绿原酸峰内标峰面积的比值(As/Ai)为纵坐标,用最小二乘法进行线性回归,结果见表1。表明京尼平苷酸在浓度0.1~150 μg/L线性关系良好,定量下限为0.1 μg/L。

表1 京尼平苷酸在不同组织中的标准曲线数据(μg/L)
1.3.3精密度与准确度试验 取空白组织液50 μL,加入京尼平苷酸溶液适量、150 μL内标溶液,按1.2.2方法处理,配成浓度为0.2、20、100 μg/L组织样品,分别在1 d内和连续3 d内进样测定。京尼平苷酸各组织液样品的日内、日间精密度和准确度的RSD和相对误差(RE)结果见表2。表明京尼平苷酸在不同组织中,精密度和准确度均符合要求。

表2 京尼平苷酸在不同组织中的精密度和准确度试验结果
1.3.4提取回收率和基质效应 提取回收率:配制三个浓度为0.2、20、100 μg/L组织液样品,每种浓度6份用UPLC-MS/MS进行测定,记录京尼平苷酸的峰面积A1;取空白组织液50 μL,加入京尼平苷酸溶液适量、150 μL内标溶液,按1.2.2方法处理,配成浓度为0.2、20、100 μg/L组织样品,记录峰面积A2;计算组织液中峰面积和不经任何处理峰面积的比值A2/A1,即为提取回收率。组织液基质效应:取不同浓度的京尼平苷酸标准品溶液,加入内标溶液,配制浓度为0.2、20、100 μg/L组织样品,记录峰面积A3,将已处理空白组织液配制的标准品溶液峰面积A2与相应浓度的标准品直接进样的峰面积A3比较,计算基质效应。结果表明京尼平苷酸在不同组织中的提取回收率和基质效应均符合要求。见表3。

表3 京尼平苷酸在不同组织中的提取回收率和基质效应
1.3.5稳定性试验 取空白组织液50 μL,加入京尼平苷酸溶液适量、150 μL内标溶液,按1.2.2方法处理,配成浓度为0.2、20、100 μg/L样品,分别于24 h,1、7、14 d解冻,-20℃冰箱中保存14 d,考察其稳定性,结果京尼平苷酸24 h内、反复冻融三次、-20℃冰箱中保存14 d相对稳定,RSD均小于10.0%。另外,取20 μg/L的质控样品,分别用空各组织液稀释20倍,每组6份,每份浓度为1 μg/L,测定结果表明稀释倍数实验的精密度的RSD及相对误差均在10%以内,符合生物样品分析方法要求。见表4。

表4 京尼平苷酸在不同组织中的稳定性试验
1.4组织分布实验 灌胃液的配制:精密称取京尼平苷酸标准品适量,用生理盐水溶解并定容,配成浓度为3.0 mg/mL的水溶液。组织样品的采集:健康SD大鼠10只,体质量(200±20)g,随机分为3组,每组3只,1只作为空白组,取空白组织;给药前12 h禁食不禁水,灌胃给药后(60 mg/kg),分别在0.5、1.5、3 h腹腔注射3%的戊巴比妥钠(2 ml/kg)麻醉大鼠,经腹主动脉取血后,分别取大鼠的心、肝、脾、肺、肾、胃等组织,用4℃生理盐水冲洗干净,用滤纸吸干,称重,于—80℃下保存备用。组织样品的处理按1.2.2方法处理。各组织浓度的计算:各组织中京尼平苷酸的浓度采用以下公式[10]计算:Ct=CsVs/P,其中,Ct代表组织浓度(μg/g),Cs代表组织液浓度(μg/L),Vs代表组织液的体积,P代表组织的质量。
2 结 果
实验结果表明,京尼平苷酸在不同组织中分布差异较大。给药0.5 h后,各组织中京尼平苷酸的质量分数排序为胃>肾>心>脾>肺>肝;给药1.5 h后各组织的质量分数排序为胃>心>肾>肺>脾>肝;给药3.0 h后各组织的质量分数排序为心>胃>脾>肾>肺,肝组织测不到浓度。见表5。

表5 京尼平苷酸在大鼠不同组织中的质量分数
3 讨 论
本实验采用UPLC-MS/MS,研究口服给药后,京尼平苷酸在大鼠各组织的分布情况。实验结果表明口服给药后,京尼平苷酸主要分布在胃和肾组织。京尼平苷酸在不同组织的分布速度有差异,在肝、脾、肾组织中0.5 h达质量分数最大值,肺、心、胃在1.5 h达质量分数最大值。说明京尼平苷酸在肝、脾、肾组织分布速度较快,在0.5 h能达到达质量分数最大值,随着时间的延长,肝、脾、肾组织中浓度逐渐降低,3.0 h后肝组织未检测到药物的存在;而肺、心、胃组织中药物质量分数在1.5 h达到最大值后也逐渐降低,但胃组织中下降的速度较其它组织快。京尼平苷酸极性大,易溶于亲水性溶剂,难溶于亲脂性溶剂,研究表明,极性较大的化合物难以透过血—脑屏障到达脑部发挥作用。由于药物在体内分布复杂、易受其它因素影响,本实验初步探讨口服给药后,京尼平苷酸在大鼠心、肝、脾、肺、肾、胃几个重要组织中的分布情况,存在一定的局限性。后续将从不同给药途径、京尼平苷酸理化性质、药理作用等方面,进行药物代谢动力学研究,以阐明其在体内的动态变化和代谢情况,为其临床应用及剂型深入开发提供参考。

