抑制PCSK9对人主动脉内皮细胞钙化的保护作用
靳天慧,陈 亮,2,刘叶红,盛 瑛,2,宗刚军,2
血管钙化在动脉粥样硬化性心脑血管疾病以及肾功能衰竭的患者中非常普遍。内皮细胞和血管平滑肌细胞的衰老,细胞外基质沉积以及血管周围脂肪组织的炎症反应等机制都参与了血管钙化的发生和发展。前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin kexin type 9,PCSK9)由参与动脉粥样硬化的多种细胞(如内皮细胞、平滑肌细胞和巨噬细胞)表达,并在人的动脉粥样硬化斑块内被检测到。PCSK9通过激活巨噬细胞,释放促炎细胞因子,来调节炎症,这是钙化的关键因素。单次注射获得功能突变的PCSK9腺相关病毒载体,可在没有基因修饰的小鼠中诱发心血管钙化。因此,PCSK9有可能成为新的预防和治疗血管钙化性疾病方法的潜在分子靶点。该研究旨在探讨抑制PCSK9对人主动脉内皮细胞(human aortic endothelial cells,HAEC)钙化的保护作用。
1 材料与方法
1.1 材料
HAEC购于美国ATCC细胞库。DMEM高糖培养基、胎牛血清购于美国Gibco公司;胰酶细胞消化液、Western及IP细胞裂解液购于上海碧云天生物技术有限公司;RNA快速提取试剂盒购于上海奕彬生物科技有限公司。一抗骨形态发生蛋白(bone morphogenetic protein,BMP)2、BMP4购于美国Abcam公司;一抗PCSK9购于美国Abways公司;LipofectamineTM 3000 购于美国ThermoFisher公司;引物由生工生物工程(上海)股份有限公司合成;小干扰RNA si-PCSK9购于北京擎科生物科技有限公司;HiScript Reverse Transcriptase、ChamQ SYBR qPCR Master Mix购于南京诺唯赞生物科技有限公司。1.2 方法
1
.2
.1
细胞培养与分组 HAEC在含有10%胎牛血清+1%双抗(青霉素和链霉素)的DMEM高糖培养基中培养,置于5% CO、37 ℃培养箱中。① 磷酸盐在血管钙化中起着核心作用,分别使用(0、10、30、50 mmol/L)β甘油磷酸+50 μg/ml L-抗坏血酸+100 nmol/L 地塞米松刺激HAEC 10 d,筛选出诱导细胞钙化的最佳浓度并检测PCSK9的表达。② 将生长状态良好的HAEC接种至12孔板,随机分为阴性对照组(siNC)及PCSK9抑制组(siPCSK9-1、siPCSK9-2、siPCSK9-3),待细胞密度达到90%,用LipofectamineTM 3000进行siRNA转染,48 h后验证转染效率。③将对数生长期HAEC接种于12孔板,随机分为对照、钙化、钙化+siNC、钙化+siPCSK9组。待细胞汇合度大于70%,钙化+siNC组、钙化+siPCSK9组用LipofectamineTM 3000进行siRNA转染,48 h后钙化、钙化+siNC、钙化+siPCSK9组用30 mmol/L β甘油磷酸+50 μg/ml L-抗坏血酸+100 nmol/L地塞米松诱导HAEC钙化。1
.2
.2
qRT-PCR检测BMP2、BMP4、RUNX2、PCSK9的mRNA表达情况 采用RNA快速提取试剂盒提取总RNA,用分光光度计检测RNA纯度和浓度。使用诺唯赞逆转录试剂将总RNA反转录为cDNA。按照SYBR说明进行引物扩增。引物序列见表1。
表1 qRT-PCR目的基因的引物及siRNA的序列
1
.2
.3
Western blot法检测BMP2、BMP4、PCSK9的蛋白表达情况 用细胞裂解液提取总蛋白。通过12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离等量的蛋白质,并将其转移到PVDF膜上。用5%BSA在摇床上封闭1h,一抗在4°C下孵育过夜。用TBST洗涤3次后,将PVDF膜与相应的二抗室温孵育1h。再次用TBST洗涤3次,使用发光液分析条带强度。1
.2
.4
茜素红S染色观察细胞内的钙化沉积 去除培养液后,用PBS溶液洗细胞。将细胞在4%多聚甲醛中室温固定30 min。随后,用PBS洗涤细胞3次,每次5 min。加入茜素红S染液(1%,pH 4.2)浸染8 min,用PBS快速冲洗,显微镜下观察钙化沉积。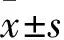
2 结果
2.1 筛选诱导HAEC钙化的最佳浓度
使用地塞米松联合L-抗坏血酸和β甘油磷酸的方法诱导HAEC钙化,保持地塞米松(100 nmol/L)和L-抗坏血酸(50 μg/ml)浓度不变,分别加入0、10、30、50 mmol/L的β甘油磷酸处理细胞。qRT-PCR结果显示,诱导HAEC钙化10 d后,β甘油磷酸浓度为30 mmol/L时,主要钙化指标BMP2(t
=-12.83,P
<0.001)、BMP4(t
=-4.54,P
<0.05)、RUNX2(t
=-5.60,P
<0.05)的基因表达水平明显高于0 mmol/L,见图1。Western blot结果显示,当β甘油磷酸浓度为30 mmol/L时,BMP2、BMP4的蛋白水平升高最明显,见图2。因此选取浓度为30 mmol/L的β甘油磷酸进行后续实验。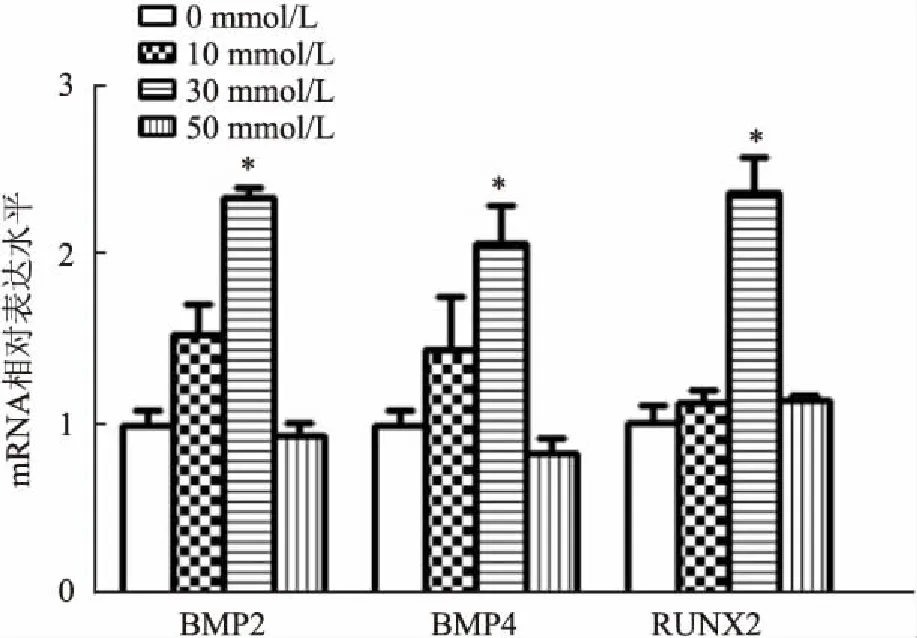
图1 qRT-PCR检测不同浓度β甘油磷酸处理后HAEC的BMP2、BMP4、RUNX2基因表达水平与0 mmol/L比较:*P<0.05
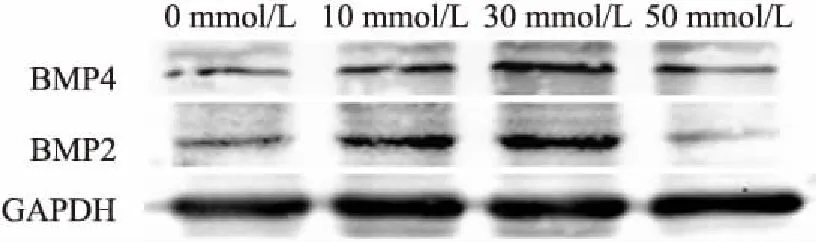
图2 Western blot 检测不同浓度β甘油磷酸处理后HAEC的BMP2、BMP4蛋白表达水平
2.2 HAEC钙化时PCSK9的表达水平升高
选用β甘油磷酸(30 mmol/L)联合地塞米松(100 nmol/L)和L-抗坏血酸(50 μg/ml)诱导HAEC钙化,10 d后收取细胞,设置为钙化组。同期以PBS处理的细胞为对照组。qRT-PCR结果提示在诱导HAEC发生钙化后,细胞内PCSK9的mRNA表达水平增加(2.35±1.39)倍(t
=-3.16,P
<0.05)。此外,Western blot结果也显示,在体外诱导HAEC钙化后,细胞内PCSK9的蛋白表达水平也明显高于对照组,见图3。2.3 小干扰RNA(siRNA)对HAEC中PCSK9的敲低验证
根据不同设计序列分别采用3种siRNA转染HAEC,提取RNA并反转录后采用qRT-PCR检测细胞内PCSK9的表达。结果显示,siPCSK9-2对HAEC中PCSK9表达的抑制作用最为明显,较阴性对照组下调(48.36±14.41)%,抑制效果最佳(t
=4.32,P
<0.05),见图4。Western blot结果显示,转染3种siRNA后,siPCSK9-2的蛋白表达水平明显低于阴性对照组,见图5。因此选取siPCSK9-2作为敲低PCSK9的工具进行后续试验。
图3 qRT-PCR与Western blot检测HAEC的PCSK9基因和蛋白表达水平
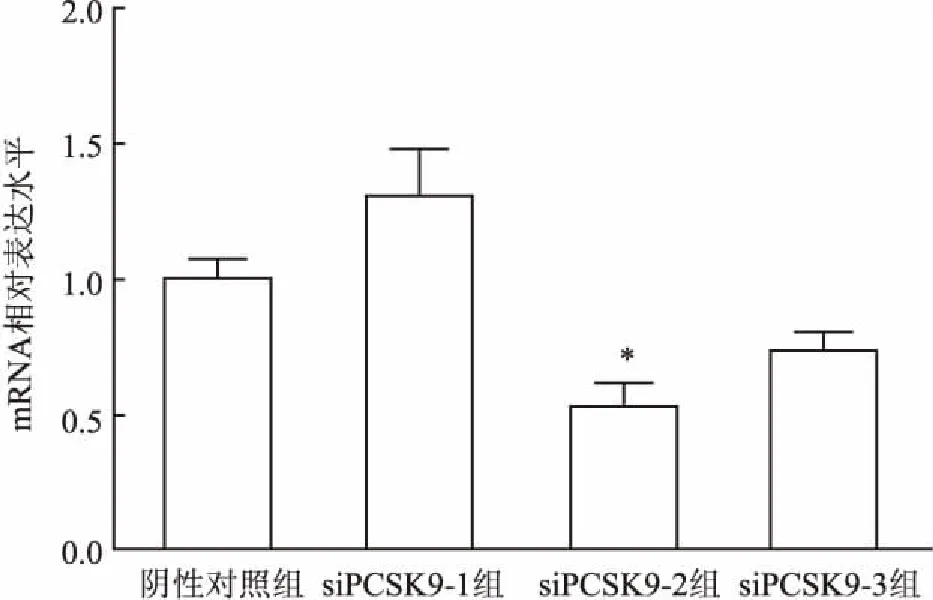
图4 qRT-PCR检测HAEC的PCSK9基因表达水平 与阴性对照组比较:*P<0.05
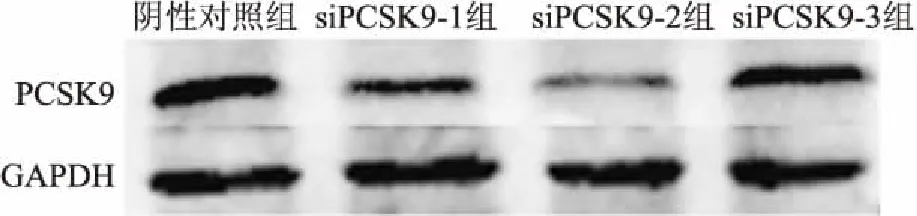
图5 Western blot 检测HAEC的PCSK9蛋白表达水平
2.4 抑制PCSK9对HAEC钙化的影响
采用siPCSK9-2转染细胞后,以同样的方法诱导HAEC钙化,观察PCSK9敲低后对HAEC钙化的影响。qRT-PCR结果显示,在相同钙化诱导条件下,敲低PCSK9(钙化+siPCSK9组)抑制了细胞内BMP2(t
=10.45,P
<0.001)、RUNX2(t
=10.78,P
<0.001)的基因表达水平(与钙化组相比),见图6。进一步通过Western blot检测细胞内主要钙化指标的蛋白表达水平,结果显示在同等诱导钙化的条件下,敲低PCSK9抑制了细胞内BMP2、BMP4的蛋白表达水平,见图7。茜素红S染色观察细胞内钙盐沉积的形态学改变,结果显示敲低PCSK9后细胞内的钙盐沉积较正常钙化组减少,见图8。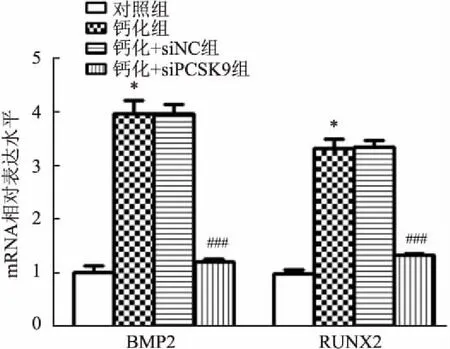
图6 qRT-PCR检测HAEC的BMP2、Runx2基因表达水平
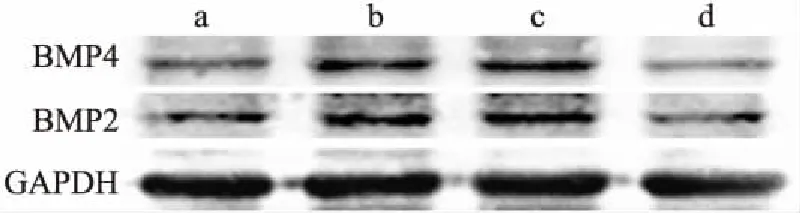
图7 Western blot检测HAEC的BMP2、BMP4蛋白表达水平

图8 茜素红S染色检测HAEC的钙化沉积 ×200
3 讨论
血管钙化是血管疾病的常见和严重并发症,其增加了糖尿病和动脉粥样硬化的发病率和病死率,并与充血性心力衰竭、心肌梗死、全身性高血压和慢性肾脏疾病的风险增加有关。以前被认为是不受控制的矿物质沉淀的最终过程,现在确定它是一种多方面的疾病,受其血管位置,钙化细胞起源和许多调节途径的特性影响。起初,由于钙化主要见于中膜,所有焦点都集中在内侧细胞,包括血管平滑肌细胞和周细胞。然后病灶扩大,包括所有血管层的细胞,包括外膜和内皮。内皮在维持血管稳态方面起着重要作用,并参与许多生理功能,包括调节血压,促进血管生成和控制凝血过程。内皮细胞通过内皮间质转化有助于血管钙化。研究表明100 nmol/L 地塞米松、50 μg/ml L-抗坏血酸和10 mmol/L β甘油磷酸可诱导人血管平滑肌细胞成骨分化。高浓度的β甘油磷酸、地塞米松和L-抗坏血酸可以诱导HAEC钙化。矿物质稳态的破坏和高磷酸盐水平被认为是慢性肾脏病中血管钙化的主要决定因素。即使肾功能正常,血清中磷酸盐的增加也与心血管病死率和冠状动脉钙化有关,提示磷酸盐在血管钙化的病理生理中起重要作用。因此,课题组分别用0、10、30、50 mmol/L的β甘油磷酸处理细胞,筛选诱导HAEC钙化的最佳浓度。
PCSK9是前蛋白转化酶家族的第9个成员,已成为开发新的降胆固醇药物和干预动脉粥样硬化治疗的热门靶点。PCSK9可能通过独立于低密度脂蛋白受体的机制促进炎症、内皮功能障碍和高血压,从而加速动脉粥样硬化。因此,抑制PCSK9是一种有前途的治疗方法。使用PCSK9抑制剂进行治疗的目的是降低循环中PCSK9水平。治疗方法包括结合循环PCSK9(单克隆抗体和修饰的结合蛋白)或减少该蛋白在肝脏的生成(siRNA)。有研究表明,与对照组相比,钙化性主动脉瓣狭窄患者主动脉瓣中PCSK9表达较高。用成骨培养基处理人瓣膜间质细胞,PCSK9水平升高,而PCSK9中和抗体减少钙积累。多廿烷醇可降低循环PCSK9水平,抑制钙化标志物,并减轻主动脉钙化,表明多廿烷醇可部分通过抑制PCSK9的表达而发挥抗钙化作用。除肝脏外,PCSK9在其他组织中也高水平表达,其功能尚不清楚,可能是内皮调节预防或治疗血管钙化的有用靶点。需要进一步的研究来了解PCSK9在血管钙化的发病机制中的潜在新作用。
本研究采用不同浓度的β甘油磷酸联合L-抗坏血酸和地塞米松诱导HAEC钙化,筛选出最适合体外诱导HAEC钙化的药物浓度。观察显示体外诱导HAEC钙化时细胞内PCSK9的表达水平升高。进一步通过siRNA敲低细胞内PCSK9的表达,采用同样方法诱导HAEC钙化后观察到,敲低PCSK9抑制了HAEC中主要钙化指标的表达以及钙盐沉积。上述结果提示PCSK9参与了HAEC钙化的发生发展,可能作为影响血管钙化的表观遗传因子发挥重要的调控作用,对于进一步研究PCSK9调节血管钙化的分子机制具有重要意义。

