掺锶TiO2纳米管涂层种植体的促成骨性能研究
朱 晔,温黎明,李 任,毕文娟,于津建,郑天霞,戚孟春
钛(Ti)及其合金由于其优良的机械性能和生物相容性,被广泛用作生物医学材料。然而,Ti基金属生物活性较差,钛表面的骨生长机制主要取决于表面微结构的骨传导,而不是骨诱导。为了赋予Ti种植体良好的生物活性,目前多种Ti金属表面改性技术已经被应用于诱导骨生成。其中,阳极氧化是制备具有纳米管状TiO涂层的一种技术,其结构有利于细胞的黏附和增殖,从而提高种植体的骨整合性能;还可以容纳生物活性药物,一些金属元素被负载其中,可赋予种植体更佳的骨生成诱导能力,其中,锶(Sr)是对促进骨生成具有较大价值的元素之一。该实验拟将Sr掺入TiO纳米管中,验证该涂层的促成骨性能。
1 材料与方法
1.1 材料
TA2 钛片、钛种植体购于广州泰沃克公司; Sr(OH)、CCK-8 试剂盒购于上海麦克林公司; MC3T3-E1细胞购于上海生命科学院细胞库;BCA 蛋白定量检测试剂盒购于上海碧云天生物科技公司;ALP 检测试剂盒购于南京建成生物工程研究所;SD大鼠由华北理工大学动物实验中心提供。1.2 器械
电子扫描显微镜(Scanning Electron Microscope,SEM)(JSM-IT100,日本JEOL)、X射线衍射仪(D/MAX-rB,日本理学公司)、原子力显微镜(Atomic Force Microscope, AFM)(Flex-Axiom,瑞士Nanosurf公司)表面接触角测量仪(DH-HV,北京哈科试验仪器厂)、电感耦合等离子体光谱仪(ICAP7000 Plus,美国赛默飞)均由华北理工大学实验检测中心提供。1.3 方法
1
.3
.1
体外实验试件制备 实验所用的试件均为 TA2 圆形钛片,厚度0.3 mm,直径33 mm,分为以下3组:Ti组,纯钛片经过物理、化学抛光后备用;TiO组,纯钛片经过物理、化学抛光后进行阳极氧化处理,电解液配比如下:0.5%质量百分比氟化铵、3%的HO 及 97%体积百分比的乙二醇,构建TiO纳米管涂层;TiO+Sr组,TiO纳米管涂层经过加入Sr(OH)溶液的水热反应处理,具体方法为:在马弗炉内胆中配制 6.2 g/L 浓度的Sr(OH)溶液后,将TiO纳米管试件浸泡于其中,置于 400 ℃下 3 h。1
.3
.2
体内实验分组 选取 TA2 纯钛种植体,种植体全长 8.5 mm,种植体螺纹间距 0.5 mm,螺纹高度0.5 mm。根据植入种植体类型不同,将体内实验分为以下3组:Ti、TiO、TiO+Sr组,制作方法与上述1.3.1相同。1
.3
.3
试件表面特征检测 试件表面微观形貌用SEM进行观察,对试件的表面微观形貌进行观察;采用SEM相配合的能谱分析对涂层表面元素组成进行分析;采用X射线衍射仪对构建的涂层进行晶相分析;采用原子力显微镜对表面涂层的粗糙度(roughness,Ra)进行测量。采用表面接触角测量仪,测量去离子水在不同涂层上的接触角,检测涂层亲水性;采用电感耦合等离子体光谱仪测量掺 Sr 涂层的Sr离子的释放浓度。1
.3
.4
试件表面促进细胞黏附、增殖及成骨性能的体外实验 使用荧光显微镜观察细胞初期黏附:将钛片置于6孔板,吸取细胞悬液以 1×10个/ml 接种于钛片上,培养2 h后使用4%多聚甲醛溶液进行细胞固定1 h,再加入0.5%的 Triton-X,静置 20 min,再加入鬼笔环肽和DAPI 染色剂,使用荧光显微镜进行观察并对黏附细胞数目进行定量评价;使用CCK-8法检测细胞增殖活性:细胞接种方法如上,于第1、4、7和11天使用CCK-8试剂盒检测450 nm波长下吸光度(optical density, OD)值;检测细胞碱性磷酸酶活性(alkaline phosphatase activity assay,ALP),细胞接种方法如上,更换培养基为含2%胎牛血清和成骨诱导液的完全培养基,于4和7 d检测各组ALP活性,各组试件细胞的ALP活性采用ALP测定试剂盒检测,检测520 nm波长下的OD值。1
.3
.5
试件表面促进细胞增殖及成骨性能的体内实验 选取9只麻醉后体质量为 200 g左右的1月龄雌性SD大鼠[华阜康SCXK(京)2014-004],经华北理工大学动物伦理委员会批准(LX2019060),将大鼠随机分组,于大鼠左侧股骨干骺端使用牙科种植机钻头进行备洞,植入不同组种植体。在种植体植入后 1月和 3月,脱颈方法处死大鼠取材,将带种植体的股骨使用Micro-CT扫描。在重建的三维图像上分析感兴趣区域(range of interests,ROI),即骨髓腔内种植体螺峰外周围 1 mm 的圆柱形(直径 4 mm)区域。检测指标为骨体积分数即矿化骨体积(bone volume,BV)占骨组织总体积(tissue volume, TV)的百分比[(BV/TV)×100%]。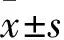
2 结果
2.1 试件涂层表面形貌观察
试件涂层表面形貌观察见图1。Ti组表面平坦,可见不规则划痕和凹坑;TiO组可见“蜂窝状”排布的纳米管,管口呈圆形或椭圆形;TiO+Sr组可见经过水热反应以后,TiO纳米管变得不规则,且管壁增厚,管径变小。
图1 各组涂层表面微观形貌SEM和AFM观察A: Ti组;B: TiO2组; C: TiO2+Sr组
图2 各组涂层表面元素分布(EDS)和X射线衍射仪分析(XRD)A: Ti组;B: TiO2组; C: TiO2+Sr组
2.2 试件涂层表面元素分布和晶相分析
试件涂层表面元素分布观察见图2、表1。TiO+Sr组可检测到Sr元素存在;XRD分析显示,经过阳极氧化,TiO组相对于Ti组的锐钛矿型增加,基底矿型减少,说明Ti组由基底矿型向锐钛矿型转变,并出现了金红石相矿峰,TiO+Sr组除了上述矿峰以外,还有钛酸锶的矿峰。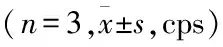
表1 各组试件表面EDS元素含量分析
2.3 试件涂层表面粗糙度和亲水性分析
试件涂层表面粗糙度和亲水性分析见表2。通过AFM检测Ra显示,与Ti组相比,TiO组Ra升高;TiO组和TiO+Sr组差异无统计学意义;测量涂层表面亲水性显示,与Ti组相比,TiO组水接触角变小,TiO+Sr组最小。
表2 涂层表面粗糙度和亲水性分析
2.4 Sr
释放检测
单位时间内Sr释放浓度见图3。在1~3 d内Sr大量释放,直至3d后释放趋于稳定,30 d后释放浓度几乎可忽略不计。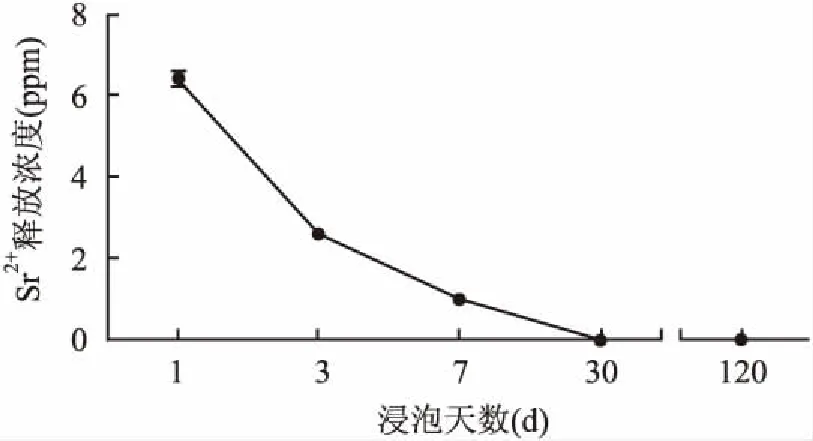
图3 Sr2+释放浓度分析
2.5 试件表面MC3T3-E1细胞黏附、增殖活性检测
由图4、表3可见,2 h时通过荧光显微镜观察细胞黏附情况显示,TiO+Sr组细胞数量(17.66±1.52)最高,Ti组细胞数量(10.00±2.64)最低。于1、4、7和11 d时,对涂层表面细胞增殖使用CCK-8法检测OD值,TiO+Sr组OD值在各时间点均最高,Ti组最低,且差异有统计学意义(P
<0.05)。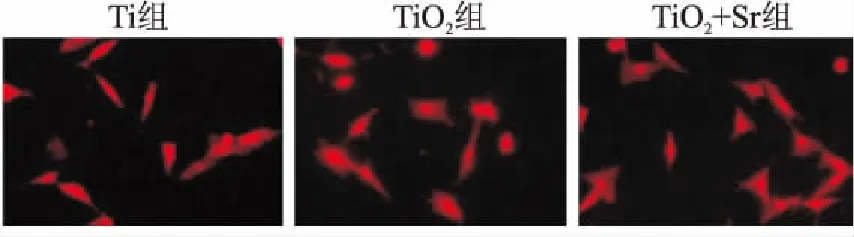
图4 各组试件表面细胞初期黏附的荧光显微镜观察
表3 4 涂层表面细胞增殖CCK-8法检测吸光度值
2.6 试件表面MC3T3-E1细胞ALP活性检测
MC3T3-E1细胞的ALP活性检测由表4所示。 4、7 d时, TiO+Sr组ALP活性最高,Ti组最低,且差异有统计学意义(P
<0.05)。
表4 各试件表面MC3T3-E1细胞的ALP活性检测分析
2.7 Micro-CT检测
种植体植入1月和3月的SD大鼠股骨Micro-CT检测由图5、表5所示。3D重建和横截面影像图显示,1月和3月时TiO+Sr组周围骨小梁密度最高,Ti组最低,种植体周围ROI区域BV/TV比值分析显示,TiO+Sr组周围骨体积量最大。
表5 种植体植入1月和3月的SD大鼠股骨Micro-CT检测分析
3 讨论
目前,为构建具有优良生物相容性的新型骨修复种植体,实现提高种植体的骨结合目的。越来越多的研究者开始从纳米尺度对Ti种植体表面进行改性处理,以期为细胞提供一个稳定可控的微环境。
TiO纳米管结构对细胞行为具有显著影响, TiO纳米管能够促进MC3T3-E1细胞肌动蛋白骨架的组装,利于其黏附,同时可以提高骨功能相关基因的早期表达水平。与此同时,它可以充当一个很好的药物的载体。大量研究证实负载生物活性成分的TiO纳米管结构,表现出比单纯 TiO纳米管更好的促进细胞成骨分化性能。与此同时,生物相容性元素(Ag、Sr等)在骨组织修复和再生中起着重要作用。其中,Sr在成骨分化上具有优异的表现,Andersen et al利用磁控溅射技术沉积SrTiO涂层,Sr不断地从涂层中释放,促进了新骨生成。
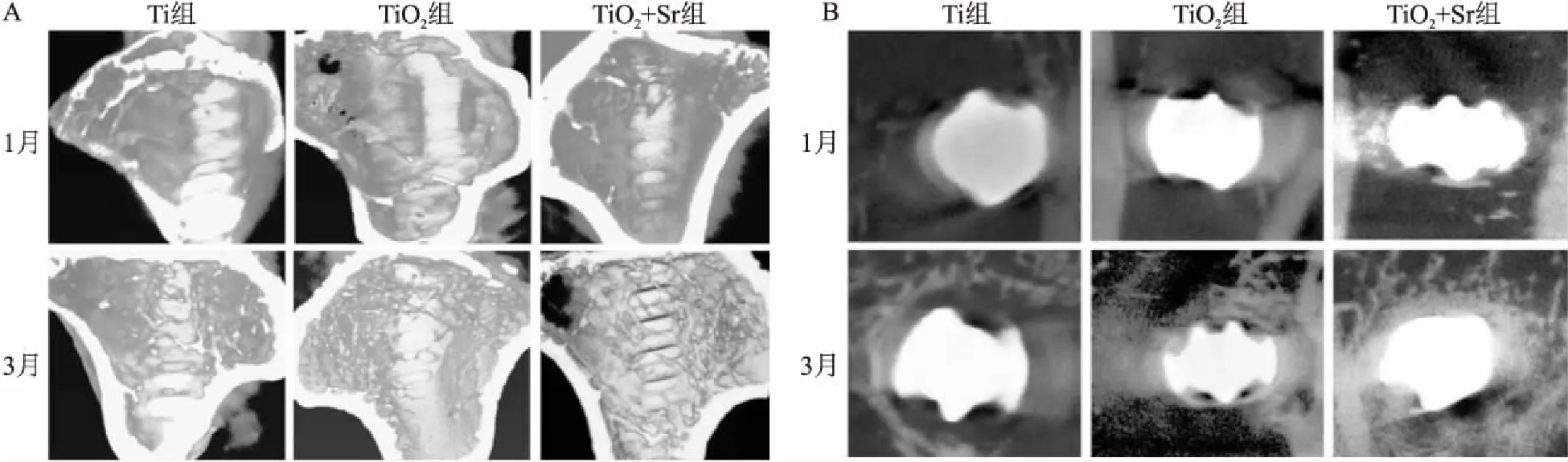
图5 各组种植体Micro-CT检测 A:3D重建纵切面截面图;B:种植体横截面影像图
本实验对涂层理化性能检测显示,通过将TiO纳米管涂层浸入Sr(OH)溶液中经过水热反应,成功构建了掺Sr-TiO纳米管涂层,相较于纯Ti表面,掺Sr-TiO涂层的粗糙度和亲水性显著增加。对Sr释放浓度检测表明,涂层中的SrTiO涂层释放的Sr在细胞黏附和增殖期均存在有效剂量的释放,细胞增殖荧光显微镜观察和CCK-8检测细胞增殖结果显示Sr的释放有利于细胞的初期黏附和增殖,而细胞增殖状态好坏是影响骨生成的重要条件。
ALP活性的高低可反映出成骨定向分化能力和细胞促矿化能力。ALP检测结果说明涂层中Sr的释放可有效提高MC3T3-E1细胞ALP活性。为了分析TiO+Sr组对细胞成骨能力的影响,在各组种植体植入大鼠股骨1、3月后,对带有种植体的股骨进行了Micro-CT扫描。ROI区域分析结果显示,植入1、3月后,TiO+Sr组种植体周围骨量均要显著地高于其他2组,说明种植体中Sr的释放有利于骨生成。
综上所述,课题组利用AO在纯钛片表面构建了TiO纳米管,并通过水热反应成功地将Sr掺入,对涂层的理化性能进行了表征检测分析;体外细胞学研究表明,掺Sr-TiO纳米管涂层显著地提高了 MC3T3-E1细胞的增殖和成骨分化能力;体内实验证实,掺Sr-TiO纳米管种植体显著促进了种植体与周围骨组织的骨结合能力。

