铁酸锌磁性纳米颗粒诱导活性氧及促死亡自噬杀伤肾癌细胞的实验研究
杨荷宇,张 力,3,4,闻慧琴,温诚浩,王 辉,梁朝朝,3
肾细胞癌是源自肾实质泌尿小管上皮系统的恶性肿瘤。据统计,2020年美国预计新发肾癌病例数73 750例,预计死亡病例数14 830例。早期肾癌患者可行手术治疗,而部分患者在初次就诊时已发生远处转移,并且转移性肾癌患者对化疗或免疫治疗不敏感。因此,对早期肾癌进行灵敏特异的诊断以及摆脱转移性肾癌的治疗困境,具有重要的临床意义。
纳米材料是指至少在三维空间中的一维处于纳米尺度(1~100 nm)范畴内的材料,其中,铁酸锌纳米颗粒(zinc ferrite nanoparticles, ZF NPs)因其优良的特性而备受关注。较于传统MRI造影剂,ZF NPs不仅能更加清晰地显示狭窄的血管,还在抗肿瘤等方面具有广阔的应用前景。在肾癌诊断中,MRI可区分良性实体肿块与肾细胞癌亚型,明确肿瘤的组织学分级,并可避免不必要的手术。该文主要研究ZF NPs的抗肿瘤效应,并进一步探讨活性氧(reactive oxygen species,ROS)及自噬在ZF NPs杀伤肾透明细胞癌Caki-1中的关联与调控机制,旨在为临床诊疗肾癌提供新的思路。
1 材料与方法
1.1 主要试剂与仪器
六水合三氯化铁(FeCl·6HO)(美国Sigma Aldrich公司);氯化锌(ZnCl)、聚乙二醇、氨水(北京国药集团);MTT、二甲基亚砜及海藻糖(德国Bio Froxx公司);ROS检测试剂盒(上海碧云天生物技术研究所);抗LC3B抗体(美国Proteintech公司);渥曼青霉素(美国MCE公司);荧光显微镜(日本Olympus公司);流式细胞仪(美国Beckman公司)。1.2 材料合成
称取1.514 g的FeCl·6HO与0.382 g的ZnCl溶于25 ml去离子水中,磁子搅拌至溶液澄清,加入5 g聚乙二醇,继续搅拌形成溶液A。配置0.7%的氨水溶液,在磁子搅拌下,迅速向溶液A中加入25 ml的氨水溶液,混合溶液在超声破碎机下超声30 min后,100 ℃下加热30 min。冷却至室温,溶液继续在超声破碎机下超声30 min后,去离子水稀释溶液,0.22 μm滤膜除菌。1.3 细胞株及细胞培养
人肾癌Caki-1细胞株购自中国科学院细胞库(北京);在37 ℃、5% CO培养箱中培养,DMEM培养液中添加10%胎牛血清及青、链霉素各100 U/ml。胰蛋白酶定期消化细胞进行传代培养,取对数生长期细胞用于实验。1.4 细胞活力检测
Caki-1细胞以4×10个/ml接种于96孔板,贴壁后每孔分别加入不同浓度或种类的药物定容至100 μl,并设置细胞活力对照组。培养24 h后,每孔加入20 μl MTT溶液(5 mg/ml)培养4 h,吸弃上清液,每孔加入150 μl二甲基亚砜,使用酶标仪以490 nm波长测定各孔吸光度。1.5 细胞内ROS测定
Caki-1细胞以1.2×10个/ml接种于12孔板,贴壁后每孔分别加入不同浓度或种类的药物定容至1 ml,并设置ROS对照组。培养6 h后,去除细胞培养液,每孔加入1 ml无血清培养基稀释的DCFH-DA荧光探针(10 μmol/L)孵育20 min,PBS洗涤3次,荧光显微镜观察染色情况并随机选取视野拍照,每个视野细胞总数大于1 000个。观察结束后,胰蛋白酶消化收集细胞,并置于流式管中用于流式细胞仪检测。1.6 TEM观察自噬的产生
Caki-1细胞以2.5×10个/ml接种于6孔板,贴壁后加入药物定容至2 ml,并设置自噬对照组。培养24 h后,细胞刮收集细胞。加入电镜固定液重悬后4 ℃固定12 h,室温下2%四氧化锇固定1 h。细胞用梯度乙醇分级脱水并包埋在环氧树脂中,将样品切成超薄切片并染色后TEM观察。1.7 Western blot检测标志蛋白
RIPA裂解液提取各组细胞蛋白,加入上样缓冲液后沸煮15 min使蛋白彻底变性。在电泳缓冲液中进行聚丙烯酰胺凝胶电泳后,将蛋白质转移至硝酸纤维素膜(NC膜)上,含5%脱脂奶粉的TBST封闭1 h,加入1 ∶500的LC3一抗或1 ∶500的GAPDH一抗,4 ℃过夜,TBST洗5次,加相应二抗孵育1 h,TBST洗膜5次后显色发光。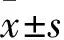
2 结果
2.1 ZF NPs的理化表征
TEM结果显示,ZF NPs的尺寸形貌为长约20 nm的纳米短棒;由于材料表面有聚乙二醇修饰,该纳米短棒可很好地分散在水溶液中;动态光散射分析显示,ZF NPs的粒径分布信息与TEM观察到的纳米棒的尺寸吻合,稍大的粒径对应若干个纳米棒的堆叠;X射线衍射图谱显示ZF NPs各衍射峰的峰位与ZnFeO标准卡片JCPDS (22-1012)的(311)、(400)、(422)、(511)衍射峰位置一致,样品符合尖晶石型结构的ZnFeO;室温条件下磁学性能测试显示ZF NPs具有良好的顺磁性。见图1。2.2 ZF NPs对Caki-1细胞的生长抑制作用
不同浓度(1、5、10、11、12、13、14、15 μg/ml)ZF NPs处理Caki-1细胞24 h,MTT结果显示,细胞活力随ZF NPs浓度的增加而下降(F
=414.0,P
<0.01);14 μg/ml的ZF NPs分别处理细胞6、12、24 h,细胞活力随着时间的延长而下降(F
=289.1,P
<0.01)。见图2。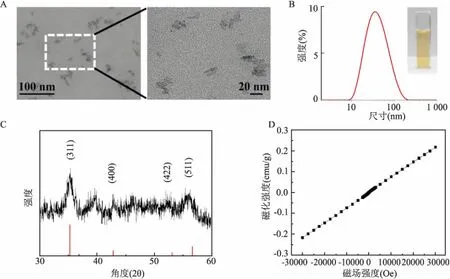
图1 ZF NPs理化表征
2.3 ZF NPs诱导ROS杀伤Caki-1细胞
不同浓度(1、5、10、14 μg/ml)ZF NPs处理Caki-1细胞6 h后,DCFH-DA染色显示,随着ZF NPs浓度的提高,ROS的积累在不断增加;14 μg/ml的ZF NPs分别处理Caki-1细胞1、2、4、6 h后显示,ROS的积累随着时间的延长也在增加,见图3。N-乙酰-L-半胱氨酸(N-Acetyl-L-cysteine, NAC)是一种含巯基的抗氧化剂,可保护细胞免受氧自由基的损害。将5 mmol/L的NAC与14 μg/ml的ZF NPs联合处理细胞6 h,ROS的积累减少;相同浓度下NAC与ZF NPs联合处理细胞24 h后,MTT结果显示,ZF NPs单独处理后Caki-1细胞的细胞活力为(59.81±3.95)%,而ZF NPs+NAC组的细胞活力为(80.93±3.24)%,高于ZF NPs单独处理组,差异有统计学意义(F
=82.07,P
<0.01)。见图4。2.4 ZF NPs诱导促死亡自噬杀伤Caki-1细胞
自噬是一个吞噬自身细胞质蛋白或细胞器并将其包裹进入囊泡,与溶酶体融合形成自噬溶酶体,降解其包裹内容物的过程。因此,通过TEM观察到自噬泡是检测自噬产生的金标准。使用14 μg/ml ZF NPs处理Caki-1细胞24 h后,TEM显示Caki-1细胞中自噬泡数量增多(图5A红箭头所示)。当自噬发生时,存在于胞质中的微管相关蛋白轻链3(microtubule associated protein 1 light chain 3,LC3)一型(LC3-I)会被特异性地剪切成绑定在自噬体膜上的LC3-Ⅱ,故LC3-Ⅱ蛋白积累水平的高低代表了自噬水平的高低。使用14 μg/ml 的ZF NPs处理Caki-1细胞6 h后,Western blot结果显示,LC3-Ⅱ蛋白的积累增多,将1 μmol/L的自噬抑制剂渥曼青霉素(wortmannin,Wort)与14 μg/ml的ZF NPs联合处理细胞6 h后,LC3-Ⅱ蛋白的积累则减少(F
=21.90,P
<0.01)。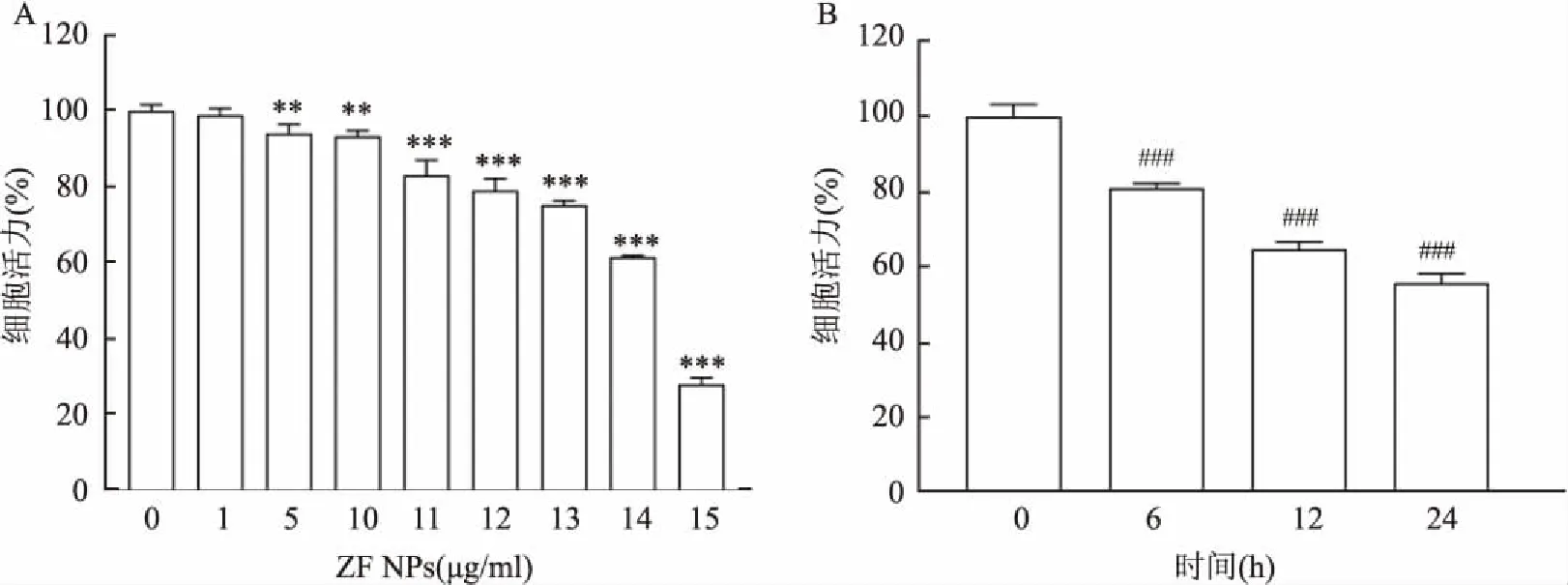
图2 ZF NPs对Caki-1细胞活力的影响
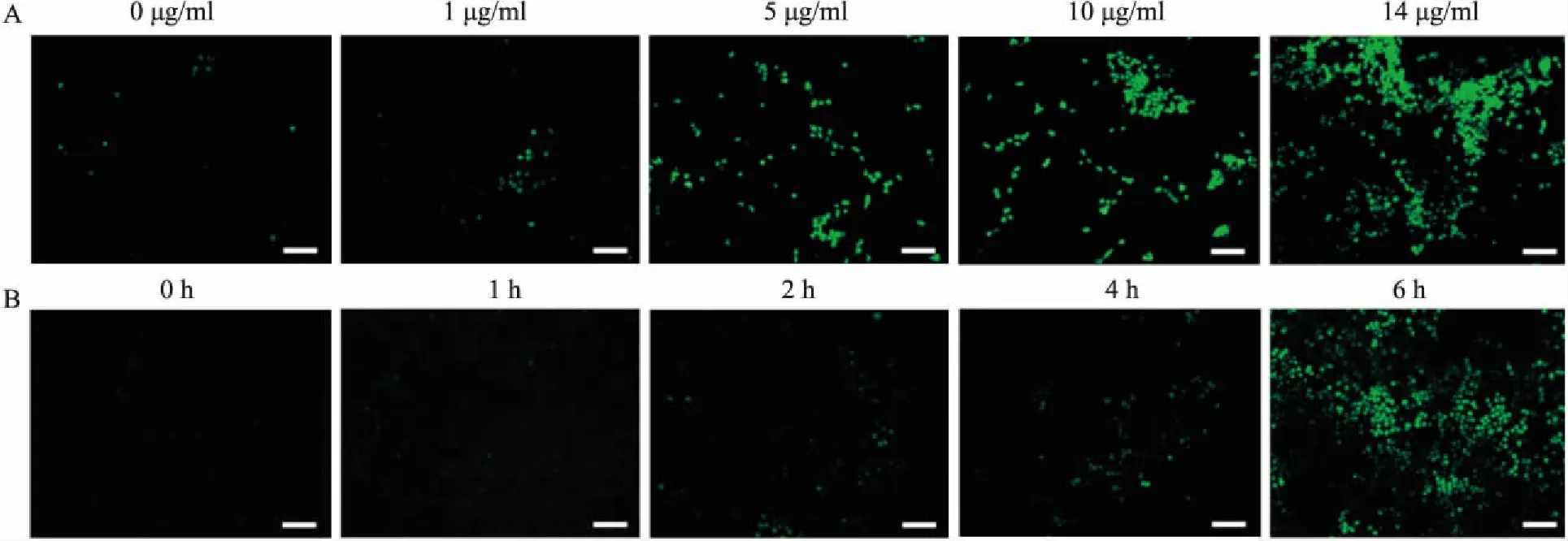
图3 DCFH-DA 染色观察ZF NPs诱导Caki-1细胞产生ROS ×100
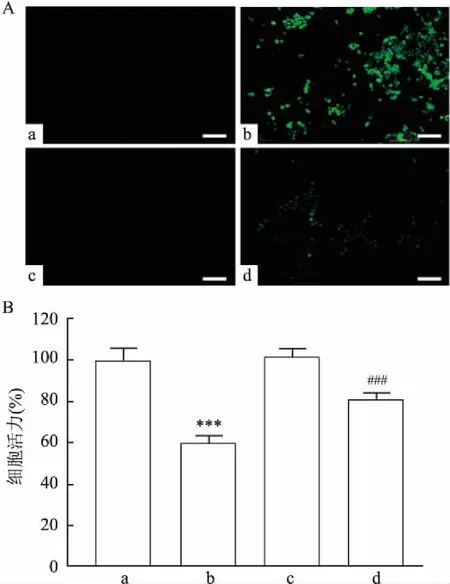
图4 NAC对ZF NPs杀伤Caki-细胞的抑制作用
使用14 μg/ml的ZF NPs分别与Wort(1 μmol/L)、自噬增强剂海藻糖(Trehalose)(50 mmol/L)共处理24 h后,MTT结果显示,相较于ZF NPs单独处理组,ZF NPs+Wort组的细胞活力回升(F
=18.98,P
<0.01);而ZF NPs+Trehalose组的细胞活力则下降(F
=476.6,P
<0.01),见图5。2.5 ZF NPs诱导ROS及促死亡自噬交互调控杀伤Caki-1细胞
14 μg/ml的ZF NPs与50 mmol/L的Trehalose联合处理Caki-1细胞时,分别加入Wort(1 μmol/L)、NAC(5 mmol/L),6 h后荧光显微镜和流式细胞仪检测各组ROS含量,结果显示,ZF NPs+Trehalose组内ROS的积累较ZF NPs组增加,ZF NPs+Trehalose+NAC组和ZF NPs+Trehalose+Wort组内ROS的积累则减少。而24 h后MTT结果显示,ZF NPs+Trehalose+NAC组和ZF NPs+Trehalose+Wort组细胞活力分别为(70.79±0.81)%和(72.63±2.29)%,相较于ZF NPs+Trehalose处理组(24.49±5.53)%,细胞活力均回升,且差异有统计学意义(F
=196.5,P
<0.01)。同时,Western blot结果显示,相较于ZF NPs组,ZF NPs+NAC组的LC3-Ⅱ蛋白的积累减少(F
=149.2,P
<0.01),而ZF NPs+Trehalose组的LC3-Ⅱ蛋白进一步增多,并且与ZF NPs+Trehalose组相比,Wort和NAC均可减少细胞内LC3-Ⅱ蛋白的积累(F
=67.56,P
<0.01)。见图6。3 讨论
肾透明细胞癌是最常见的肾脏恶性肿瘤,早期肾癌患者可接受手术治疗,而转移性肾癌患者的治疗手段则较少。尽管5年相对生存率现有所改善,但总体而言预后仍然很差。近年来,将纳米材料应用于癌症的诊疗越来越受到研究者的青睐。例如:氧化铁纳米颗粒可作为MRI造影剂,用于多种癌症的诊断。氧化锌纳米颗粒可作为一种多靶点的纳米载体,对肿瘤的治疗具有深远的影响。ZF NPs结合了上述两种纳米材料优异的理化特性,但ZF NPs在肿瘤中的研究并不多见。因此,本研究合成了尺寸均一的水分散ZF NPs,一方面ZF NPs具备顺磁性,并可通过“渗透与滞留增强效应”在肿瘤组织中累积,有望作为MRI造影对比剂辅助肾癌诊断;另一方面,ZF NPs可作为药物直接或增敏杀伤肾癌细胞,有望解决肾癌患者对化疗药物不敏感的难题。
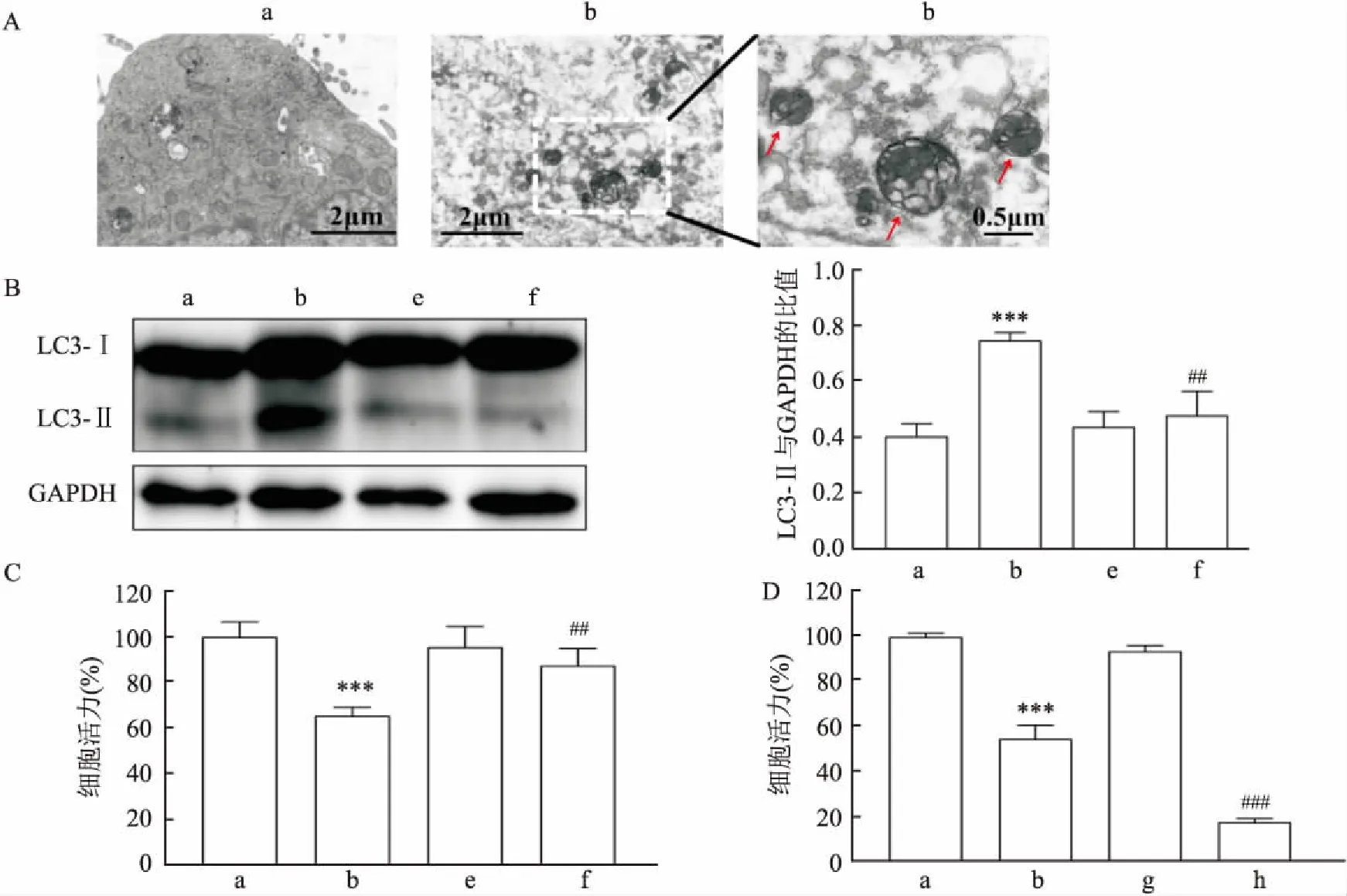
图5 ZF NPs诱导Caki-1细胞产生自噬效应以及ZF NPs与自噬抑制或增强剂对Caki-1细胞活力的影响
本研究重点评估了ZF NPs对Caki-1细胞的生长抑制作用,显示ZF NPs对Caki-1细胞的生长抑制作用具有剂量和时间依赖性。ROS是线粒体呼吸的副产物,现被认为是纳米颗粒引起细胞死亡的诱因之一。结果表明,ZF NPs诱导Caki-1细胞产生的ROS是引起Caki-1细胞死亡的重要原因,并且ROS清除剂可有效抑制该过程。
自噬是溶酶体介导的降解过程,用于清除受损的细胞器、异常聚集的蛋白质和侵入的病原体,几乎在每个哺乳动物细胞中都以低水平状态运转,在维持细胞的稳态和促进细胞的存活中起着至关重要的作用。细胞在受到物理、化学或生物等刺激后,可应激性地提升细胞内的自噬水平,而这种被诱导的自噬可分为促进细胞存活或加速细胞死亡两种情况。大量研究表明,纳米材料作为一类独特的自噬诱导剂,可将细胞自噬水平由本底低水平提升到较高水平。虽然部分纳米材料能够引起抑制细胞死亡的自噬,即促生存自噬,但在多数情况下,由纳米材料诱导的自噬会促进细胞死亡,即促死亡自噬。因此,不同的纳米材料在不同的细胞中诱导的自噬对细胞命运的影响不可一概而论。本研究利用TEM以及Western blot探究ZF NPs能否诱导Caki-1细胞产生自噬以及自噬的类型。结果表明,ZF NPs可诱导Caki-1细胞产生自噬效应,并且自噬强度的抑制或增强,可直接调控ZF NPs的肿瘤细胞杀伤效应。而细胞的自噬水平与细胞活力存在负相关性,因此,ZF NPs可诱导Caki-1细胞产生促死亡型细胞自噬。
综上所述,ZF NPs可诱导ROS及促死亡自噬杀伤Caki-1细胞。ROS在自噬激活中起着至关重要的作用,但具体调控机制仍不清楚。因此,为进一步探究两者在ZF NPs杀伤Caki-1细胞过程中的调控关系,课题组首先检测在自噬水平升高的情况下,Caki-1细胞内ROS的情况,随后继续探究Caki-1细胞内ROS清除与自噬水平改变的关联。结果表明,ZF NPs可通过诱导促死亡自噬进而促进ROS的积累以杀伤Caki-1细胞,而ROS的积累又可进一步提升促死亡自噬强度进而杀伤Caki-1细胞。由此可见,ZF NPs在杀伤Caki-1细胞的过程中诱导ROS及促死亡自噬的产生,并且两者在这一过程中可交互调控、相互促进,进而有效地杀伤肿瘤细胞。
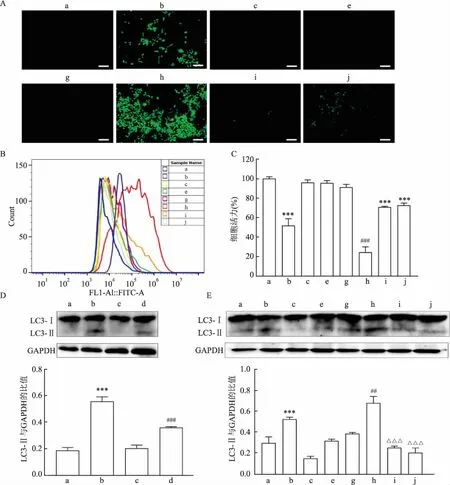
图6 ZF NPs诱导ROS及促死亡自噬交互调控杀伤Caki-1细胞

