高良姜素对于肺腺癌细胞增殖、迁移能力的影响
汪 新,束 军,代丽丽,沈继龙
肿瘤的十大特征已经成为一种共识,其中包括肿瘤细胞异常的能量代谢以及肿瘤的浸润和转移。肿瘤细胞即使在有氧环境中也无法进行有氧氧化,而只能依赖于糖酵解产生少量能量,这一现象称为瓦博格效应,即有氧糖酵解。肿瘤的转移通常发生在晚期阶段,上皮间质转化(epithelial-mesenchymal transition, EMT)是上皮细胞失去极性向间质转化的过程,对于肿瘤转移起着重要作用。高良姜素(galangin, Ga) 具有一定的抗癌作用,如Ga通过抑制糖酵解来抑制肝癌细胞的增殖等过程,或通过抑制EMT过程进而抑制肾癌细胞、胶质瘤细胞的进展。目前Ga对于肺癌治疗的研究罕见,其相关机制尚无明确定论。该文旨在初步探讨Ga对于肺腺癌A549、PC9细胞增殖、迁移能力的影响及其可能机制。
1 材料与方法
1.1 实验材料
人肺腺癌A549、PC9细胞由安徽医科大学基础医学院惠赠;Ga(DG0020)购于成都德思特生物技术有限公司,规格:20 mg/支;RPMI-1640培养基购于美国HyClone公司;胎牛血清购于杭州四季青生物技术有限公司;二甲基亚砜(DMSO)购于美国Sigma公司;CCK-8试剂盒(C0038)、青霉素-链霉素-两性霉素B溶液(100X)、胰酶、RIPA裂解液、BCA蛋白浓度测定试剂盒(增强型)(P0010S)购于上海碧云天生物技术有限公司;乳酸(lactic acid,LD)检测试剂盒(A019-2-1)、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(A020-1-2)、ATP检测试剂盒(A095-1-1)购于南京建成生物工程研究所;人E-钙黏蛋白(E-cadherin, E-cad)ELISA试剂盒(JYM0034Hu)、人N-钙黏蛋白(N-cadherin, N-cad)ELISA 试剂盒(JYM0185Hu)购于武汉基因美生物科技有限公司;酶标仪购于美国Biotek公司。1.2 实验方法
1
.2
.1
细胞培养 肺腺癌A549、PC9细胞分别置于37 ℃、含有5% CO的细胞培养箱中,用含有10%胎牛血清、1%抗生素的RPMI-1640培养基进行培养。肺腺癌细胞呈贴壁方式生长,视细胞生长状态进行换液、传代。取处于对数生长期的健康细胞进行实验。1
.2
.2
药物配制 用DMSO作为溶剂,将Ga溶于其中并配制成药物溶液,于-20 ℃冰箱保存备用。实验中各组DMSO溶剂浓度不超过0.1%。1
.2
.3
CCK-8法检测不同浓度Ga对于肺腺癌细胞增殖能力的影响 取处于对数生长期的健康肺腺癌A549、PC9细胞,调整好细胞浓度进行96孔板铺板,每孔加入100 μl细胞悬液。细胞贴壁后0药对照组加入100 μl培养基,实验组加入同体积不同浓度Ga(12.5、25、50、100 μmol/L)溶液,各组均设置5个重复孔。培养24、48 h后分别加入10 μl CCK-8试剂,调节酶标仪波长为450 nm进行吸光度(optical density,OD)检测。计算各组细胞活力,细胞活力=(实验组OD值-空白对照组OD值)/(0药对照组OD值-空白对照组OD值)×100%。DMSO组细胞活力计算方式与实验组类似,实验重复3次。1
.2
.4
细胞划痕实验检测不同浓度Ga对于肺腺癌细胞迁移能力的影响 在6孔板背面沿直尺划线,每孔3条线。取处于对数生长期的健康肺腺癌A549、PC9细胞,调整好细胞密度,将细胞均匀铺板。在细胞长满后,用枪头垂直于横线划痕,用PBS清洗并在显微镜下拍照即为0 h划痕宽度。实验组分别加入含有不同浓度Ga(12.5、25、50、100 μmol/L)的无血清培养基,对照组加入等量无血清培养基,培养24 h后用PBS清洗并在同一位置拍照,即为24 h划痕宽度。用ImageJ软件分析细胞迁移距离,细胞迁移率=(0 h划痕宽度-24 h划痕宽度)/ 0 h划痕宽度×100%。实验重复3次。1
.2
.5
LD试剂盒检测Ga对于肺腺癌细胞上清液中LD生成量的影响 取处于对数生长期的健康肺腺癌A549、PC9细胞,调整为合适细胞密度,进行6孔板铺板。等细胞生长至70%左右,去除原培养基并清洗,实验组加入2 ml不同浓度Ga(12.5、25、50、100 μmol/L)的培养基,对照组加入同体积培养基。24 h后吸取细胞培养液,离心、收集并用于后续上清液成分检测。按照LD测定试剂盒说明书要求分别对空白组、标准组、待测组(0药对照组及实验组)加样,调节酶标仪波长至530 nm检测OD值,即可计算LD生成量,细胞上清液LD生成量=(待测组OD值-空白组OD值)/(标准组OD值-空白组OD值)×标准品浓度(3 mmol/L)×样本测定前稀释倍数。实验重复3次。1
.2
.6
LDH试剂盒检测Ga对于肺腺癌细胞内LDH活性的影响 按照实验方法1.2.5进行细胞铺板,24 h后用PBS清洗,加入细胞裂解液,刮取细胞并置于4 ℃冰箱裂解30 min后离心,收取上清液用于后续细胞内成分检测。根据BCA蛋白检测试剂盒说明书加蛋白标准品及待测细胞内成分,调节酶标仪波长至562 nm检测OD值,检测待测组(0药对照组及实验组)细胞BCA蛋白表达水平以备后用。按照LDH测定试剂盒说明书要求对标准组、空白组、待测组(0药对照组及实验组)、对照组加样,调节酶标仪波长至440 nm检测OD值,即可计算LDH活性,LDH活性=(待测组OD值-对照组OD值)/(标准组OD值-空白组OD值) ×标准品浓度(2 mmol/L)×样本测定前稀释倍数/待测样本蛋白浓度。实验重复3次。1
.2
.7
ATP测定试剂盒检测不同浓度Ga对于肺腺癌细胞内ATP生成量的影响 参照实验方法1.2.6提取肺腺癌细胞内成分,计算待测组(0药对照组及实验组)细胞BCA蛋白表达水平以备后用。按照ATP含量测定试剂盒说明书要求对空白组、标准组、待测组、对照组加样,调节酶标仪波长至636 nm检测OD值,即可计算ATP生成量,ATP生成量=(待测组OD值-对照组OD值)/(标准组OD值-空白组OD值)×标准品浓度(10μmol/L)×样本测定前稀释倍数/待测样本蛋白浓度。实验重复3次。1
.2
.8
人E-
cad与N-
cad ELISA试剂盒检测细胞上清液中E-
cad与N-
cad蛋白量 参照实验方法1.2.5收集肺腺癌细胞上清液,按照ELISA试剂盒说明书要求对空白组、标准组、待测组(0药对照组及实验组)进行加样,调节酶标仪波长为450 nm测定各孔OD值,用空白孔调零。以标准品浓度为横轴、OD值为纵轴,绘制标准曲线计算出待测样品浓度,再乘以稀释倍数即为E-cad、N-cad蛋白表达量。实验重复3次。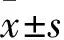
2 结果
2.1 Ga抑制肺腺癌A549、PC9细胞的增殖
与0药对照组相比,实验组用不同浓度的Ga分别处理A549、PC9细胞24、48 h后,细胞出现不同程度的增殖抑制现象,而DMSO溶剂对照组对细胞活力的组间差异无统计学意义。24 h(A549:F
=14.60;PC9:F
=21.06)检测结果显示,与0药对照组相比,实验组中低浓度Ga(12.5、25 μmol/L)对于A549、PC9细胞的细胞活力影响差异无统计学意义,而较高浓度组Ga(50、100 μmol/L)抑制两种细胞的细胞活力,组间差异有统计学意义(P
<0.05)。48 h(A549:F
=127.49;PC9:F
=85.75)结果表明,实验组Ga对于两种细胞的增殖抑制作用差异均有统计学意义(P
<0.05)。此外,在高浓度组Ga中,Ga处理细胞时间越长,细胞增殖抑制作用越强(P
<0.05)。综上,Ga对于肺腺癌A549、PC9细胞的增殖有抑制作用(图1)。2.2 Ga抑制肺腺癌A549、PC9细胞的迁移
与0药对照组相比,实验组用不同浓度Ga(12.5、25、50、100 μmol/L)作用于肺腺癌细胞24 h(A549:F
=141.87;PC9:F
=223.94),细胞出现不同程度的迁移抑制现象,细胞迁移率的组间差异有统计学意义P
<0.05(图2)。2.3 Ga抑制肺腺癌A549、PC9细胞LD生成、LDH活性及ATP生成
与0药对照组相比,实验组用不同浓度Ga(12.5、25、50、100 μmol/L)作用于肺腺癌A549、PC9细胞24 h,LD生成量均逐渐降低,组间差异均有统计学意义(A549:F
=320.12,P
<0.05;PC9:F
=327.61,P
<0.05);LDH活性逐渐越低,组间差异均有统计学意义(A549:F
=153.53,P
<0.05;PC9:F
=193.69,P
<0.05);ATP生成量出现不同程度降低,除低浓度组Ga(12.5 μmol/L)对于A549细胞组间差异无统计学意义外,其余组间差异均有统计学意义(A549:F
=87.13,P
<0.05;PC9:F
=58.04,P
<0.05)(表1、2)。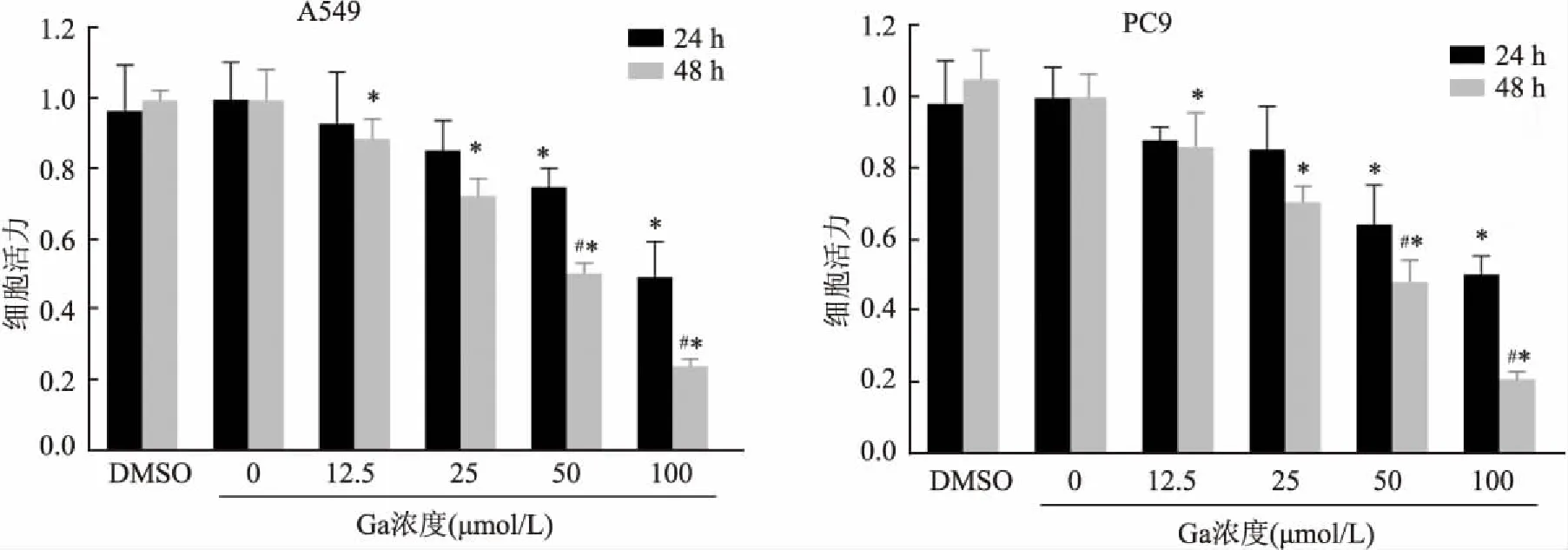
图1 Ga对于肺腺癌A549、PC9细胞增殖能力的影响
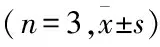
表1 不同浓度Ga对于肺腺癌A549细胞LD生成量、LDH活性、ATP生成量及E-cad、N-cad蛋白表达量的影响
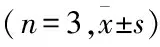
表2 不同浓度Ga对于肺腺癌PC9细胞LD生成量、LDH活性、ATP生成量及E-cad、N-cad蛋白表达量的影响
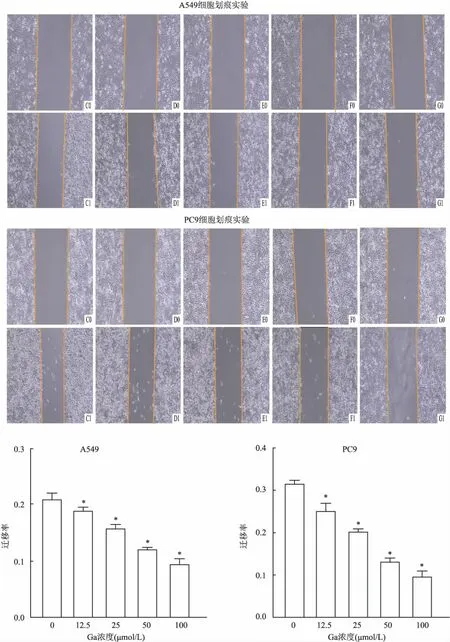
图2 Ga对于肺腺癌A549、PC9细胞迁移能力的影响 ×100
2.4 Ga促进肺腺癌A549、PC9细胞E-cad生成、抑制N-cad生成
与0药对照组相比,实验组用不同浓度Ga(12.5、25、50、100 μmol/L)作用于肺腺癌A549、PC9细胞24 h,上清液E-cad蛋白表达量逐渐增高,组间差异均有统计学意义(A549:F
=195.38,P
<0.05;PC9:F
=160.24,P
<0.05);而N-cad蛋白表达量逐渐降低,组间差异均有统计学意义(A549:F
=260.44,P
<0.05;PC9:F
=258.79,P
<0.05)(表1、2)。3 讨论
肺癌是全球发病率、死亡率居高位的癌症,目前尚无特效治疗。对于肺癌的治疗方式主要包括手术、放疗、化疗、靶向治疗等,但均存在一定的弊端。为了更好地治疗肺癌,提高肺癌患者的生存率,国内外研究者开始研究一些具有抗癌活性的纯天然化合物,Ga就是其中一种。Ga是从中药材高良姜的根茎中提取出的黄酮类化合物,具有广泛的生物活性如抗炎、抗氧化等。Ga还具有一定的抗癌作用,可以通过不同的途径抑制肿瘤细胞的进展如肝癌、肾癌、胶质瘤,但是Ga对于肺癌治疗的研究罕有报道。本研究用不同浓度的Ga处理肺腺癌A549、PC9细胞,初步探讨其对于肺腺癌细胞增殖、迁移能力的影响以及可能的作用机制。本研究表明,Ga抑制肺腺癌细胞的增殖和迁移能力,且呈现一定的浓度依赖性和时间依赖性。
肿瘤细胞的能量代谢失衡是肿瘤细胞区别于正常细胞的特征之一。肿瘤细胞的生长依赖于糖酵解并在LDH的作用下生成少量能量以满足代谢需要。多种生物组分参与其中,如LDH、LD、葡萄糖、ATP等。研究显示肿瘤细胞的糖酵解与细胞增殖密切相关。本研究中,Ga处理肺腺癌细胞后,细胞的LDH活性降低,LD和ATP的生成量降低,并且均与Ga浓度有关,这提示Ga有可能是通过抑制肿瘤细胞的糖酵解,降低细胞能量供应,进而抑制肿瘤细胞增殖。
肿瘤的转移是另一特征,指的是肿瘤从原发部位转移到其他部位并形成新的肿瘤的过程。EMT是上皮细胞向间质细胞转化,使其失去细胞间黏附作用,以提高细胞活动性的过程。EMT被认为是肿瘤转移中的主要因素。目前已知的EMT标志蛋白主要包括上皮标志蛋白E-cad以及间质标志蛋白N-cad、vimentin(VIM),并且EMT抑制过程常表现为E-cad表达量增高而N-cad、VIM表达量降低。本研究显示,当作用于肺腺癌细胞的Ga浓度逐渐增加时,E-cad蛋白表达量逐渐增高,而N-cad的表达量逐渐降低,这提示Ga有可能通过抑制EMT过程进而抑制肺腺癌细胞的迁移能力。
Yang et al研究表明胃癌细胞的增殖、迁移与糖酵解密切相关。Cao et al发现肺癌细胞外ATP能促进细胞迁移、侵袭,并且诱导基质金属蛋白酶(matrix metalloproteinase,MMPs)、EMT相关蛋白等表达。Hou et al发现抑制肺癌细胞LDH-A的表达能够抑制EMT过程,伴有E-cad表达增加而VIM、N-cad等表达降低。细胞的生命活动离不开能量,而肿瘤细胞的能量代谢则依赖于糖酵解。结合本研究,Ga对于肺腺癌细胞迁移能力的影响可能不仅与EMT有关,还与糖酵解有关,但相关机制仍需进一步探讨。

