小鼠肝癌细胞外泌体对树突状细胞成熟与功能的影响
许伟兵,范璐璐
肝细胞癌(hepatocellular carcinoma,HCC)是严重危害全人类健康的恶性肿瘤之一,目前手术治疗是肝细胞癌的主要治疗方法,但由于大部分患者常诊断于疾病的中晚期,只能进行介入治疗、放化疗、药物靶向治疗等综合治疗,其疗效不尽如人意。近来免疫治疗因其显著的疗效和创新型为肝细胞癌治疗带来了新的突破,其中以树突状细胞(dendritic cells, DCs)为基础的免疫治疗是目前HCC的研究热点。
近年来有学者研究证明肿瘤来源的外泌体(tumor-derived exosome,TDE)可以通过调节肿瘤的免疫微环境来发挥作用。但其在DC中的作用及功能目前尚不清楚。该研究首先通过小鼠肝癌细胞来源外泌体致敏DCs,观察其表面类分子的表达,并将致敏DCs与T淋巴细胞共同孵育,观察小鼠T淋巴细胞的增殖分裂情况,为基于DCs的HCC的免疫治疗提供理论支持。
1 材料与方法
1.1 材料
C57小鼠肝癌细胞Hepa1-6、树突状细胞DC2.4购自中科院上海细胞库。胎牛血清(FBS)购自美国Gibco公司;高糖DMEM和低糖DMEM购自美国Hyclone公司;ExoQuick-TC外泌体提取试剂盒购自美国的System Biosciences公司。兔来源Anti-CD63、Anti-TSG10、Anti-Cytochrome C单克隆抗体购自美国Abcam公司;抗体FITC anti-Mouse CD86、PerCP/Cy5.5 anti - Mouse CD80、PE anti-Mouse CD83、APC anti-Mouse CD40、Brilliant Violet 650 anti - Mouse MHC-Ⅱ购自美国 Biolegend 公司。实验过程中需要的去外泌体的血清通过超速离心机去除(34 000 r/min 14 h),0.22 mm的过滤器过滤。胰酶消化液、BCA蛋白浓度检测试剂盒和1%青霉素-1%链霉素(双抗)溶液购自中国上海碧云天科技有限公司。1.2 方法
1
.2
.1
细胞培养 将小鼠Hepa1-6细胞,用10%的FBS和浓度为1%双抗溶液,培养于含4.5 g/L D-葡萄糖的培养基中;将小鼠DC2.4细胞用10%的FBS和双抗溶液培养于含1g/L D-葡萄糖的培养基中,置于37 ℃、5% CO的培养箱中,换液时间为1~2 d,在对数生长期进行实验。1
.2
.2
外泌体提取方法 将Hepa1-6细胞于对数生长期时换不含外泌体的FBS培养,48 h后收集Hepa1-6细胞培养上清液,在4 ℃离心机中 5 982 r/min离心15 min去除凋亡细胞以及细胞碎片,在收集的上清液中加入外泌体提取液并充分混匀,置于4 ℃冰箱中12 h,第2天取出,在4 ℃离心机上2 991 r/min 30 min,弃掉上清液,再次 2 991 r/min、4 ℃离心5 min,弃掉上清液,用300 μl PBS重悬离心沉淀。BCA蛋白定量,样本分装于-80 ℃冰箱保存。1
.2
.3
外泌体的鉴定 通过透射电子显微镜观察外泌体形态,用1×PBS稀释外泌体样本,取外泌体悬浮液20 μl于封口膜上,将铜片放入20 μl样本液中,并在室温下放置5 min,晾干。PBS冲洗后,用滤纸吸去残余液体,反复冲洗3次后,再将铜片插入30 μl醋酸双氧铀中,并放置在封口膜上,室温下染色(3 min),滤纸吸干残余的染料,用PBS反复冲洗铜片3次,室温下干燥铜片30 min,电镜下观察外泌体形态。1
.2
.4
蛋白提取和Western blot检测外泌体的标记蛋白 提取蛋白:收集细胞于EP管中,加入RIPA蛋白裂解液(含PMSF溶液),4 ℃用旋转仪充分接触裂解30 min,低温4 ℃离心机,10 000 r/min、10 min离心,去沉淀,用BCA试剂盒测定样品中的蛋白含量。通过SDS-PAGE检测蛋白质样品,在恒定电流(350 mA)下通过湿转法1.5 h,转移到PVDF膜上,使用5%BSA封闭,分别加入一抗(1 ∶1 000): Anti-CD63、Anti-TSG101、Cytochrome C,4 ℃孵育过夜。室温孵育二抗(1 ∶4 000)2 h,使用化学发光成像仪进行成像显影。1
.2
.5
外泌体冲击DC2.4细胞 培养DC2.4细胞,分别加入PBS、外泌体(20 μg/ml)、LPS(1 μg/ml),于12孔板中继续培养48 h。经PBS、EXO、LPS体外冲击致敏的DC2.4细胞分别命名为iDC、DC-EXO、DC-LPS。1
.2
.6
DC2.4表面分子染色及流式细胞仪检测 收集不同处理组的DC2.4细胞于EP管中,1×PBS冲洗2次,然后在各管分别加入90 μl封闭液,在4 ℃环境中避光封闭15 min。然后于每管中加入荧光标记抗体FITC anti-Mouse CD86、PerCP/Cy5.5 anti-Mouse CD80、PE anti-Mouse CD83、APC anti-Mouse CD40、Brilliant Violet 650 anti - Mouse MHC-Ⅱ,在4 ℃环境中孵抗体30 min后用PBS反复冲洗3次,在每管加入DAPI后进行流式仪检测细胞。1
.2
.7
外泌体致敏DCs对T淋巴细胞增殖的影响 在超净台下取C57BL/6成年健康小鼠的脾脏,充分裂解以去除红细胞,反复洗涤后制成单个细胞的悬液;然后采用免疫磁珠分离法来获得小鼠的T淋巴细胞,将CFSE标记的T淋巴细胞和各处理组DCs按5 ∶1比例共孵育5 d。实验分2组:未用外泌体致敏的DCs与淋巴细胞共孵育组、外泌体致敏后的DCs与淋巴细胞共孵育组。用流式仪来测定不同组T淋巴细胞的分裂增殖情况。1.3 统计学处理
所得数据采用GraphPad prism 6.0软件进行统计分析,用t
检验方法比较每组数据的差异,以P
<0.05为差异有统计学意义。每项实验均重复3次。2 结果
2.1 透射电镜观察小鼠Hepa1-6细胞外泌体的形态
通过透射电镜可清晰地看到,从Hepa1-6细胞的上清液提取的外泌体为双层膜样结构,呈圆形或者类圆形,直径为30~100 nm,大小相对均一,均匀地分布在视野内(×40 000)。见图1。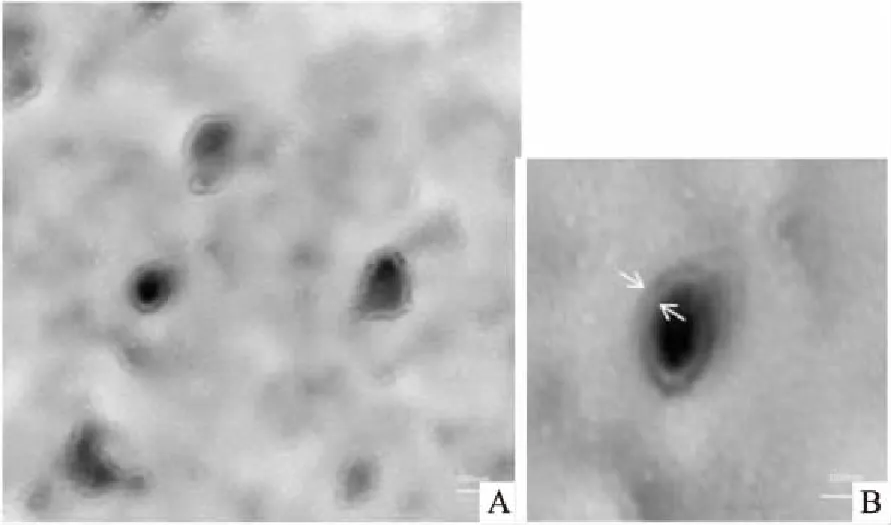
图1 透射电镜观察小鼠肝癌细胞外泌体的形态 ×40 000
2.2 Western blot检测外泌体标志性蛋白
Western blot结果显示,从Hepa 1-6细胞的上清液中提取的物质有外泌体标志性蛋白CD63、TSG101的表达,但无细胞色素C(Cytochrome C)的表达,表明提取的外泌体中不含有细胞成分,无细胞碎片的污染,为纯度较高的外泌体。见图2。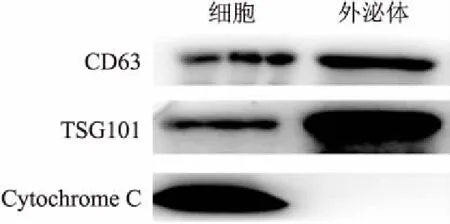
图2 Western-blot法检测外泌体标志性蛋白CD63、
2.3 小鼠肝癌细胞Hepa 1-6来源的外泌体对DC2.4表型的影响
将小鼠Hepa 1-6细胞来源的外泌体与鼠DC2.4细胞共培养48 h后见DC2.4细胞体积增大,半贴壁生长,可在DC2.4细胞边缘见树突状或者伪足样突起,表明朝向成熟方向分化。流式细胞术检测显示,与iDC组相比,外泌体能够上调DC2.4表面的MHC-Ⅱ、CD80、CD83、CD86 和 CD40 分子的表达(P
<0.
05),见图3。并且随着外泌体浓度的增加,DC2.4表面分子表达增高,见图4。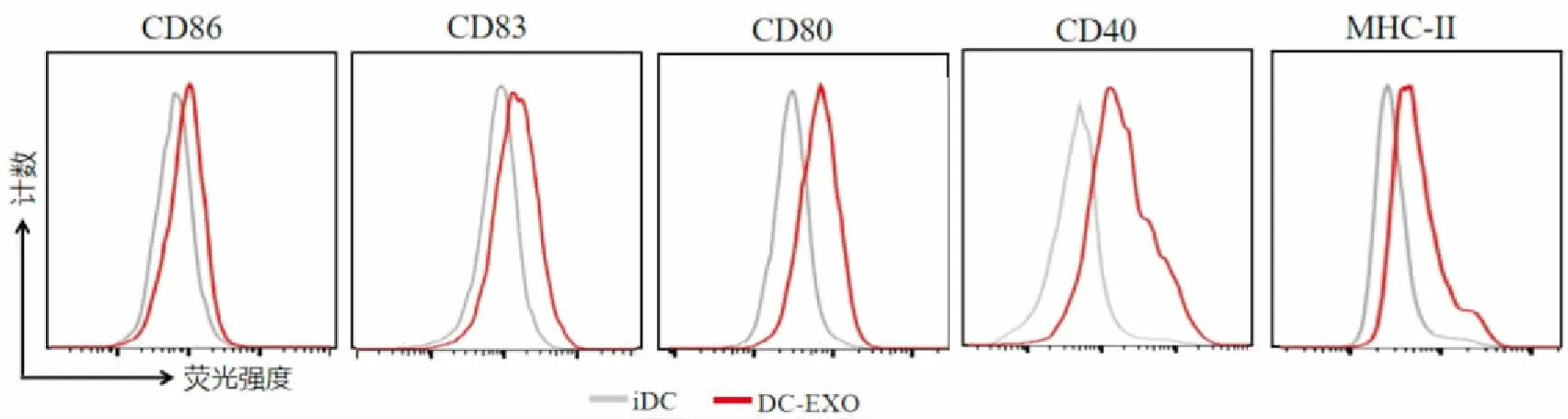
图3 小鼠肝癌细胞来源的外泌体对鼠树突状细胞表型的影响
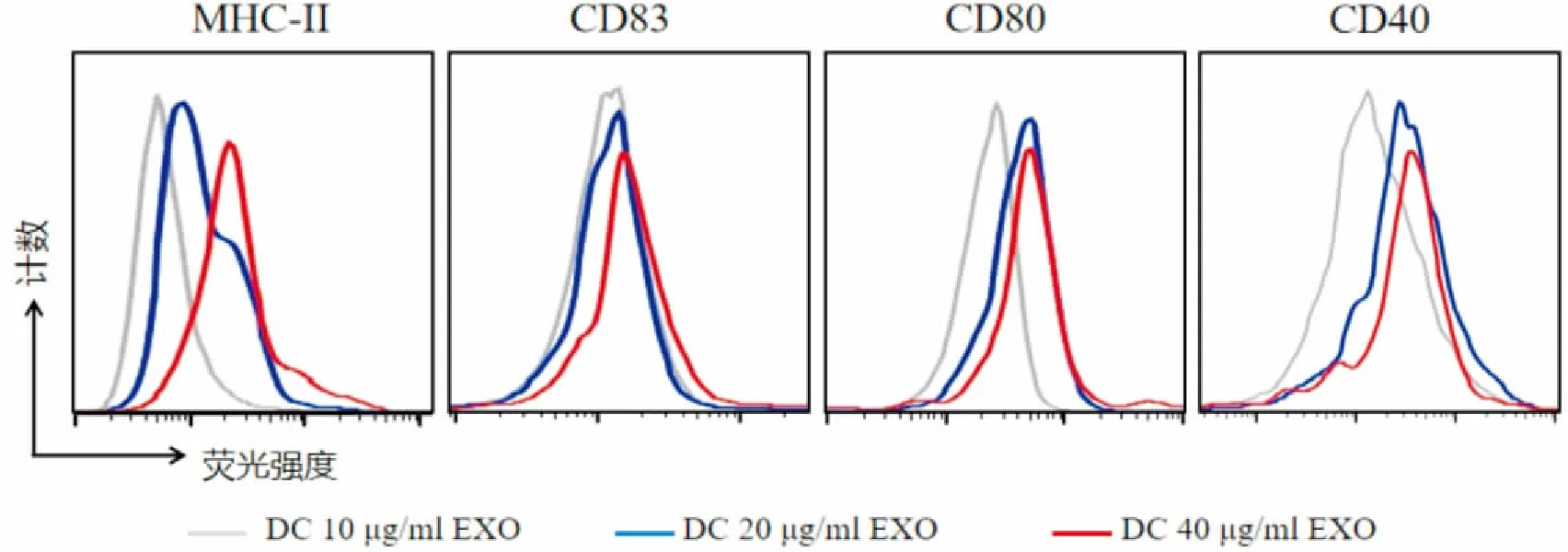
图4 不同浓度的小鼠肝癌细胞来源的外泌体对鼠树突状细胞表型的影响
2.4 小鼠肝癌细胞Hepa1-6来源的外泌体致敏DCs对T淋巴细胞增殖情况的影响
小鼠肝癌细胞Hepa1-6来源的外泌体致敏DCs(成熟DCs)共孵育组诱导刺激初始T淋巴细胞增殖情况高于未用外泌体致敏的DCs(t
=-3.260,P
<0.05)。FITC通道标记的CFSE染料,随着T淋巴细胞的增值,荧光强度逐渐的减少。见图5。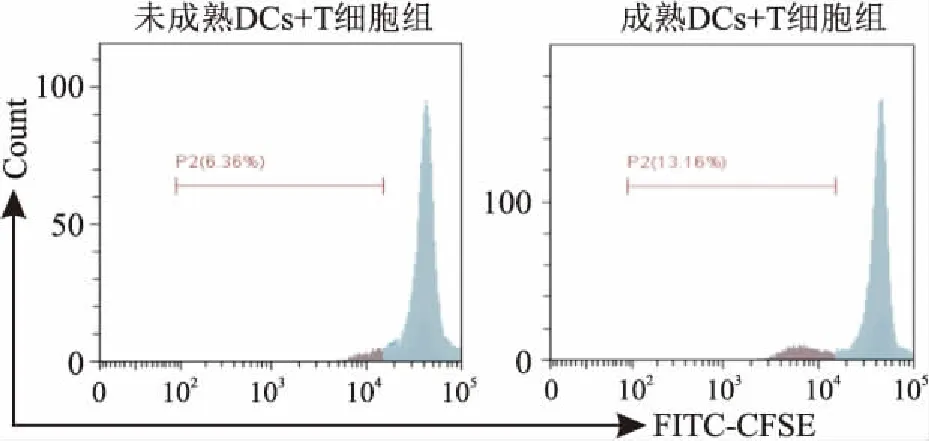
图5 小鼠肝癌细胞来源的外泌体致敏树突状细胞
3 讨论
基于DC的抗肿瘤免疫治疗现已成为HCC治疗的研究热点之一。DC是人体内最重要的抗原提呈细胞(antigen presenting cells,APC),DC首先对抗原进行识别、摄取和加工,然后将加工处理的抗原多肽片段与主要组织相容性复合体(MHC)以复合物的方式提交给T细胞表面并活化初始T淋巴细胞,进而激活T淋巴细胞的免疫应答反应,在人体抗肿瘤特异性免疫应答的启动中发挥着至关重要的作用。有研究表明,以DCs为基础的抗肿瘤免疫治疗具有一定的效果,但是HCC患者多数有慢性肝病病史,患者长期处于免疫功能抑制状态,肿瘤组织内浸润 DC的功能受抑,无法获得具有较强特异免疫原性的DC疫苗,严重限制了基于DC的疫苗的发展。因此,开发以DCs为基础的抗肿瘤免疫治疗的重点是寻找具有更强的免疫原性,但同时又含有较少免疫抑制性物质的肿瘤抗原。
外泌体是双层囊泡样结构的物质,其直径约为30~100 nm,并由多种活细胞分泌而来。有研究表明外泌体是一种细胞间信号传递的重要介质之一,在机体的生理和病理过程中都发挥着重要的作用,在不同恶性肿瘤中也发挥着不同的作用。研究表明TDE既能通过直接作用又可以通过间接作用来影响免疫细胞的成熟和功能,目前尚不清楚其在DC中的作用及功能。本研究结果显示小鼠肝癌细胞Hepa 1-6来源的外泌体致敏DCs能够上调其成熟分子的表达,并且随着外泌体浓度的增加,表面类分子表达增高,同时将致敏的DCs与T细胞共孵育,可促进T淋巴细胞的增殖。提示肝癌细胞Hepa1-6提取的外泌体可提供重要抗原性物质为调节DCs介导抗肿瘤免疫。但肿瘤的外泌体刺激DC成熟并发挥抗肿瘤的机制有待进一步探讨。
综上所述,小鼠Hepa1-6细胞提取的外泌体可促进DC2.4细胞成熟,并刺激T细胞的分裂增殖,为基于DC的HCC免疫治疗提供潜在的肿瘤抗原谱,并为基于DCs的抗肿瘤免疫治疗提供一定理论依据。

