肺炎支原体P116基因FP2片段的免疫优势和细胞黏附活性
林 康,文 志,周 畅,李文丽,吴焕武,刘丹艳,朱玉林,王林定
肺炎支原体是一种原核细胞型微生物,是已知能够自我复制的最小的人类病原体,大约7%~20%的获得性肺炎病例是由该病原体引起的。肺炎支原体对宿主呼吸道黏膜上皮细胞的黏附和定植是成功感染的关键因素之一。这一过程由肺炎支原体的附着细胞器(adherent organelle,AO)所介导。AO是一种极化和锥形的细胞延伸,被认为与肺炎支原体滑动和细胞分裂有关。肺炎支原体黏附过程需要多种蛋白质的参与,包括P1、P2、P3、P116和P30以及高分子量(high molecular weight,HMW)蛋白。与其他表面黏附蛋白不同,P116不与P1、P30或HMW蛋白形成复合物,而是独立参与细胞黏附。P116蛋白由3 093 bp的开放阅读框编码,编码1 030个氨基酸,分子量为116 ku。该研究旨在对P116蛋白的敏感性、特异性和黏附介导区,作结构-功能研究,为提供临床诊断和治疗策略提供线索。
1 材料与方法
1.1 材料
A549细胞购于美国ATCC。肺炎支原体SP4快速培养基购于珠海迪尔生物技术有限公司、质粒提取试剂盒购于北京TIANGEN公司;QuickCut限制性内切酶EcoR l与BamH 1及其配套缓冲液购于北京Takara公司;Ni-NTA购于生工生物工程(上海)股份有限公司1.2 方法
1
.2
.1
肺炎支原体标准株的复苏培养 将肺炎支原体标准株(FH,ATCC 15531)接种于支原体培养液中,需氧培养,每日观察。当培养基颜色由红色变为橙色时,细菌处于指数生长期。收集细菌,用PBS洗涤,离心、静置,在PPLO琼脂平板上涂板,37 ℃、5% CO培养,每3 d进行10倍显微镜观察,可疑菌落用双烯染色,镜下观察和PCR鉴定。1
.2
.2
重组质粒PQE-P116-FP2的构建 参照文献设计P116-FP2基因引物,上游引物5-CCAAGTGGATCCCTGATCTCTTTGGCGAC-3;下游引物5-GCAAATTG-AATTCCCCGTTGTTCAGGATCAG-3。内切酶为BamH 1酶与EcoR l酶,由上海生工生物工程有限公司合成。合成后粉剂按说明书稀释分装,贮存于-20 ℃。复苏培养MP-FH标准菌株,经检测阳性后,用细菌基因组DNA提取试剂盒提取 DNA,测定浓度加入100 ng模板基因95 ℃、5 min,95 ℃、30 s,62 ℃、30 s, 72 ℃、1 min,72 ℃、10 min反应体系50 μl: PCR mix 25 μl,上下游引物各2 μl,模板15 μl,ddHO 6 μl。通过PCR的方法扩增肺炎支原体P116-FP2基因片段,克隆到表达载体PQE80-L中,转化大肠杆菌BL21(DE3)。1
.2
.3
重组蛋白诱导表达 大肠杆菌BL21(DE3)用1 mmol/L的异丙基硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)在37 ℃诱导6 h后,收集细菌,离心,再悬浮在裂解缓冲液(50 mmol/L NaHPO, 500 mmol/L NaCl,10 mmol/L咪唑,pH 8.0)中。收集悬浮菌,加入PMSF蛋白酶抑制剂和溶菌酶,冰浴20 min。超声破碎5 s,间隔5 s,功率300 W,总工作时间18 min。然后将裂解物以4 ℃,8 000 r/min的速度离心20 min。用50 ml变性裂解缓冲液(10 mmol/L Tris,100 mmol/L NaHPO,10 mmol/L咪唑,8 mol/L尿素,pH 8.0)溶解沉淀。收集上清液,经Ni-NTA琼脂树脂过滤。用12% SDS-PAGE电泳分析蛋白质。SDS-PAGE和Western blot分别用5%和12%的分离和浓缩胶进行。样品在SDS蛋白上样缓冲液中煮沸10 min,然后用12%的SDS-PAGE电泳分离,每份样品10 μl。凝胶用考马斯亮蓝染色1 h,脱色液脱色12 h。Western blot实验用上述同样的方法,待电泳完毕后,将蛋白分离后转移到聚偏二氟乙烯膜 (PVDF膜)上,用含5%脱脂牛奶的PBST室温封闭膜2 h,用PBST洗涤,与抗P116血清抗体孵育(1 ∶200)2 h。TBST洗涤3次。用Goat Anti-Rabbit IgG (Elabscience,1 ∶5 000)孵育1 h后,TBST洗涤4次,加化学发光剂,免疫检测采用ECL检测系统。1
.2
.4
P116-FP2多克隆抗体的制备 免疫前选取3只3.5 kg成年雄性新西兰大白兔(安徽医科大学动物实验中心),编号A、B、C,心脏取血2 ml,此为阴性对照。然后,将制备好的纯化蛋白200 μg与完全弗氏佐剂(美国Thermo公司)充分混合,并沿背部多个部位皮下注射。第二周,将100 μg蛋白抗原与不完全弗氏佐剂(美国Sigma-Aldrich)完全混合,免疫方案同上。每周加强免疫1次,共接种4次。末次免疫前抽取耳缘静脉血,Western blot验证是否产生抗体。第四次免疫后7 d,采集心脏血60~80 ml,分离血清,无菌分装,-80 ℃保存。1
.2
.5
P116-FP2多克隆抗体效价的测定 用ELISA法检测抗P116-FP2多克隆抗体的效价。用1 μg/L P116-FP2蛋白包被ELISA板, 每孔加100 μl,4 ℃孵育过夜。第二天用含1%山羊血清的封闭液,250 μl 每孔,37 ℃封闭1 h后洗涤,以免疫前采集的兔血清为对照,将抗血清1 ∶300、1 ∶600、1 ∶1 200 、1 ∶2 400、1 ∶4 800、1 ∶9 600 倍比稀释,每孔100 μl加到包被好的ELISA板中,37 ℃孵育1 h。PBST洗涤5次,加入1 ∶3 000稀释的HRP标记羊抗兔IgG 100 μl,37 ℃孵育1 h,洗涤5次。每孔加入50 μl四甲基联苯胺(TMB)显色底物,37 ℃避光30 min,加终止液终止反应。用酶标仪检测450 nm波长下的吸光度。1
.2
.6
P116-FP2多克隆抗体抑制肺炎支原体与A549细胞黏附的能力检测 为了检测特异性多克隆抗体抑制肺炎支原体与A549细胞黏附的能力,以4个抗体浓度(1 ∶50、1 ∶100、1 ∶200和1 ∶500)与肺炎支原体孵育,然后感染A549细胞。人肺癌细胞株A549(美国马纳萨斯,弗吉尼亚州,ATCC)在含有25 mmol/L HEPES缓冲液(0.01mol/L N-2-羟乙基哌嗪-N9-2-乙磺酸,0.15 mol/L NaCl,pH 7.2),碳酸氢钠,10%胎牛血清,200 μg/ml庆大霉素,2 mg/ml庆大霉素的高糖DMEM中培养。经胰蛋白酶消化后,将A549细胞(5×10)转移到12孔培养皿(康宁)中的无菌玻璃盖片上,并在37 ℃、5% CO加湿的环境中孵育过夜。用肺炎支原体DMEM悬液(100 μl /孔)感染A549细胞,37 ℃、5% CO中孵育6 h。感染的A549细胞在4%多聚甲醛中室温固定1 min,用PBS清洗。为检测黏附性支原体,加入兔一抗 (1 ∶500),37 ℃孵育30 min,再次加入FITC标记的驴抗兔IgG(上海桑贡生物科技公司,1 ∶100)与细胞孵育。细胞随后与4,6-二氨基-2-苯基吲哚(Sangon Biotech;1 ∶10)在37 ℃孵育30 min,最后用双蒸水洗涤细胞并进行分析。用100 μl的肺炎支原体悬液与不同稀释度(1 ∶50、1 ∶100、1 ∶200、1 ∶500)的兔一抗100 μl在37 ℃预孵育30 min。然后将肺炎支原体/抗体悬液(200 μl)加入含1.5 ml二甲基甲酰胺的A549细胞中,在37 ℃、5% CO中孵育过夜,然后如上所述测定黏附性。肺炎支原体表面暴露试验检测支原体表面蛋白,固定前加入一抗,所有其他程序与上述相同。将制备好的细胞标本用直立荧光显微镜进行观察,成像前将一滴防褪色溶液(对苯二胺二盐酸盐,1 μg/ml,10% PBS和90%甘油,pH 9.0)放在盖片和载玻片之间。1.3 统计学处理
采用SPSS 17.0统计软件进行分析,两两比较采用t
检验,以α=0.05为检验标准。P
<0.
05为差异有统计学意义。2 结果
2.1 MP-FP2重组载体的构建及鉴定
将目的基因经电泳分析正确后,连接到表达载体 PQE-80-L 上,转化构建好的重组载体至 BL21(DE3)中,平板四区划线后,挑取单克隆菌落,摇菌提取质粒。经 BamH I 与 EcoR I 双酶切鉴定后,重组质粒载体 MP-FP2 切出目的基因片段,大小与前期设计目的片段一致。表明目的基因成功连接到表达载体上。见图1。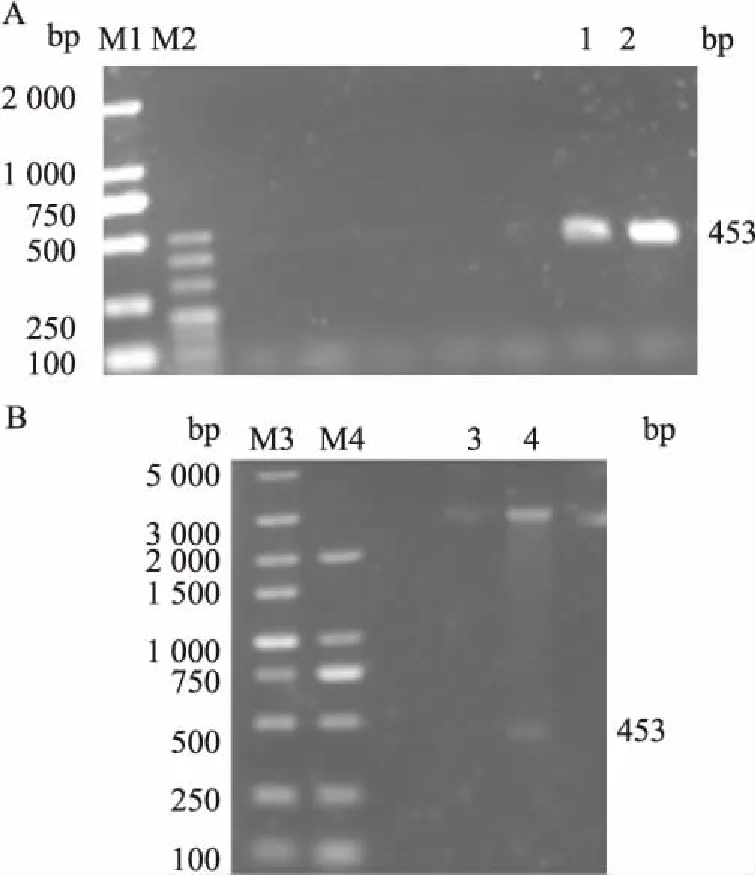
图1 MP-FP2目的基因PCR扩增及重组载体的双酶切鉴定
2.2 重组蛋白SDS-PAGE分析
肺炎支原体的克隆、表达和纯化通过PCR扩增出P116-FP2基因的453 bp片段,将其克隆到PQE80-L表达载体中,并在大肠杆菌BL21中表达。对重组蛋白进行SDS-PAGE分析。诱导了约14 ku的重组蛋白,以上清液形式表达。对P116-FP2蛋白经Ni-NTA柱层析纯化,结果如图2所示。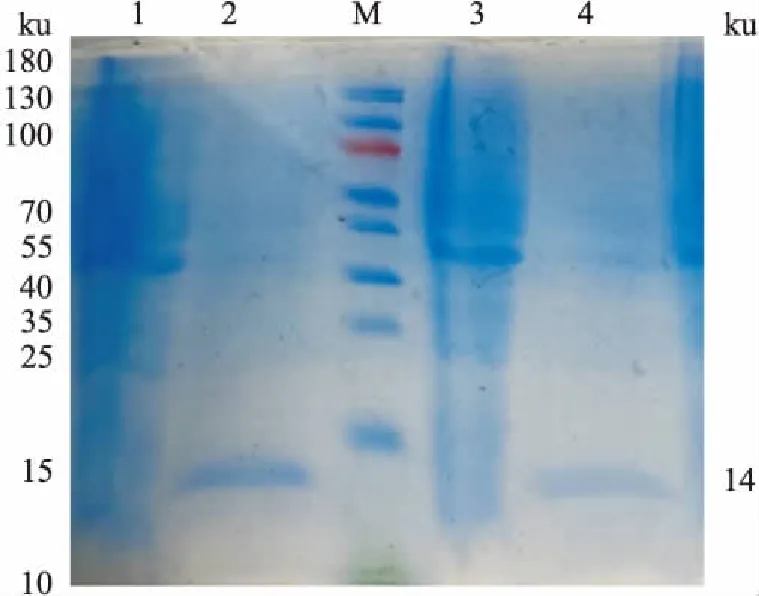
图2 P116-FP2目的蛋白的表达及纯化SDS分析图
2.3 P116-FP2蛋白Western blot检测及其多克隆抗体效价测定
使用肺炎支原体阳性患者血清(1 ∶200)和阴性血清作为一抗,对纯化后的抗原进行免疫印迹反应。通过对比阴性与阳性的结果,显示表达的 P116-FP2蛋白具有免疫反应性。见图3。对4次免疫加强后的兔心脏取血清,间接ELISA法检测不同兔产生的抗P116-FP2血清的效价。结果判定:吸光度值大于1.0为阳性结果,通过比较1 ∶300 ~1 ∶19 200 7组稀释血清的吸光度值可以得出3份血清效价均大于1 ∶4 800,且7组间两两比较,经t
检验均P
<0.05,差异有统计学意义。见表1。
图3 Western blot 检测P116-FP2蛋白的特异性MP-:阴性患者血清;MP+:为阳性患者血清
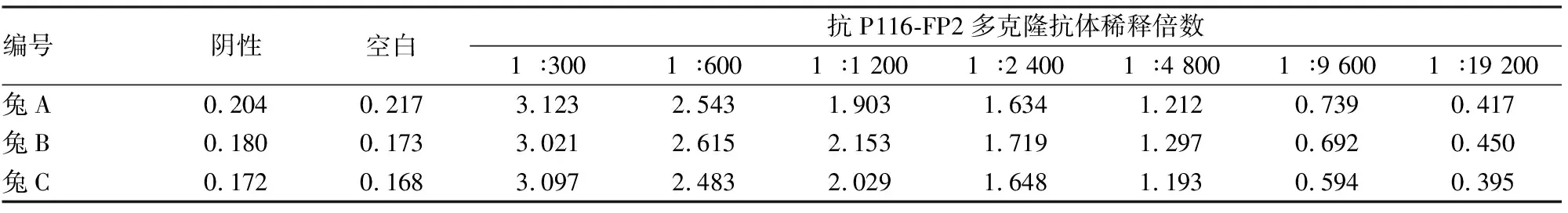
表1 抗P116-FP2多克隆抗体稀释度的检测(n=3)
2.4 荧光显微镜观察结果
在荧光显微镜下,可以观察到孵育肺炎支原体抗体与A549细胞有FITC的绿色荧光,随着抗体浓度的增加,激发的绿色荧光越少,表明对肺炎支原体黏附的抑制作用越强。细胞经过细胞核染色后,显示细胞核激发的蓝色荧光位点与FITC激发的绿色荧光位点相同。见图4。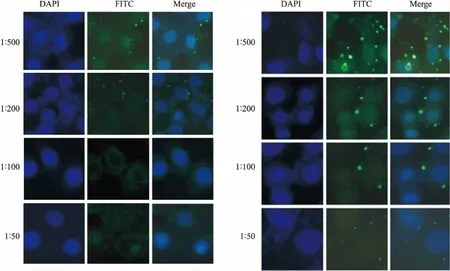
图4 多克隆抗体抑制肺炎支原体感染A549细胞免疫荧光图 ×1 000FITC:含FITC标记的荧光二抗;DAPI:细胞核染色;Merge:叠加效果
3 讨论
肺炎支原体是支原体属的一个种。MP 感染的诊断主要有3种方法:培养、血清学和分子生物学法。培养法特异性强,传统上,肺炎支原体培养是肺炎支原体感染病原学诊断的标准,但由于肺炎支原体生长缓慢,阳性分离率低,限制了其临床应用。虽然PCR检测敏感,但实验技术和结果分析要求严格。因此,血清学是诊断肺炎支原体感染最常用的方法。近年来,除了制备完整的肺炎支原体和膜蛋白抗原外,还开发了合成肽抗原和重组抗原。由于现有的血清学试验是基于肺炎支原体的粗细胞成分,血清学试验往往受到非特异性反应的阻碍。用纯化的肺炎支原体表面蛋白进行ELISA具有独特的优点。发展肺炎支原体血清学检测方法的主要困难之一是难以在异源表达系统中表达其蛋白,因为肺炎支原体使用非通用密码子。例如,UGA在肺炎支原体中被翻译为色氨酸,在大肠杆菌中被翻译为终止密码子。因此,UGA密码子的存在可能导致克隆基因的不完全表达。P116蛋白的基因和氨基酸序列在肺炎支原体FH和M129之间高度保守,与生殖支原体基因和氨基酸序列的同源性分别为61%和52%。与其他支原体、细菌、病毒和脊椎动物相比,未发现同源基因。虽然一些报告已经在其他国家调查了类似的方法,尚未在用P116蛋白诊断肺炎支原体的报告。本研究使用了与Tabassum et al类似的方法,表达了P116蛋白,制备了抗肺炎支原体的抗体。肺炎支原体感染患者的Western blot结果表明蛋白具有免疫反应性。由于P116被认为是主要的黏附调节配体,随后又对其黏附抑制进行了实验。为了鉴定细胞黏附区,重组了P116蛋白。该重组蛋白与肺炎支原体多克隆抗体反应。IFA结果表明,重组P116蛋白多克隆抗体能抑制肺炎支原体与A549细胞的黏附,证明P116蛋白在细胞黏附和免疫活性方面是一个不依赖于P1的重要因子。本研究对肺炎支原体P116-FP2段的免疫反应和细胞黏附区进行了系统的研究,结果表明,P116-FP2多克隆抗体具备免疫肺炎支原体的能力,针对该区域的抗体阻断了肺炎支原体与细胞的黏附。

