WZB117下调YAP影响胃癌细胞干性和糖酵解的机制
张晨嵩,潘成武,王庆康,李 靖,汪 虎,马家驰
胃癌是全世界第四大最常见的癌症,是每年死亡人数第二多的癌症。Hippo途径在组织稳态和早期胚胎细胞规格方面起着至关重要的作用,与细胞能量代谢密切相关。Yes相关蛋白(Yes-associated protein,YAP)是该途径的核心组成部分。抑制YAP的表达可抑制胃癌细胞的增殖、迁移、侵袭和转移。WZB117[2-氟-6-(间羟基苯甲酰氧基)苯基-羟基-羟基苯甲酸酯]是一种合成的小分子糖酵解抑制剂,可通过限制糖酵解来抑制小鼠体内的肿瘤增长。WZB117可以下调GLUT1蛋白、细胞内三磷酸腺苷(adenosine triphosphate, ATP)和糖酵解酶的水平,并上调AMP依赖的蛋白激酶[Adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK]的磷酸化,导致癌细胞的细胞周期停滞、衰老和凋亡。该研究探讨WZB117通过下调YAP的表达进而影响病人来源的胃癌细胞能量代谢的机制。
1 材料与方法
1.1 材料
新鲜的胃癌组织用PBS洗涤以除去血液后,将组织切成1~3 mm大小的碎片,漂浮在含15%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的杜氏磷酸缓冲盐溶液改良的Eagle培养基中。将胃癌组织碎片在37 ℃、5% CO的潮湿空气中培养。当细胞汇合至约80%,用胰蛋白酶消化,然后以1 ∶3的分离比重新铺入较大的培养瓶中。第4代的胃癌细胞用于后续实验。临床样品的使用经医院伦理委员会批准,并获得患者的书面知情同意。1.2 细胞分组及培养
将胃癌细胞接种植至6孔板中,在37 ℃、5%CO培养箱中培养,观察细胞在培养24、48 h的生长情况并计数。将胃癌细胞随机分为3组:正常组、低糖对照组和WZB117处理组。正常组细胞培养于DMEM高糖(4.5 g/L)中,添加含100 ml/L胎牛血清、100 IU/ml青霉素、100 μg/ml链霉素的完全培养基;低糖对照组细胞培养于DMEM低糖(1.0 g/L)完全培养基;WZB117处理组细胞培养于 DMEM 高糖(4.5 g/L)完全培养基,添加10 mmol/L抑制剂WZB117。细胞常规培养2~3 d传代1次。1.3 MTT检测细胞增殖活性
在96孔板中将正常组、低糖对照组和WZB117处理组细胞于37 ℃、5%CO培养箱中培养48 h后,在每孔迅速加入10 μl浓度为5 mg/ml的MTT溶液,继续37 ℃、5%CO培养箱中孵育4 h。取出培养板,用移液枪把孔中的上清液吸除,再加入100 μl的二甲基亚砜溶液,摇床反应10 min。观察结晶物溶解后,酶标仪检测OD570。1.4 RNA提取和qRT-PCR
根据制造商的说明,细胞培养48 h后使用TRIzol试剂从细胞中分离总RNA,溶于20 μl DEPC水中,检测其浓度和纯度。StepOne Real-Time系统用于定量mRNA检测,内参基因为β-actin。逆转录反应程序为:42 ℃、60 min,70 ℃、50 min。qRT-PCR反应程序为:94 ℃、45 s,60 ℃、60 s,72 ℃、80 s,合计40个循环。通过式2测量每个基因的表达。本研究中使用的引物由Invitrogen(中国上海)生产,其序列如表1所示。
表1 引物序列
1.5 Western blot检测蛋白表达
正常组、低糖对照组和WZB117处理组细胞培养48 h后,移液器吸除培养液,PBS洗涤细胞2次。均质化后在添加了蛋白酶抑制剂的RIPA缓冲液中裂解,收集细胞裂解液,在4 ℃条件下12 000 r/min离心10 min,吸取培养液上清液,BAC法对蛋白定量。在12% SDS-PAGE凝胶上分离蛋白质。电泳后,将蛋白质转移到PVDF膜上,在5%(W/V)的脱脂牛奶中封闭,并与一抗在4 ℃下孵育过夜。将膜用Tris缓冲盐水/吐温洗涤3次,并在37 ℃下用二抗孵育1 h。一抗和二抗的稀释倍数均为1 ∶1 000。1.6 平板克隆实验检测细胞克隆形成能力
在6孔板(2×10个细胞/孔)中将正常组、低糖对照组和WZB117处理组细胞于37 ℃、5% CO湿润的培养箱中培养8 d。用2 ml完全培养基处理细胞。每3 d更换1次培养基。孵育结束时,将培养物用4%多聚甲醛固定并用结晶紫染色。1.7 细胞中ATP含量及培养液中乳酸含量测定
使用ATP含量试剂盒检测正常组、低糖对照组和WZB117处理组细胞中ATP的含量,3组细胞培养48 h后,吸取培养液上清液,使用乳酸含量检测试剂盒检测乳酸水平。ATP含量和乳酸含量分别以低糖对照组及正常组为对照,分析ATP相对含量和乳酸相对含量。1.8 细胞迁移和侵袭测定
正常组、低糖对照组和WZB117处理组细胞(5×10个细胞/孔)铺在顶室,将无血清L-DMEM和含有10%FBS的培养基放入Transwell(孔径8.0 μm)中,并放入底部腔室。在37 ℃、5%CO湿润的培养箱中孵育12 h后,用棉签除去残留在膜上表面的细胞。将滤膜在4%多聚甲醛中固定30 min,用结晶紫染色15 min后照相。在显微镜下观察细胞,每组至少分析5个视野。为了进行细胞侵袭测定,在Transwell室中用200 μl在无血清培养基中以1 ∶5稀释的Matrigel包被,并将孵育时间延长至24 h。其余步骤与细胞迁移测定相同。在显微镜下计数迁移和侵袭的细胞数。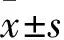
2 结果
2.1 WZB117对病人来源胃癌细胞中YAP蛋白质表达的影响
正常组和低糖对照组细胞中YAP 表达水平的比较,差异无统计学意义。WZB117处理组细胞中YAP 的表达水平均低于正常组及低糖对照组,差异有统计学意义(P
<0.05),见表2。2.2 WZB117对病人来源胃癌细胞增殖活性、克隆形成率、侵袭能力、迁移能力的影响
利用MTT检测WZB117对胃癌细胞增殖活性的影响,平板克隆实验检测细胞克隆形成能力。结果显示WZB117处理组胃癌细胞增殖活性和克隆形成能力均低于正常组及低糖对照组,差异有统计学意义(P
<0.05),正常组与低糖对照组比较,差异无统计学意义,见表3。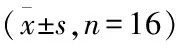
表2 各组细胞中YAP蛋白质表达
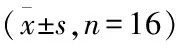
表3 各组细胞增殖活性和细胞克隆率
通过定量RT-PCR检测MMP-2和MMP-9的表达,结果显示WZB117降低了胃癌细胞中MMP-2和MMP-9的表达(图1)。同样在Transwell迁移分析中,WZB117处理组向室下表面迁移的细胞数量比正常组及低糖对照组要少(图2A),在侵袭试验中观察到了类似的变化(图2B)。这表明WZB117抑制剂可降低胃癌细胞的迁移和侵袭能力。
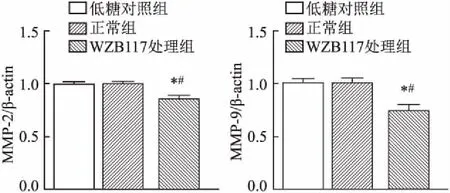
图1 胃癌细胞中MMP-2和MMP-9的表达
与正常组比较:P
<0.05;与低糖对照组比较:P
<0.052.3 WZB117对患者来源胃癌细胞干性的影响
为了探讨糖酵解抑制剂WZB117对胃癌细胞干性的影响,检测包括Sox-2、Oct-4和Nanog在内的干性相关基因的表达。Sox-2、Oct-4和Nanog的表达降低,表明WZB117可能调节GC-MSC的干细胞特性,结果见图3、表4。2.4 WZB117对患者来源胃癌细胞ATP和培养液中乳酸含量的影响
使用不同浓度WZB117处理胃癌细胞,分别在4、8 h时使用ATP含量试剂盒检测胃癌细胞中ATP含量,分别在24、48 h使用乳酸含量试剂盒检测培养液中乳酸含量。ATP和乳酸含量均随WZB117浓度增高和药物作用时间延长而降低,差异有统计学意义(P
<0.05),表明WZB117降低ATP和乳酸含量水平呈现时间和浓度依赖性,结果见表5。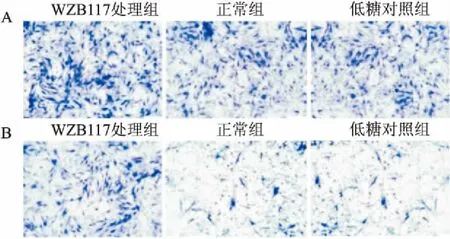
图2 WZB117可降低胃癌细胞的迁移和侵袭能力 SP×400
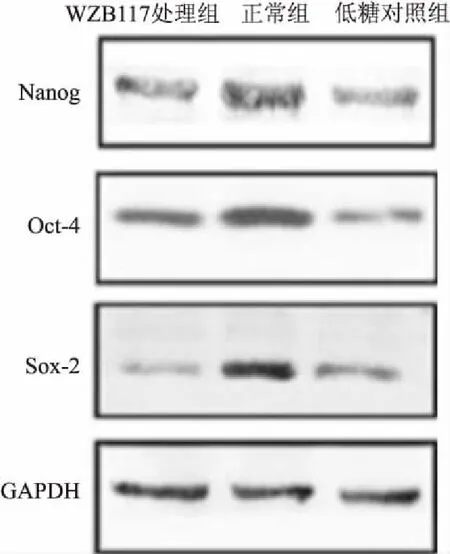
图3 WZB117可以调节胃癌细胞的干性
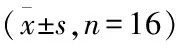
表4 胃癌细胞干性相关基因的蛋白表达水平
2.5 WZB117对患者来源胃癌细胞HK2、PKM2和Caspase-3表达的影响
使用不同浓度WZB117处理胃癌细胞,分别使用qRT-PCR和Western blot检测胃癌细胞中HK2、PKM2和Caspase-3的mRNA和蛋白质表达。WZB117处理组HK2和PKM2表达均较正常组和低糖对照组降低,差异有统计学意义(P
<0.05);Caspase-3表达较正常组和低糖对照组升高,差异有统计学意义(P
<0.05);正常组和低糖对照组间比较,差异无统计学意义,见表6、7和图4。
表5 WZB117对胃癌细胞ATP和培养液中乳酸含量的影响
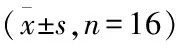
表6 各组细胞中HK2、PKM2和Caspase-3的mRNA表达
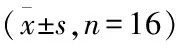
表7 胃癌细胞中Caspase-3、HK2和PKM2的蛋白表达
2.6 WZB117对患者来源胃癌细胞中Bcl-2、Bax和Cyt-C表达的影响
使用不同浓度WZB117处理胃癌细胞,在24 h使用qRT-PCR检测胃癌细胞中Bcl-2、Bax和Cyt-C表达。Bcl-2表达随WZB117浓度增高而降低,差异有统计学意义(P
<0.05);Bax和Cyt-C表达随WZB117浓度增高升高,差异有统计学意义(P
<0.05),见表8。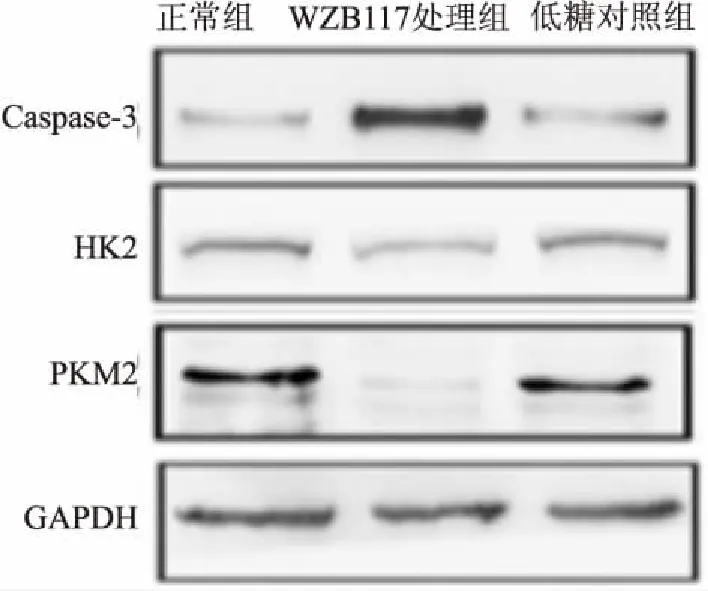
图4 WZB117可以调节胃癌细胞中Caspase-3、HK2和PKM2的表达
3 讨论
Hippo/YAP途径在人类癌症中起重要作用。YAP在胃癌组织中的表达与患者总生存率较低密切相关,其致癌作用最近已成为研究热点。据报道,YAP可通过与TEAD转录因子相互作用来促进胆管癌的生长。且YAP可以在体外和体内增强胃癌细胞的增殖、迁移和侵袭能力。通过减少MMP-2和MMP-9的表达,降低YAP的信号传导,从而抑制肿瘤的生长和转移。在本研究中,WZB117可以抑制YAP的表达,进而降低了胃癌细胞的干性(包括增殖活性、克隆形成率、侵袭能力、迁移能力),促进细胞凋亡;WZB117也降低了细胞干性相关基因Nanog、BMil、c-Myc的表达。
肿瘤细胞较正常细胞相比需要更多的能量以维持其侵袭、增值和细胞干性。大多数癌细胞利用厌氧代谢(糖酵解)来产生细胞生长和增值所需的ATP,这与正常分化的细胞不同,后者通常使用线粒体氧化磷酸化来维持细胞功能。从有氧代谢到无氧代谢的过渡被称为“Warburg效应”。肿瘤细胞在供氧充足条件下,“Warburg效应”强于普通细胞。肿瘤细胞的糖酵解水平与肿瘤细胞的分化程度和肿瘤恶性程度呈正相关效应,高度分化的肿瘤细胞能量代谢水平是正常细胞的40倍左右,糖酵解途径是维持高水平能量代谢的重要途径。因此,阻断肿瘤细胞糖酵解代谢途径中的任何一个环节,就能够降低肿瘤细胞的增殖能力,促进细胞凋亡。YAP可以调控肿瘤细胞生长,而肿瘤细胞的生长需ATP 的参与,因此,YAP可能参与肿瘤细胞能量代谢过程。本研究结果显示,WZB117可通过下调 YAP 表达,使胃癌细胞中HK2、PKM2 表达、乳酸和ATP水平皆下降,表明YAP下调可抑制胃癌细胞糖酵解。
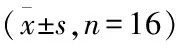
表8 WZB117对胃癌细胞中Bcl-2、Bax和Cyt-C表达的影响
综上所述,WZB117可以下调YAP的表达,从而影响胃癌细胞的迁移、侵袭能力和增殖活性,促使胃癌细胞凋亡。这说明YAP在胃癌细胞中的表达在促进胃癌细胞的进展中起着重要作用,这可能为胃癌的进一步研究和治疗提供新的思路。

