血管紧张素Ⅱ 2型受体基因敲除小鼠的构建、繁育和基因型鉴定
蒋 吉,胡姗姗,魏 伟
Agtr2作为G蛋白偶联受体(G-protein coupled receptors, GPCRs),一般在胚胎时期表达较多,出生后表达水平大幅降低,但在病理状态,如炎症、损伤等情况下,其表达水平较正常生理状态显著增高。有文献报道,直接激动Agtr2导致了血管内皮的舒张,抑制炎症反应以及促进神经元的修复再生。课题组既往研究显示,Agtr2在佐剂性关节炎(adjuvant induces arthritis,AIA)大鼠滑膜组织中的表达升高可在氯沙坦治疗后进一步上调,且上调水平与炎症指数的减轻呈正相关,提示Agtr2可能具有缓解类风湿关节炎(rheumatoid arthritis,RA)炎症免疫反应的作用。在此基础上,该研究构建了Agtr2基因工程小鼠,并对Agtr2小鼠进行扩繁、基因型鉴定和蛋白检测,将为进一步研究Agtr2在疾病发病机制中的作用以及作为药物的作用靶点提供重要实验基础。
1 材料与方法
1.1 实验动物
55只7周龄C57BL/6J鼠,30只雄鼠、25只雌鼠,体质量为(20±2) g,购自江苏集萃药康生物科技有限公司,生产许可证号:SCXK (苏) 2015-0001。所有实验均经安徽医科大学临床药理研究所动物实验伦理委员会批准,并于SPF级实验室饲养繁育小鼠。1.2 主要试剂
核酸染料购自北京康润生物科技有限公司;琼脂糖凝胶购自法国Biowest公司;Genotyping Mix购自南京诺唯赞生物科技股份有限公司;Proteinase K购自美国Sigma Aldrich公司;异丙醇购自国药集团化学试剂有限公司;RIPA蛋白裂解液、苯甲基磺酰氯、5×电泳加样缓冲液购自江苏碧云天生物技术公司;抗GAHDH抗体购自美国Affinity Biosciences公司;抗Agtr2抗体购自英国Abcam公司;辣根酶标记的山羊抗兔IgG购自北京中杉金桥生物公司;ECL化学发光试剂盒购自上海天能科技有限公司。1.3 主要仪器
通用型电泳仪DYY-7C型购自北京六一生物科技有限公司;荧光定量PCR仪购自上海伯乐生命医学产品有限公司;Tanon-1600全自动数码凝胶图像分析系统购自上海天能科技有限公司;LAS4000Mini型化学发光成像分析仪购自美国GE公司。1.4 方法
1
.4
.1
Cas9/先导RNA(single guide RNA, sgRNA)载体构建 小鼠Agtr2由363个氨基酸组成,分子量为41.2 ku,Agtr2基因包括3个外显子和2个内含子,基因ID为11609,基因定位在Xq22-23。利用美国麻省理工学院CRISPR Design软件(http://crispr.mit.edu),按照sgRNA设计原则,选择外显子3作为设计靶位点,经过设计筛选后得到两对sgRNA,分别为:Agtr2-S1(GTGCATATTAGGATAGAGTC)、Agtr2-S2 (GCATTTCTCTATGAAGCAGC)、Agtr2-S3(TGTATTATGACACTACGTAA)、Agtr2-S4(CTCATGCTATATCATATGGT)。将设计的sgRNA寡核苷酸单链利用PCR仪退火形成双链。将双链sgRNA与线性化载体PGK1.1 linear vector在T4 DNA连接酶作用下16℃过夜连接,连接产物转染到DH5α感受态细胞,通过PCR和基因测序挑选阳性克隆产物,完成sgRNA载体构建。1
.4
.2
Agtr2小鼠的获得 将体外转录的sgRNA与Cas9混合后,显微注射到C57BL/6J鼠受精卵中,Cas9蛋白在sgRNA引导下结合到靶位点进而造成DNA双链断裂,从而实现靶位点碱基序列缺失,最终实现基因敲除(图1)。将受精卵移植进C57BL/6J 雌性小鼠体内,繁育得到F0代小鼠。1
.4
.3
Agtr2小鼠的饲养和繁育 Agtr2小鼠于SPF级动物实验室内饲养和繁殖。严格控制温度(18 ~ 22℃)、湿度(0.4 ~ 0.7)等饲养条件,昼夜明暗交替时间12/12 h,所有小鼠饲养所需物品如笼盒、饲料等均经过高温高压消毒灭菌,每日定时定量喂食灭菌核桃仁保证小鼠营养供给。饲养期间,每天补充饲料、更换饮用水、观察记录小鼠体质量等生长状况,每3 d更换1次小鼠垫料。各种操作均在超净工作台内按无菌操作进行。繁殖出F0代敲基因鼠后,与同窝野生型C57BL/6J小鼠进行合笼,以得到更多F1代小鼠进行检测。孕鼠妊娠期21 d左右,子鼠19 ~ 21 d可与母鼠分笼,将雌、雄小鼠分笼饲养,雄鼠8周、雌鼠6周左右性成熟,可用于配繁。1
.4
.4
基因型鉴定1
.4
.4
.1
鼠尾DNA提取 待F0代子鼠2周龄时,剪取小鼠尾尖部(长不超过0.3 cm),放入1.5 ml EP管中,加入490 μl鼠尾裂解液(100 ml裂解液中含5 ml质量分数为0.1的SDS、2 ml 5 mol/L NaCl、1 ml 1mol/L Tris·Hcl、10 ml 0.5 mol/L EDTA、82 ml HO)和10 μl Proteinase K(10 mg/ml),混匀后将含有鼠尾的EP管放入60℃金属浴中消化过夜。第二天,将EP管放入100℃金属浴中煮沸10 min终止裂解。样本于高速离心机10 000 r/min离心10 min后,取上清液转移至新EP管中,加入2倍上清液体积的无水乙醇,上下颠倒混匀,可以看到白色丝状的DNA析出,以 12 000 r/min 离心10 min,弃上清液,加800 μl体积分数为0.75的乙醇后,以12 000 r/min离心5 min,弃上清液,小心吸弃残留乙醇,晾干(大约30 min),加入100 μl TE溶液溶解DNA,进行PCR检测。1
.4
.4
.2
PCR扩增反应 实验所用引物均由上海生工生物工程有限公司合成。引物序列见表1。
表1 Agtr2-/-小鼠基因鉴定PCR反应引物序列
1
.4
.4
.3
琼脂糖凝胶电泳 1×TAE buffer 30 ml,加入琼脂糖0.3 g及1 μl的核酸染料,取上述PCR扩增产物10 μl,电压120 V,电泳30 min,于Tanon-1600全自动数码凝胶图像分析系统中拍照观察。1
.4
.5
小鼠主要器官Agtr2蛋白水平检测 待F1代小鼠8周时,禁食过夜,同时取同窝野生型及Agtr2纯合子小鼠心脏、肝脏、脾脏、胸腺以及肾脏组织匀浆提取组织蛋白,进行标准蛋白定量。加入5×loading buffer煮10 min后,采用质量分数为0.1的SDS-PAGE电泳,后转移至PVDF膜,质量分数为0.05的脱脂奶粉室温封闭2 h,TPBS洗3次,PBS洗1次,每次10 min,后加入Agtr2一抗(1 ∶2 000),4 ℃孵育过夜,次日用TPBS洗3次,每次10 min,加入对应山羊抗兔IgG(1 ∶10 000),室温孵育2 h后继续用TPBS洗3次,PBS洗1次,每次10 min。使用LAS4000Mini型化学发光成像分析仪,利用ECL发光液进行蛋白质信号检测。Image J软件分析目的条带灰度值。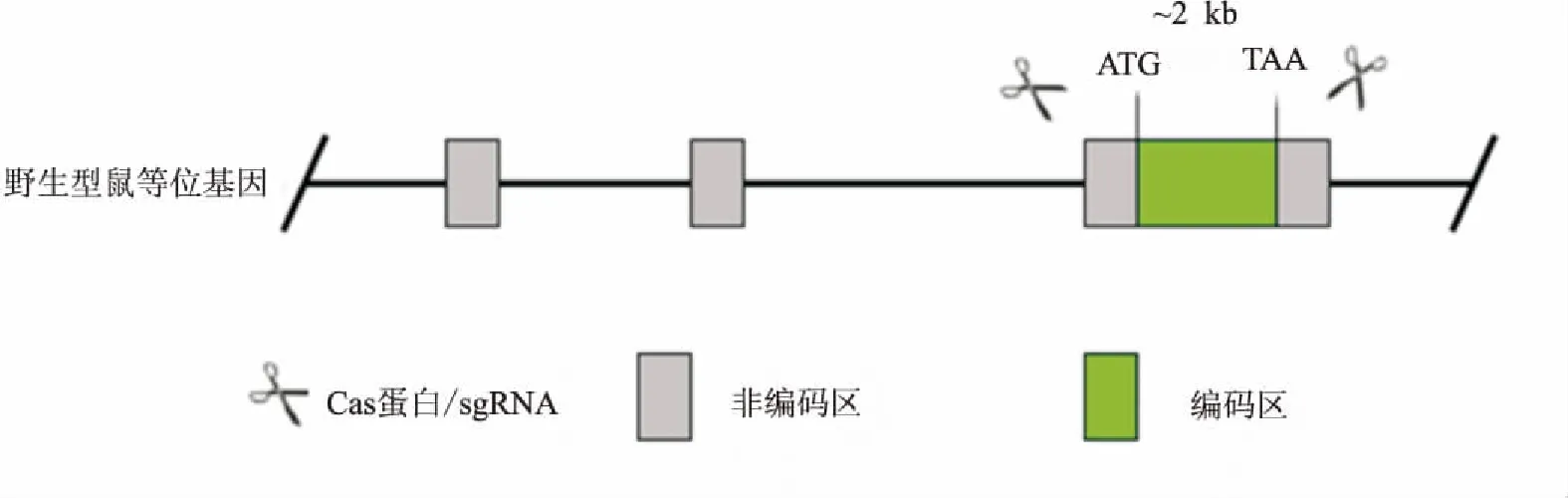
图1 利用CRISPR/Cas9系统敲除Agtr2基因策略
2 结果
2.1 获得Agtr2
F0代小鼠
将sgRNA与Cas9的混合物显微注射入C57BL/6J小鼠受精卵中,获得18只F0代小鼠,编号为1~18,提取尾部DNA分别与WT引物和KO引物进行PCR扩增反应,后通过琼脂糖凝胶电泳分析目的条带。野生型:PCR反应未获得1 123 bp条带,可以获得403 bp条带;杂合子:PCR反应可以获得1 123 bp条带,也可以获得403 bp条带;纯合子:PCR反应可以获得1 123 bp条带,未获得403 bp条带。鉴定结果见图2。由图可知,纯合子:2~8、11~18;杂合子:1、9、10;未获得野生型小鼠。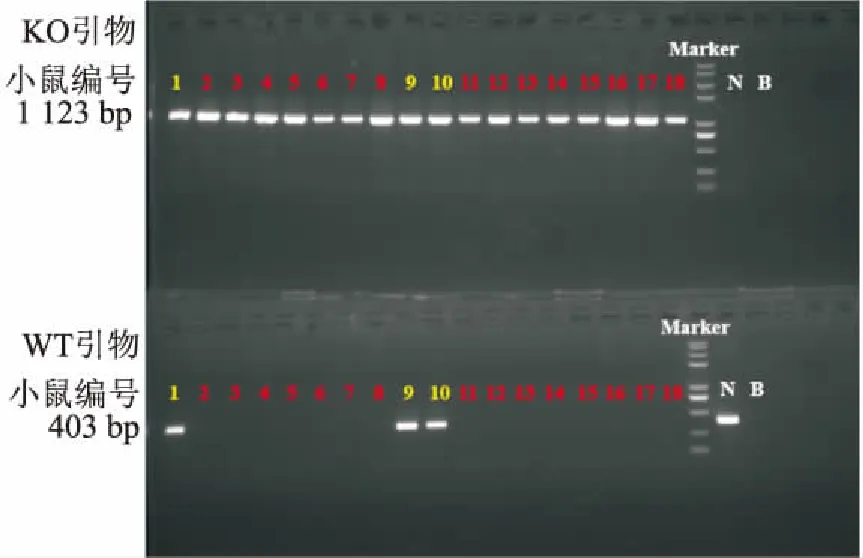
图2 F0代Agtr2-/- 小鼠PCR结果
2.2 获得Agtr2
F1代小鼠
为构建稳定遗传的Agtr2小鼠,将F0代雄鼠与不同母本的雌鼠按1∶2进行合笼,共得到55只F1代小鼠,编号为19~73。每只子鼠的DNA分别与WT引物和KO引物进行PCR扩增反应,后通过琼脂糖凝胶电泳分析目的条带,结果见图3。由图可知,纯合子:27、30、32、33、53、70 ~ 73;杂合子:19、21 ~ 23、34 ~ 38、44、45、47、56 ~ 58、60 ~ 69;野生型:20、24 ~ 26、28、29、31、39 ~ 43、46、48 ~ 52、54、55、59。至此成功获得遗传稳定的Agtr2小鼠。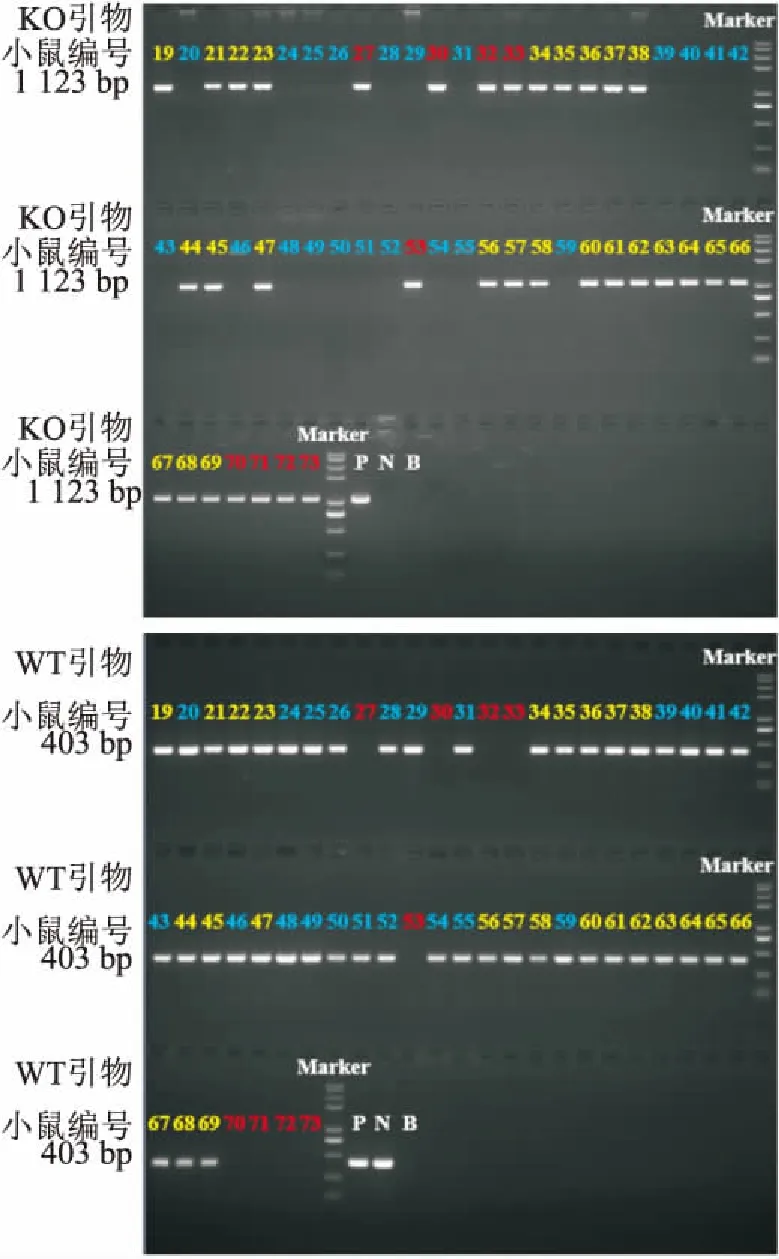
图3 F1代Agtr2-/- 小鼠PCR结果
2.3 Agtr2
小鼠的繁殖情况
将sgRNA与Cas9的混合物显微注射入C57BL/6小鼠受精卵中,母鼠成功繁殖出F0代Agtr2幼鼠,将F0代小鼠与同窝野生型C57BL/6J小鼠进行交配,成功繁殖出更多的F1代Agtr2小鼠。孕鼠妊娠期集中在19 ~ 21 d左右,每胎可产5 ~ 8只幼鼠,成活率超过九成。Agtr2小鼠各项体征较野生型小鼠无明显差异。2.4 Agtr2
小鼠主要脏器内Agtr2蛋白表达情况
Western blot检测PCR鉴定后Agtr2基因敲除纯合子小鼠以及野生型小鼠Agtr2蛋白表达情况,共检测了心脏、肝脏、肾脏、脾脏和胸腺5种脏器,结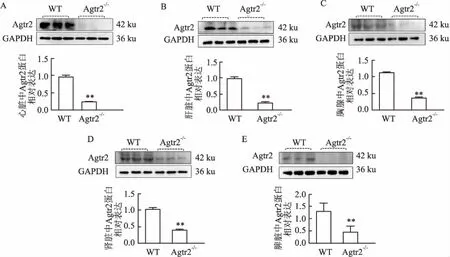
图4 F2代Agtr2基因敲除纯合子小鼠与野生型小鼠Agtr2蛋白表达
3 讨论
近年来,对Agtr2的研究已经不仅仅局限于心血管系统,其在自身免疫性疾病中的作用也愈发得到重视。ERK1/2-NF-κB信号转导失衡是RA发病过程中单核/巨噬细胞异常活化的关键,产生大量促炎细胞因子。使用C21活化Agtr2及其下游信号可直接抑制ERK1/2-NF-κB信号的过度活化,调节单核/巨噬细胞的稳定,促进巨噬细胞抗炎细胞因子IL-10的分泌,抑制促炎细胞因子如TNF-α和IL-6的产生,缓解炎症。注射Agtr2特异性激动剂CGP42112可通过减少关节滑膜巨噬细胞、T淋巴细胞等炎性细胞浸润,抑制滑膜细胞过度增殖,有效减轻AIA大鼠的疾病表现。C21通过抑制肾脏氧化应激、炎症和纤维化,抑制实验性糖尿病肾病的进展,而使用Agtr2阻断剂PD123319则会损害C57BL/6J小鼠的胰岛素信号转导。在炎性肠病中,Agtr2的激活刺激黏膜中一氧化氮的形成,参与调节胃肠道上皮屏障的形成,对炎性肠病的有明显的治疗作用。
动物模型是医学实验的基础,为了更好地探究Agtr2的功能,本研究构建了Agtr2基因敲除小鼠,并采用操作简便,重复性、适用性更好的PCR-琼脂糖凝胶电泳的方法,对所得Agtr2基因敲除小鼠进行基因型鉴定,可靠验证了模型的遗传稳定性。Agtr2在不同组织内的表达水平不同,转录和翻译水平也可能存在一定差异,但Western blot结果显示,Agtr2 基因敲除纯合子小鼠主要脏器内几乎不表达Agtr2蛋白,进一步验证了模型的可靠性。虽然纯合子Agtr2小鼠的Western blot结果条带中也存在微弱的Agtr2蛋白表达,这可能与Agtr2抗体特异性相对较低有关。Agtr2基因敲除小鼠的建立将为进一步研究Agtr2在疾病发病机制中的作用以及作为药物的作用靶点提供重要实验基础。

