hUC-MSCs对缺氧缺血脑损伤新生大鼠脑组织的保护作用研究
陈茂琼,向 敏,宋海良,王 岚,匡梦岚,张丽娟,熊 英,何志旭,许键炜,高 鸿,秦 臻
围生期多种因素引起的缺氧、脑血流减少而致的新生儿缺氧缺血性脑病(hypoxic ischemic encephalopathy,HIE)是新生儿死亡和婴儿神经系统功能障碍的主要原因,研究表明,HIE通过氧化应激、炎症、凋亡和兴奋性毒性导致延迟的细胞死亡。目前,亚低温等常规治疗对于缺氧缺血性脑病有一定的疗效,但无法逆转神经细胞损伤。近年来,对间充质干细胞(marrow mesenchymal stem cell,MSCs),特别是来源更加原始,分化能力更强的人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)研究的深入,为HIE的治疗带来了新的希望。研究显示,MSCs因其具有自我更新和多项分化潜能以及分泌、旁分泌等能力,同时还参与信号通路的调节,对受损组织发挥保护作用。该实验旨在通过移植hUC-MSCs治疗缺血缺氧诱导的新生大鼠HIE,并探讨hUC-MSCs对神经细胞的保护作用及机制。
1 材料与方法
1.1 材料与仪器
新生7日龄健康SD大鼠18只,雌雄不限,体质量(15±2)g[贵州医科大学实验动物中心,动物合格号SYXK(黔)2018-0001];新生儿脐带(贵州医科大学附属医院产科)。相差显微镜(德国Leica公司);CO培养箱(美国Thermo Forma公司);台式高速冷冻离心机(Allegra 64R,美国贝克曼库尔特公司);CM1950型冰冻切片机(德国徕卡公司);超净工作台(苏州苏净集团);U-LH100L-3活细胞工作站(日本OLYMPUS公司)。L-DMEM培养基、10%FBS及0.25%胰酶 (美国Hyclone公司); 2,3,5-氯化三苯基四氮唑(TTC)染色液(北京索莱宝科技有限公司);TRIzol、转染试剂(美国Ambion公司);Q-PCR引物(生工生物工程上海股份有限公司合成)。1.2 方法
1
.2
.1
hUC-
MSCs的分离、培养及鉴定 采集新生儿长脐带约10 cm(产妇年龄在20~35岁之间,身体健康,无各种急、慢性疾病。胎儿足月,出生体质量>2 500 g,健康、无畸形),提取脐带内保留华尔通胶,剪碎成约1×1×1(mm)大小颗粒,接种于75 cm培养瓶,10%FBS+L-DMEM液适量,置于37℃、5%CO培养箱中培养。3 d后半量换液,以后每3 d全量换液,倒置相差显微镜观察。待细胞融合至50%后去除组织块,继续培养;细胞融合至80%左右传代。传代纯化至第4代,用流式细胞仪进行细胞膜表面分子CD44、CD73、CD90的水平检测分析,并设立阴性对照。1
.2
.2
动物分组及缺氧缺血脑损伤模型的制备、hUC-
MSCs的标记及移植治疗 将大鼠随机均分为对照(假手术)组、模型组、治疗组。模型组和治疗组大鼠用丝线对其左侧颈总动脉进行双重结扎,使其缺血后置于原母鼠笼中2 h,再置于37℃常压含8%O和92%N混合气体的低氧舱内,以2 L/min的速度输入,持续1 h,建立缺氧缺血脑损伤模型。对照组新生大鼠仅分离左侧颈总动脉,不予结扎阻断血流和低氧处理。选取第三代生长融合至80%左右的hUC-MSCs,通过感染携带绿色荧光蛋白(green fluorescent protein,GFP)的乱序腺病毒(由课题组前期包装重组腺病毒获得),PBS洗2次,按浓度为1×10pfu/L的病毒液,每个培养皿中加入100 μl,37 ℃孵育1.5~2 h后PBS液洗净,加入含10%FBS+L-DMEM液继续培养48 h,活细胞工作站观察GFP的表达。如GFP表达率达70%左右,消化、离心、PBS液洗涤后,制备成细胞密度为1×10个/L的细胞悬液,用微量注射器l ml注射器吸取细胞悬液置于冰上待移植用。
于缺氧缺血脑损伤后1 d采用侧脑室穿刺方法进行细胞移植。移植部位为左侧(损伤侧)侧脑室,注射位点:冠状缝后1.5 mm,颅骨矢状缝左1.5 mm,颅骨下-3 mm。使用微量注射器均匀缓慢注射hUC-MSCs 细胞悬液5 μl,停针5 min,然后缓慢退出,缝合消毒。待新生鼠苏醒后继续置于原母鼠笼中喂养。
1
.2
.3
检测hUC-
MSCs在HIE大鼠大脑内的定植及TTC染色观察梗死脑组织 各组大鼠hUC-MSCs移植治疗48 h后,乙醚深度麻醉处死后经心腔内灌注PBS。取部分大脑组织,冰冻切片成8 μm厚度,荧光显微镜下观察切片中绿色荧光阳性细胞在大鼠大脑内定植分布情况,追踪移植细胞的定位、数量。另取部分大脑组织切成2 mm厚的切片,浸泡在37℃、2%TTC溶液中5 min,然后用10%甲醛溶液固定。用Image J软件追踪和分析梗死体积。其余大脑组织置于液氮备用。1
.2
.4
RT-qPCR法测定海马组织中Beclin-2、Caspase-3 mRNA 水平的变化 根据RT-qPCR试剂盒说明书,液氮中取出大脑组织,称取50 mg,PBS清洗后加1 ml Buffer Rlysis A,室温裂解5 min,转移至玻璃研磨器中,充分研磨。加0.2 ml氯仿,12 000 r/min离心15 min。取500 μl上清液加入1/3体积无水乙醇混匀,12 000 r/min离心10 min。弃上清液再加入预冷的无RNase 75%乙醇,12 000 r/min离心10 min。再次弃上清液,干燥后加入无RNase水50 μl,-80℃冻存备用。根据生工M-MuLV合成试剂盒说明书操作,建立20 μl PCR反应体系(各基因RT-qPCR引物序列见表1)。
表1 各基因RT-qPCR引物一览表
1
.2
.5
Western blot检测海马组织中Beclin-2、Caspase-3蛋白的表达 按照生工生物工程上海股份有限公司提供的全蛋白提取试剂盒说明书,将海马固体组织置于培养皿中,剪碎成3 mm×3 mm左右的小块, PBS液洗涤2次,离心取沉淀,4℃玻璃匀浆器匀浆 20次。取组织匀浆液剧烈震荡2~3次,3 000 r/min、4℃离心10 min,取上清液即全蛋白提取物,用BCA试剂盒检测所提蛋白的浓度。后续蛋白提取实验参照说明书进行。
2 结果
2.1 hUC-MSCs培养、扩增及鉴定结果
接种1周可见细胞从组织块中爬出,贴壁生长。接种14 d细胞融合至50%左右。去除组织块并换液后,细胞生长迅速,再培养3~5 d,细胞融合可达80%以上。传代后生长更加迅速,细胞呈长梭形或多角形、旋涡状或流水样分布。1传2,3~5 d可融合至70%~80%,传下一代。利用机械法可从脐带华尔通胶获得贴壁生长的hUC-MSCs,并经培养、传代,可纯化、扩增得到大量满足实验需要的hUC-MSCs(图1)。课题组前期用同样方法培养出CD44 、CD73 、CD90阳性表达的细胞,而 NOT-hUC-MSCs呈阴性,符合 MSCs 的生物学特征。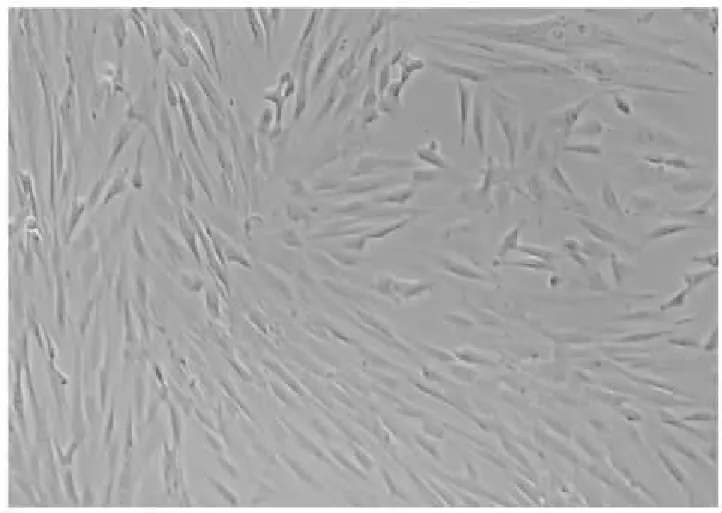
图1 第三代hUC-MSCs ×200
2.2 hUC-MSCs的荧光标记
上述hUC-MSCs通过感染重组携带GFP的腺病毒48 h后,在荧光显微镜下可观察到超过70%的细胞GFP呈阳性表达(图2),可以用于后续实验示踪。2.3 hUC-MSCs在HIE大鼠大脑内的定植及TTC染色观察梗死脑组织情况
治疗组大鼠hUC-MSCs移植治疗48 h后,大脑组织冰冻切片在荧光显微镜下显示移植侧(左侧)侧脑室周围散在分布的发绿色荧光的hUC-MSCs,提示hUC-MSCs迁移并定植于脑组织中(图3)。TTC染色实验结果表明,对照组大脑没有形成梗死体积;模型组大鼠大脑梗死体积明显,其梗死体积比为(41.67±4.17)%;治疗组大脑经hUC-MSCs移植治疗48 h后,梗死体积减小,梗死体积比为(16.65±3.43)%,与模型组比较,差异有统计学意义(图4,白色为梗死灶),表明hUC-MSCs可减小缺氧缺血损伤大鼠大脑梗死体积,对损伤大鼠具有保护作用(图4)。2.4 大鼠海马组织中Beclin-2、Caspase-3的变化
HIE建模后48 h,内源性Beclin-2 、Caspase-3 的mRNA以及蛋白的表达明显上调(图5 A)。hUC-MSCs移植治疗48 h后, Beclin-2、caspase-3 的mRNA以及蛋白的表达下降(图5B、C)。3 讨论
hUC-MSCs来源丰富,采集方便,通过机械法分离、培养、扩增技术成熟,经流式细胞术鉴定,为实验用目的细胞,可大量制备。hUC-MSCs对产妇和新生儿不会带来任何创伤和不良反应,且较其他来源的MSCs更原始,增殖能力强,长期传代不易分化,不会有肿瘤细胞,被病原微生物感染几率低,亦不涉及伦理争议,是再生医学领域理想的种子细胞。hUC-MSCs独特的生物学特征,特别是其跨胚层的分化潜能,展现出诱人的应用前景,成为再生医学与转化医学研究的热点。本研究结果显示,将体外培养的hUC-MSCs 通过侧脑室植入HIE新生大鼠实验,利用荧光示踪、TTC染色、海马细胞Beclin-2、caspase-3 的mRNA和蛋白检测,显示hUC-MSCs移植后,能向脑室周围组织间隙迁移,定植于HIE大鼠大脑病灶部位,并有效地减小了缺氧缺血损伤大鼠大脑梗死体积,减轻缺氧缺血损伤所致的大鼠神经元病变,对损伤大鼠大脑具有保护作用。同时,hUC-MSCs能够明显减少大鼠脑细胞凋亡,显著下调缺氧缺血脑损伤大鼠海马区细胞凋亡相关Beclin-2与Caspase-3的mRNA以及蛋白水平。

图2 hUC-MSCs荧光表达 ×200
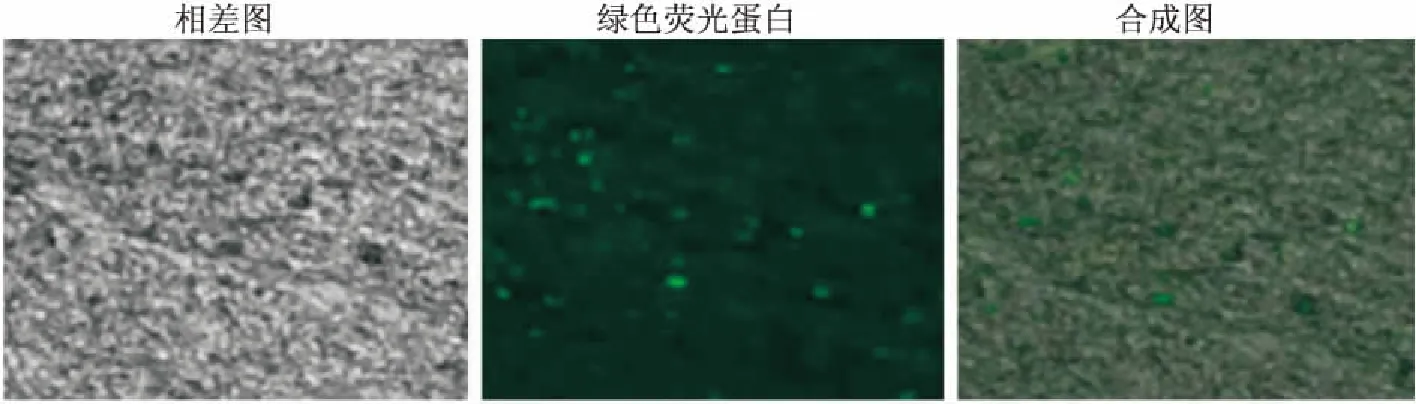
图3 hUC-MSCs在HIE大鼠大脑内的定植 ×50
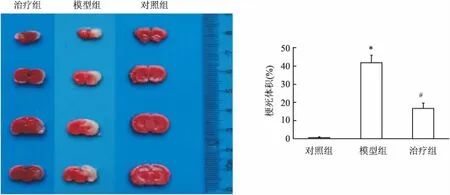
图4 各组大鼠大脑TTC染色与对照组比较:*P<0.05 ;与模型组比较:#P<0.05
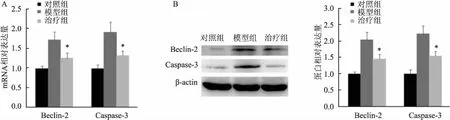
图5 Beclin-2和Caspase-3的mRNA以及蛋白的表达情况A: mRNA;B:蛋白;与模型组比较: *P<0.05
近年来,有研究报道细胞凋亡与Beclin-2和Caspase-3关系密切。Beclin-2通过与Ⅲ类PI3K复合物和Bcl-2相互作用调节细胞凋亡和自噬。Beclin-2在作为融合调节因子的同时,还可以增强溶酶体的转运和代谢多样性,增强Beclin家族在细胞凋亡及自噬中的作用,以及在受损组织中的表达。作为Caspase级联下游最关键的凋亡执行者,Caspase-3在疾病的发生发展中起着重要作用。Caspase-3参与多种神经细胞的凋亡过程,可被一系列因子激活。凋亡过程中,Caspase-9首先被激活,进而切割和激活Caspase-3,裂解其蛋白底物,最终导致凋亡的发生。本实验中,Beclin-2和Caspase-3在HIE模型建立后48 h内均有高表达。经hUC-MSCs处理后,Beclin-2和Caspase-3的表达均降低。提示hUC-MSCs在HIE新生大鼠脑损伤修复中起调节作用,调节凋亡相关蛋白Beclin-2和Caspase-3,抑制HIE大鼠脑细胞凋亡。hUC-MSCs移植可促进HIE大鼠神经功能恢复,缩小梗死体积和缺氧缺血性损伤,抑制神经元凋亡。另外, hUC-MSCs定植后通过分泌多种因子,抑制炎症反应和宿主神经细胞凋亡,并促进血管和轴突再生。hUC-MSCs可通过自身分化、转分化以及旁分泌功能发挥再生修复以及神经保护作用。其疗效稳定,且无明显不良反应。hUC-MSCs作为一类免疫缺陷细胞,异体移植无免疫排斥反应或反应较弱,不需严格配型,适宜于不同个体之间的移植。hUC-MSCs 治疗HIE 安全有效,并具有一定的优势,为未来临床进一步扩大应用提供依据。相信随着对hUC-MSCs研究的不断深入,其必将广泛应用于临床HIE的治疗以及其他疾病或亚健康、抗衰老等领域,为人类健康和生活质量的提高发挥巨大作用。

