等位基因特异PCR法鉴定花生FAD2B新突变
韩宏伟 王传堂 王志伟 孙东伟 杜祖波 李 秋 唐月异王菲菲焦 坤
(1.沈阳农业大学农学院,辽宁 沈阳 110866;2.山东省花生研究所,山东 青岛 266100;3.山东鲁花集团有限公司,山东 莱阳 265200)
花生是我国重要的经济作物和油料作物,据统计,2019年全国播种面积463万hm2,总产量1752万t,单产3781 kg/hm2[1]。花生籽仁富含脂肪、蛋白质、糖类、矿物质及多种维生素等,对促进人体新陈代谢和改善记忆力等都有所裨益,是一种集益智、抗衰、延寿等功效于一体的农产品[2]。
油酸和亚油酸是花生两种主要脂肪酸,两者之和约占脂肪酸总量的80%,呈显著的负相关关系,两者含量和比例是衡量花生和花生油品质的重要指标[3-5]。普通花生油酸含量一般为40%~60%,而高油酸花生油酸含量高于70%[6]。国内外研究发现,FAD2A和FAD2B即ol1和ol2两对隐性基因是控制花生高油酸性状的主效基因[3,7-9]。
杂交育种是培育高油酸花生品种的有效途径,但高油酸供体严重匮乏且多为F435型FAD2突变,花生高油酸育种狭窄的遗传基础亟待拓宽。据2016年底统计,我国38个高油酸花生品种高油酸供体为F435、SPI098、0002-2、CTWE和P76等5份材料(全部为F435型FAD2突变),国外高油酸供体主要有F435、458、FR596、GA-T2636M、AT 225 High oleic等材料,国内外可追溯高油酸供体的花生品种78%以上具有F435型FAD2突变[10]。
CAPS法、PCR产物直接测序法、Taq Man探针法、AS-PCR 法、KASP法等各种分子标记技术应用于花生FAD2基因型分析已有报道[11-14]。其中AS-PCR 法因其操作相对简单、对仪器设备要求不高而应用较广。
本团队前期筛选获得了高油酸花生化学突变体15L46HO,FAD2A/FAD2B基 因PCR 产 物直接测序结果表明,其FAD2A突变为F435 型(FAD2AG448A),FAD2B突变为新突变。本研究在此基础上对FAD2B基因进行克隆测序,并建立检测新突变位点的AS-PCR 技术,以期为杂种鉴定及高油酸花生标记辅助选择育种提供便捷的工具。
1 材料和方法
1.1 供试材料
野生型花生15L46(20MNCK-1)为本团队育成的普通油酸高产品系(油酸含量42.4%,亚油酸含量35.7%),突变型花生15L46HO(20 MNHO-15)为本团队利用15 mmol/L叠氮化钠处理15L46预浸种子获得的高油酸突变体,其油酸含量79.7%、亚油酸含量4.35%。
1.2 DNA 提取
采用本团队建立的方法(专利号:ZL 2009 1 0255786.0)快速提取花生子叶DNA。该方法不需液氮研磨,用时短,费用低,且不影响种子发芽。
1.3 FAD 2B 基因克隆测序
采用PCR 引物对bF19/R1扩增突变体和野生型花生FAD2B基因[11]。完成后,电泳检测PCR产物质量和浓度,对产物进行胶回收纯化。使用擎科pClone007 Versatile Simple Vector Kit将纯化的扩增片段与载体连接,并转化化学感受态大肠杆菌擎科TreliefTM5αChemically Competent Cell,菌落PCR法(2×T5 Super PCR Mix,Colony)鉴定阳性克隆,送北京擎科生物科技测序。
1.4 AS-PCR 引物设计及扩增程序
针对FAD2B基因558 bp处突变设计2组特异性引物(表1),扩增野生型和突变型FAD2B。其中FAD2B-F2 为上游通用引物、FAD2B-A3 和FAD2B-A4为突变位点特异性引物、FAD2B-R2为下游通用引物。引物由北京擎科生物科技合成。
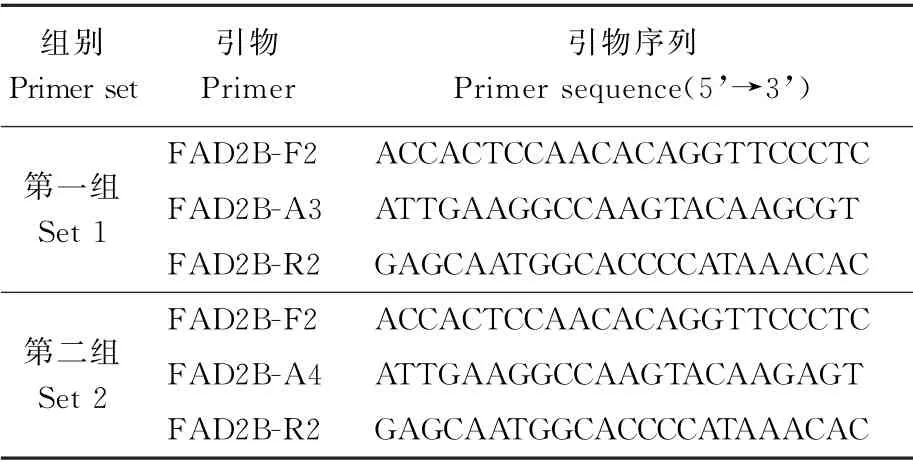
表1 针对FAD 2B 突变位点G558A设计的AS-PCR 引物组合Table 1 AS-PCR primer combinations based on the FAD 2B mutated site G558A
针对上述引物,参考Yu等[15]方法建立AS-PCR反应混合体系和PCR反应程序。25μL反应体系:2×TaqPCR Mix(北京天根生化科技)12.5μL、模板DNA1.5μL、特异性引物1μL、上游引物1μL、下游引物0.25μL、无菌双蒸水8.75μL。PCR程序:94℃1 min,94℃30 s,53℃30 s,72℃30 s,30个循环;72℃5 min。在东胜龙EDC-810型PCR仪上完成。
2 结果与分析
2.1 FAD 2B 基因编码序列比较
用引物对bf19/R1扩增FAD2B目的基因,得到1255 bp扩增产物,长度符合预期。经序列比对,发现高油酸突变体FAD2B基因具有G558A 突变(图1),与之前PCR 产物直接测序结果一致。全部突变型克隆均具有该突变位点。FAD2BG558A 突变位点导致提前产生一终止密码子,从而影响了该基因的功能。
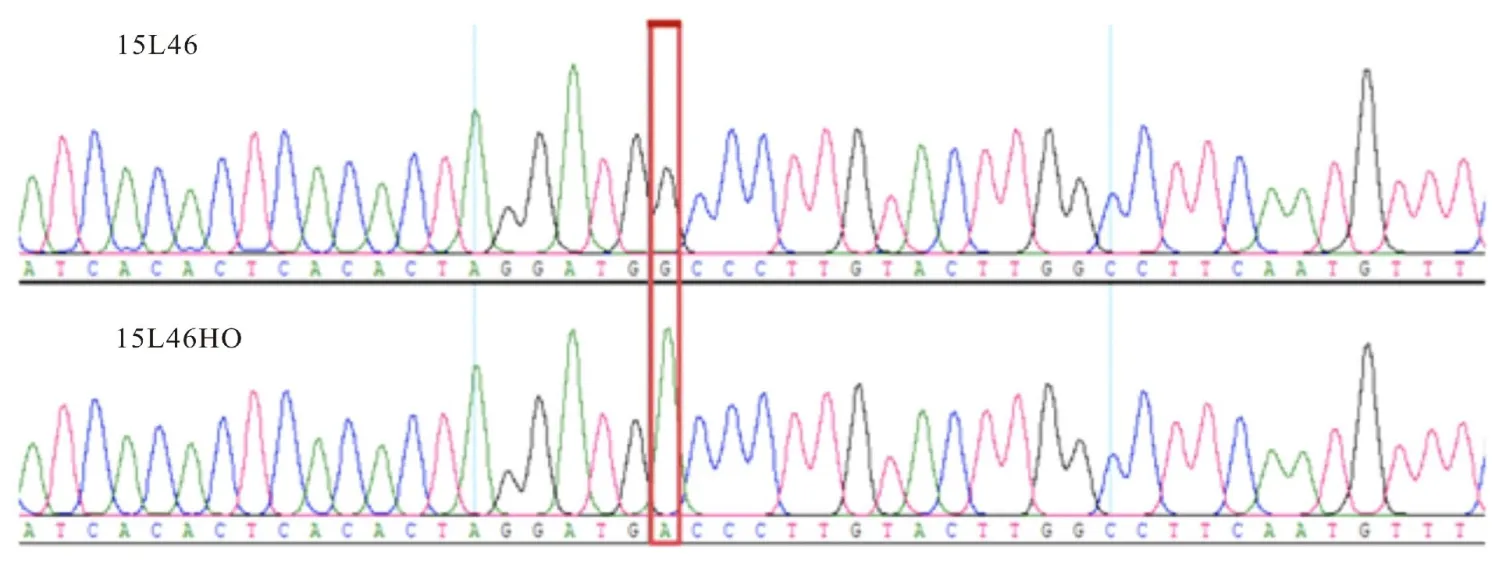
图1 FAD 2B 基因部分序列比较,红框示突变位点Fig.1 Partial FAD 2B DNA sequences,red-block showing mutated site FAD 2B G558A
2.2 FAD 2B G558A突变位点AS-PCR检测
图2可看出,产物条带清晰,其中由上游引物与特异性引物扩增出的目的条带约为150 bp;由上游引物和下游引物扩增出的内参条带约为350 bp,该条带是反应成功的标志。无论是第一组引物还是第二组引物,突变型DNA 能同时扩增出目的条带和内参条带,证明该突变碱基存在;而野生型DNA只能扩增出内参条带,无目的条带,证明其不含突变碱基。两组引物扩增效果稳定。

图2 两组AS-PCR 特异引物(1、2)鉴定FAD 2B G558A 突变Fig.2 Identification of FAD 2B G558A mutation using two sets of AS-PCR specific primers(set 1 and set 2)
3 结论与讨论
自1995年在美国鉴定出全球首个高油酸花生自然突变体F435之后,采用F435做直接亲本或间接亲本培育出很多品种[10]。随后陆续有诱发高油酸突变体或鉴定自然突变体的报道,但多具F435型FAD2突变,围绕该突变类型建立了包括AS-PCR法在内的多种FAD2基因型分析方法,提高了选择效率[10]。
AS-PCR法原理是利用Taq酶进行PCR扩增时,引物3’端最后一个碱基与目标片段的碱基错配使反应受阻无法扩增,而与SNP碱基互补的特异性引物有扩增产物,从而将野生型与突变型辨别出来[16]。本研究所采用的高油酸化学突变体具有不同于以往报道的FAD2B新突变G558A。本研究基于AS-PCR法原理,设计出两组AS-PCR引物,均能很好地鉴别FAD2B是否存在G558A新突变,但要确定该突变位点是否纯合,仍需另外设计针对野生型的引物。
总之,本研究通过对FAD2B基因进行克隆测序,成功设计出两组AS-PCR 引物,实现了对FAD2BG558A突变型基因的分子检测。该方法操作简单,成本低,结果稳定,作为标记辅助选择工具,将促进该高油酸新型突变体的育种利用。

