花生转录因子LEC1的表达特性分析
潘丽娟 王 冕 苏茂文 陈明娜 王 通 许 静 杨 珍孙 伟邹宗峰禹山林陈 娜*迟晓元*
(1.山东省花生研究所,山东 青岛 266100;2.青岛海关,山东 青岛 266001;3.临沂市农业科学院,山东 临沂 276012;4.烟台市农业技术推广中心,山东 烟台 264001)
LEC1(LEAFYCOTYLEDON1) 是编码CCAAT-box结合转录因子HAP3(Heme-activated protein 3)亚单位的基因,在植物种子胚发育过程中起着关键作用,而且是种子成熟、储藏物质积累的重要调控因子[1-2]。研究发现,LEC1在拟南芥叶片中异位表达能诱导胚特异基因在叶中的表达[3]。拟南芥lec1突变体出现胚胎发育异常且不耐干燥[4]、部分种子成熟特异基因的表达受到抑制和种子贮藏蛋白的表达量降低等现象[5-6]。同时,LEC1影响植物脂肪酸生物合成基因的表达,对脂肪酸生物合成进行调控[7]。研究表明,在拟南芥中过表达拟南芥或甘蓝型油菜LEC1 基因,可促进脂肪酸代谢途径上多个基因表达量的增加,从而提高植物组织中脂肪酸的含量[8]。Elahi等研究发现,在油菜中过量表达LEC1 基因,使得种子油脂含量增加7%~16%,LEC1能促进在种子发育过程中与脂肪酸合成相关基因的表达[9]。在玉米中过量表达ZmLEC1基因时,提高了其种子的油脂含量[10]。这些试验结果表明LEC1是植物脂肪酸合成过程中的正调控因子。因此,对LEC1 基因的发掘,为油料作物种子品质改良研究提供了新的思路。
本研究前期从花生中分离克隆了2个AhLEC1基因(AhLEC1A,GenBank登录号KP 090434;AhLEC1B,GenBank登录号KP090435),在此基础上进行原核表达分析,并初步分析了AhLEC1基因在花生生长发育过程中的表达以及对非生物胁迫的应答情况,为深入研究AhLEC1基因在花生中的生物学功能提供参考信息,也为利用基因工程手段改良花生品质提供新的候选基因。
1 材料与方法
1.1 植物材料
组织表达分析选用不同含油量的花生品种花育17号(粗脂肪含量44.6%)、白沙1016(粗脂肪含量56.0%)和徐花9号(粗脂肪含量60.9%)。参照潘丽娟等[11]的方法进行花生组织取样,略有修改。花生盛花期采集花,花生开花下针后采集果针和花后15、25、35、45、55、65和75 d的荚果以及花后35、45、55、65和75 d的种子,样品经液氮速冻后立即放入-80℃冰箱保存备用。
非生物胁迫表达分析所用花生材料为花育33号,参照潘丽娟等[12]的方法进行品种前处理。花生生长至三叶期后进行非生物胁迫处理试验。低温处理是将生长于土中的花生幼苗置于光照培养箱中,温度设定为4℃。用NaCl和PEG6000进行处理时,将花生幼苗从土中小心拔出,用清水冲洗根部后直接浸泡于200 mmol/L NaCl或20%PEG6000溶液中。所有处理均在处理的0、4、8、12、24和72 h分别取叶片,液氮冷冻保存,作为后续试验材料。
1.2 试验试剂
总RNA 提取试剂盒和E.coliBL21感受态购自天根生化科技有限公司,M-MLV 反转录酶购自Promega,载体p ET-28b购自Novagen,T4 DNA 连接酶购自宝生物工程(大连)有限公司,凝胶回收试剂盒、质粒提取试剂盒购自美国Omega公司,Super GelRed购自US Everbright Inc,荧光定量PCR 用SYBR Green PreMix试剂盒购自MDBio台湾生工。
1.3 原核表达分析
根据AhLEC1基因的CDS序列和原核表达载体pET-28b,设计特异性引物,5'端引物加了EcoRI酶切位点:5'-GAATTCATGGAAACTGGAGGAGGCTTT-3',3'端引物加了XhoI酶切位点:5'-CTCGAGTCATTTGTATTGAGTATTTGG-3'。进行基因扩增,分别构建p ET-28b-AhLEC1A和p ET-28b-AhLEC1B原核表达载体。将p ET-28b-AhLEC1A和p ET-28b-AhLEC1B原核表达载体分别转化至E.coliBL21感受态细胞中,进行蛋白诱导及SDS-PAGE 分析。具体流程参照潘丽娟等[12]的方法进行。含重组质粒的菌液培养至OD600约为0.6 时,加入0.5 mmol/L 的IPTG 诱导蛋白表达。分别于诱导后0、2、6、10、16 h收集菌液进行SDS-PAGE电泳,分析蛋白表达结果。
1.4 qRT-PCR 分析
qRT-PCR反应的方法和条件参照陈娜等[13-14],内参基因为Actin11,每样品重复3次,采用2-ΔΔCt法[15]分析数据。qRT-PCR分析所用引物如下:Actin11引物为5'-TTGGAATGGGTCAGAAGGATGC-3'和5'-AGTGGTGCCTCAGTAAGAAGC-3';AhLEC1引物为5'-CTTTCCTACCACTACCTCTG-3'和5'-ATCTTGCTCCCTCACAGTG-3'。
2 结果与分析
2.1 Ah LEC 1蛋白的原核表达
将鉴定为阳性的重组质粒p ET-28b-AhLEC1A和p ET-28b-AhLEC1B分别转化至表达菌株BL21 中,用0.5 mmol/L 的IPTG 诱 导 表达,于诱导后0、2、6、10、16 h分别收集菌液,菌液分上清和沉淀两部分单独收集,进行SDS-PAGE电泳 检 测。由 于AhLEC1A和AhLEC1B的CDS序列仅有27个碱基差异,因此两者目的蛋白的预测值差异不大,AhLEC1A 蛋白预测值为25.4 k D,AhLEC1B 蛋白预测值为25.3 k D。SDS-PAGE电泳检测结果表明,在分子量25 k D和35 kD之间出现明显的特异性目的条带(图1),分别与Ah LEC1A 和Ah LEC1B的蛋白分子量预测值一致。
2.2 Ah LEC 1基因在花生发育过程中的表达
由图2 可知,分别在3 个花生品种中检测AhLEC1基因在花生荚果发育过程中的转录表达情况。AhLEC1基因在花育17号的花和果针中表达量低,随着荚果发育,AhLEC1 基因表达量逐渐升高,在荚果发育的第4个时期AhLEC1基因表达量达到峰值,随后又出现降低。AhLEC1基因在白沙1016和徐花9号的花和果针中也是微量表达,随着荚果发育,AhLEC1 基因表达量逐渐升高,分别在荚果发育的第5个时期和第6个时期达到峰值,随后逐渐降低。AhLEC1基因在3个花生品种的荚果发育过程中都出现先增后降的趋势,但基因的表达量在花生不同品种间存在差异,其表达峰值出现的时期也有所不同,这种表达差异可能由品种间差异引起。
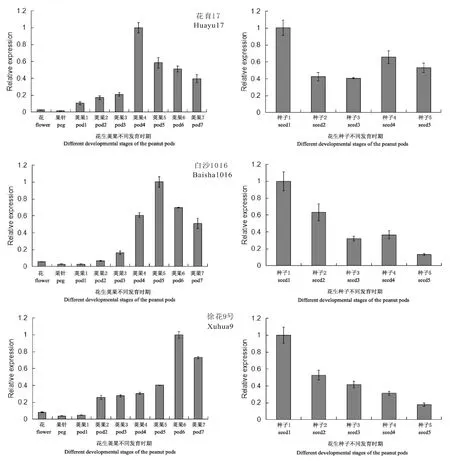
图2 Ah LEC 1基因在花生不同组织及种子不同发育时期的表达分析Fig.2 Analysis on expression of AhLEC 1 in different tissues and seed development stages of peanut
AhLEC1基因在3 个花生品种种子发育过程中的表达模式略有不同,其基因表达峰值都出现在种子发育的第一个时期(花后35 d),发育的后期(花后45、55、65、75 d)出现逐渐降低的趋势。上述结果表明,AhLEC1基因参与了花生荚果和种子的发育过程,可能是种胚形成、种子成熟、储藏物质积累的调控因子。
2.3 AhLEC1基因在非生物胁迫条件下的表达分析
图3可看出,以0 h花生三叶期幼苗为对照,在4℃、NaCl和PEG6000 处理的花生叶片中AhLEC1基因均明显诱导表达。AhLEC1 基因在低温处理4h后表达量上调,8 h后表达量约为对照的18倍,随后表达量有所下降,但在24 h后表达量又达到最高,最高上调倍数约22倍。NaCl处理4h时AhLEC1基因表达无明显变化,12 h后表达量最高,最高上调倍数约23倍,随后表达量明显下降。AhLEC1基因在PEG6000处理后表达量明显上调,4 h后表达量最高,为对照的12倍左右,之后表达量大幅下降。荧光定量PCR 结果表明,AhLEC1基因在转录水平上对低温、高盐及干旱三种非生物胁迫均有响应,说明该基因在花生对抗逆境胁迫中可能发挥了一定作用。
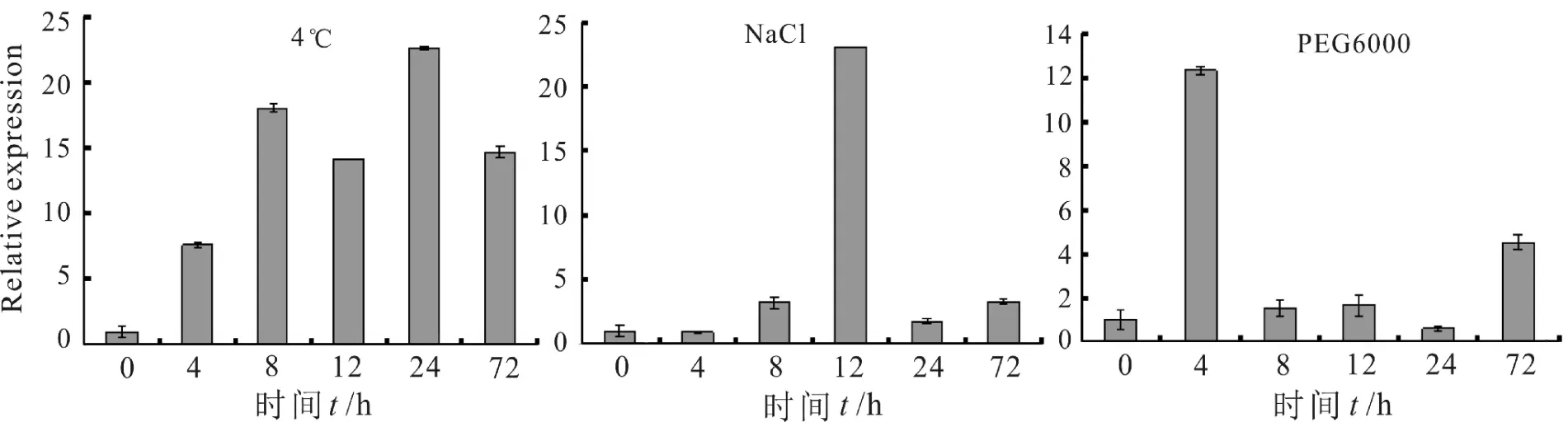
图3 Ah LEC 1基因在非生物胁迫条件下的表达量分析Fig.3 Analysis on expression of Ah LEC 1 under abiotic stress
3 讨论与结论
LEC1是真核生物转录激活因子CBF 亚基HAP3的同源基因[16],HAP3基因可分为LEC1类型和非LEC1类型两大类。在种子植物进化的早期,LEC1型基因参与到一个新的基因调控网络中,参与胚的形成以及种子发育后期物质积累等过程[17-18]。本研究组织特异性表达分析显示,AhLEC1基因在花生的花、果针、荚果及种子中均有不同水平的表达量。其中在花和果针中表达量低,在荚果和种子发育过程中分别出现了明显的时序表达特性。AhLEC1 基因在参试的3个花生品种种子发育的第一个时期(花后35 d)表达量最高,发育的后期(花后45、55、65、75 d)出现逐渐降低的趋势。花生荚果在花后30~60 d是快速增长阶段,60 d后增长缓慢;籽仁发育相对滞后,花后40~70 d是快速增长阶段[19]。因此,AhLEC1基因在花后35 d有较高的表达,说明其可能参与了花生种胚形成早期的调控。
研究表明,LEC1可能参与植物对非生物胁迫反应的逆境信号通路。大麦根中HvLEC1基因受到盐胁迫后快速上调表达,且在后续时间保持高表达水平,显示HvLEC1可能在大麦对盐胁迫的反应中起作用[20]。刘豪等[21]研究结果表明,小麦TaLEC1基因参与ABA 依赖的胁迫响应,可能在小麦耐受高温胁迫和渗透胁迫过程中发挥着重要的脱水保护功能。本研究通过实时荧光定量PCR 对AhLEC1 基因在低温、高盐及干旱胁迫下的表达模式分析发现,AhLEC1基因对三种非生物胁迫均有明显响应,说明该基因在花生应对逆境胁迫的反应中可能发挥了一定的作用。
此外,前人报道,过表达LEC1基因能促进脂肪酸代谢途径上的多个基因表达变化,从而影响植物脂肪酸合成,提高植物组织中脂肪酸含量,是植物脂肪酸代谢的重要调控因子[7,22]。因此,对AhLEC1基因的研究可进一步解析花生脂肪酸合成代谢途径的调控网络,为花生种子品质改良提供研究新思路。目前对LEC1表达调控机制的研究还十分有限,LEC1与参与油脂合成途径的其他调控因子的作用方式也有待研究[23],花生中对LEC1表达调控的研究更是鲜有报道。因此,本研究在前期试验基础上,对花生AhLEC1基因进行了原核表达分析,获得了与理论分子量一致的目标蛋白;并对该基因在花生发育过程中的表达特性以及其对非生物胁迫的响应进行分析,为后期深入了解AhLEC1的生物学功能和调控机制奠定重要基础。

