非那雄胺通过调控尿道板成纤维细胞增殖和凋亡诱导 SD雄鼠发生尿道下裂
李飞 安妮妮 彭金普 陈辉 范霞
(贵州省人民医院小儿外科,贵州 贵阳 550002)
尿道下裂(hypospadias)是儿童最常见的先天性泌尿生殖畸形之一,发病率为1/200~1/300,且呈逐年上升的趋势[1]。尿道下裂是一种尿道开口位置异常的男性先天畸形,尿道口分布在正常尿道口至会阴部的连线上,多数病人伴有阴茎弯曲,患儿不能站立排尿,对成年后的性功能及生育能力有显著影响,严重危害患儿的身心健康,给家庭和社会带来严重影响[2]。迄今为止,手术矫形仍是治疗本病的唯一措施,然而,300多种术式无一例外均伴有明显的术后并发症,如尿瘘,尿道狭窄,手术瘢痕等,最终造成“尿道下裂残废”[3]。因此,深入研究尿道下裂的发生机制并寻求其防治手段是重要的研究方向。尿道下裂的发生原因多且复杂,就目前而言,能明确病因的病例不足5%[4]。其中,遗传因素、内分泌因素和环境因素与之密切相关[5]。非那雄胺,是一种四氮杂甾体化合物,可抑制睾酮转化成双氢睾酮,对雄激素受体没有亲和力,更为重要的是,它不影响其他的激素的水平,如促卵泡素,促黄体激素、皮质激素、雌二醇、催乳素和甲状腺素等[5],能更好的模拟尿道下裂的发生。因此,在本研究中,我们首次采用非那雄胺构建尿道下裂的SD雄鼠模型,探索尿道下裂的发生机制。报告如下。
1 材料和方法
1.1实验材料 SPF级Sprague-Dawley(SD)大鼠,约6周龄,体重150g左右,购于南通大学实验动物中心(许可证号SCXK(苏)2014-0001),动物饲养房间的室温22~25℃,湿度50%左右,昼夜周期为12/12 h,自由饮食和摄水。
1.2实验方法 (1)非那雄胺暴露动物模型构建:SD大鼠正常饲养至其成年,体重250g左右,将其按雄雌比例1:1于下午4点合笼,次日上午10点检查雌鼠有无阴栓,有阴栓者计为妊娠第0.5天(GD0.5)。将孕鼠随机分为4组:正常对照组、非那雄胺低剂量组(10 mg/kg.bw)、非那雄胺中剂量组(50 mg/kg.bw)和非那雄胺高剂量组(100 mg/kg.bw)。每组12只,于GD8~GD16每天上午8点灌胃。非那雄胺溶于生理盐水中。其中10只孕鼠于GD18上午8点剖腹取出胎鼠,2只孕鼠自然分娩,待子代雄鼠生长至30 d观察阴茎外观。(2)观察胎鼠尿道下裂畸形:正常雄性SD大鼠尿道开口于阴茎顶端,包皮完整。尿道开口于阴茎与会阴的交接处或阴茎体腹侧,伴有包皮分裂为判定尿道下裂雄性大鼠的标准。(3)阴茎组织病理学观察:阴茎组织置于4%多聚甲醛中固定48 h左右,随后脱水、包埋。组织包埋机沿着阴茎横切面进行石蜡包埋后切片,厚度为4 μm,放入60oC烤箱中过夜。石蜡切片经脱蜡、复水后,浸泡于苏木素染液中约2 min,采用1%酸乙醇分化3 s,随后用自来水冲洗2 min以复蓝。饱和碳酸锂溶液中5 s,自来水冲洗1 min。置于伊红染液中5 s,自来水冲洗3 min。随后切片依次放入50%、70%、85%、95%、100%、100%酒精、二甲苯、二甲苯各2 min,中性树脂封片。待其充分晾干后,在光学显微镜下观察阴茎的组织病理学改变。(4)尿道板成纤维细胞的原代培养:SD孕鼠于GD18断颈处死,剖腹取出胎鼠,在解剖显微镜下观察性腺,以找到睾丸为准选出雄性胎鼠。无菌条件下取出胎鼠尿道组织,转移至超净台,用含青链霉素的PBS冲洗组织5遍。刮去尿道周围的组织内膜,用眼科剪将组织块剪成2 mm×2 mm 大小。将组织块贴到培养瓶中,置于37℃ CO2培养箱中培养4 h。待其完全贴壁后,加入5 mL含10%胎牛血清DMEM培养基继续培养,每3 d换液。待细胞长满至85%时,移去组织块,用PBS清洗两次,随后用0.25%胰蛋白酶消化细胞2 min,传代。(5)尿道板成纤维细胞的鉴定:4%多聚甲醛固定细胞爬片15 min, 0.5% Triton X-100(PBS配制)对细胞进行穿孔,室温放置15 min。5% BSA室温封闭1 h;加入vimentin抗体(ABCAM,ab11256),4℃过夜。PBS清洗3次,10 min/次。室温孵育荧光二抗1 h(Roche,11684817910)。DAPI孵育30 min,随后用PBS清洗3次,10 min/次。用蒸馏水洗去残留的PBS,抗荧光淬灭剂封片,荧光显微镜采集图像。(6)CCK8检测细胞增殖:将处于对数生长期的成纤维细胞用0.25%胰蛋白酶消化,细胞计数板对消化后的细胞进行计数,将细胞接种于含有96孔板中,2×104个细胞/孔/100 μL培养基。待细胞长满约80%时,更换无血清培养液,继续孵育24 h使细胞同步化。按照实验分组,每组设6个复孔。每孔加入10 μL CCK8溶液,放入细胞培养箱内继续孵育1 h。酶标仪检测吸光度,450 nm,记录吸光度值。计算细胞增殖程度:细胞活力(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)] ×100 。(7)检测细胞凋亡:Western blot检测尿道板成纤维细胞中凋亡蛋白caspase 3和p53的蛋白表达情况,采用Image J软件测定显色条带灰度值,目的蛋白/ GAPDH,从而得到目的蛋白的相对表达量。将阴茎组织进行石蜡切片后,利用免疫组化检测凋亡蛋caspase 3和p53的蛋白表达。将细胞爬片用4%多聚甲醛固定15 min, 0.5% Triton X-100(PBS配制)对细胞进行穿孔,室温放置15 min。5% BSA室温封闭1 h;加入caspase 3(ABCAM,ab13847)和p53抗体(ABCAM,ab32389),室温过夜。PBS清洗3次,10 min/次。室温孵育二抗1 h(Roche,11684817910)。DAB显色后封片,待其充分晾干后,光学显微镜下观察。

2 结果
2.1非那雄胺成功诱导雄性胎鼠发生尿道下裂 非那雄胺暴露后导致胎鼠出现典型的尿道下裂表现,尿道开口异常,于阴茎根部开口,且包皮出现分裂,龟头和部分尿道外露。在正常对照组中,雄性胎鼠无尿道下裂发生。各组发生率见表1,随着暴露浓度的增加,尿道发生率亦明显升高,但中剂量和高剂量组之间并无明显差异。

表1 非那雄胺诱导尿道下裂发生
2.2阴茎的组织病理学改变 将横向包埋好的阴茎组织进行连续切片,随后进行HE染色观察阴茎的组织病理学变化。HE染色结果显示,正常尿道海绵体血窦大小相对均一,白膜与皮肤之间的组织层次多而疏松。与正常组相比,大鼠阴茎与正常组相比,均表现为发育不良。其中以10 mg/kg.bw 非那雄胺组最为严重,分叉尿道海绵体异位严重,表现为大小极不一致的血窦之间夹杂着一些纤维结缔组织,无明显白膜结构,且与皮肤间隔的组织较薄而相对致密(图1)。因此,在后续的研究中,我们选择10 mg.kg.bw的浓度进行细胞实验。
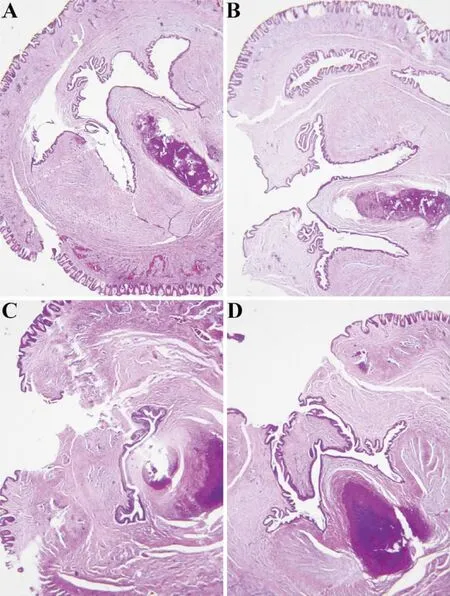
注:A:正常对照组;B:10 mg/kg非那雄胺组;C:50 mg/kg非那雄胺组;D:100 mg/kg非那雄胺组;图1 阴茎的组织病理学改变
2.3尿道板成纤维细胞的鉴定 由于成纤维细胞特异性的表达Vimentin,因此,我们应用免疫荧光检测原代培养细胞Vimentin的表达以确定其为成纤维细胞。90%以上的细胞均表达Vimentin(红色荧光),证明我们分离出的原代细胞为成纤维细胞,且纯度可用于后续研究。
2.4尿道板成纤维细胞的增殖活力 随后,我们检测了非那雄胺暴露后成纤维细胞的活力变化。与正常对照组相比,非那雄胺组的成纤维细胞增殖明显增强,差异有统计学意义(P<0.05)。给予p38或ERK抑制剂处理后,成纤维细胞增殖活力明显下降,差异有统计学意义(P<0.05),与对照组无明显差别(图2)。
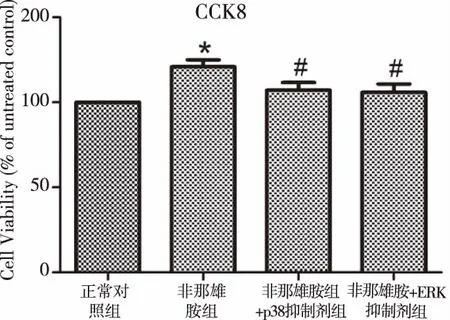
注:*与正常对照组相比,P<0.05;#与非那雄胺组相比,P<0.05。图2 尿道板成纤维细胞的增殖活力
2.5尿道板成纤维细胞的凋亡增加 Caspase-3是一种蛋白酶,是细胞凋亡过程中最主要的终末剪切酶。p53是一种肿瘤抑制基因,控制细胞周期的启动。二者均促使细胞发生凋亡。因此,我们检测这两个基因在成纤维细胞的蛋白表达水平。免疫组化结果显示,p53和caspase-3在两组中均有表达,且定位于细胞核,但趋势不是很明显(图3)。这可能是由于免疫组化更趋向于检测目的蛋白的定位而非定量,因此,我们随后采用Western blot检测这两个基因的蛋白表达水平。Western blot结果显示(图4), Caspase-3和p53表达模式是一致的,二者在非那雄胺组中的蛋白水平显著低于正常对照组,差异有统计学意义(P<0.05),p38抑制剂组和ERK抑制剂组中Caspase-3和P53的蛋白水平高于非那雄胺组,差异有统计学意义(P<0.05),但与正常对照组差异无统计学意义(P>0.05)。
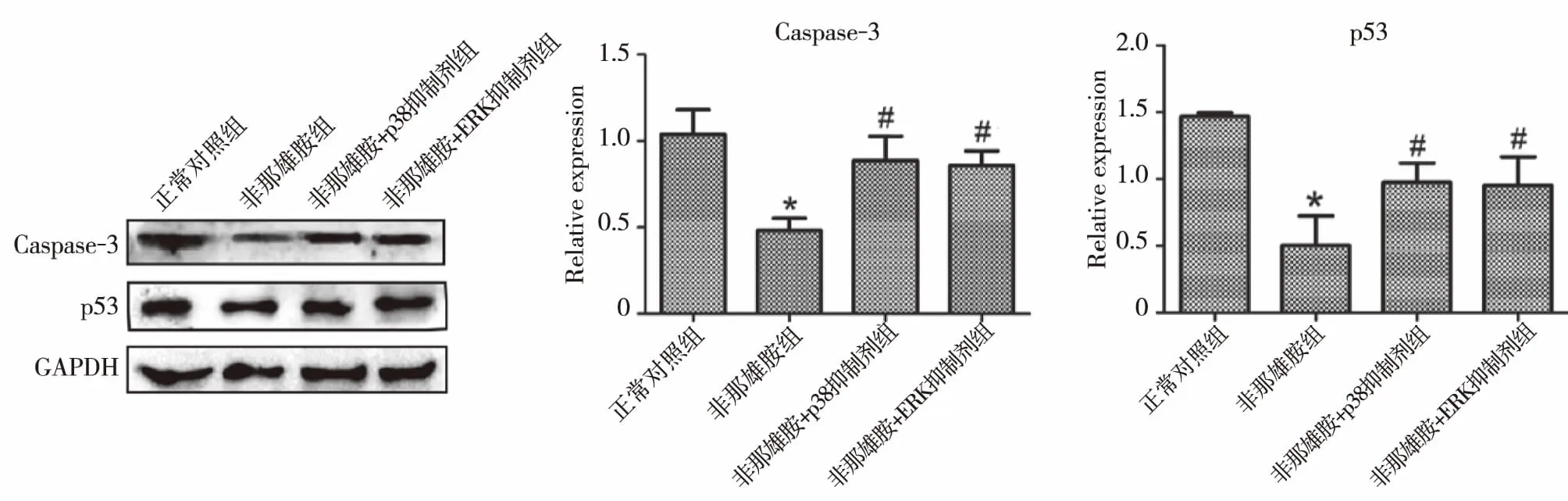
注:*与正常对照组相比,P<0.05;#与非那雄胺组相比,P<0.05。图4 Caspase-3和p53在尿道板成纤维细胞中的免疫组化结果
3 讨 论
尿道下裂是除隐睾外小儿最常见的泌尿先天畸形,且发病率呈逐年上升的趋势,引起国内外学者的广泛关注,主要表现为尿道口开口异位,阴茎下弯和包皮分布异常[6]。在我国,城市的发病率明显高于农村[7]。因此,对尿道下裂发生机制的研究有助于临床治疗和预防该疾病。
由于GD14~GD21是尿道发育的关键时期[8],因此,我们在GD8~GD16每天连续给予梯度剂量的非那雄胺,干扰胎鼠阴茎及尿道的发育,构建尿道下裂的SD雄鼠模型。结果显示,虽然3种非那雄胺暴露剂量均不会影响性别分化和雄性胎鼠的体重,但10 mg/kg非那雄胺即可成功导致雄性胎鼠发生尿道下裂,HE染色显示,大鼠阴茎发育不良。其中以10 mg/kg非那雄胺组最为严重,因此,我们认为10 mg/kg为构建尿道下裂SD大鼠的最佳剂量,非那雄胺可作为构建尿道下裂动物模型的优选药物。尿道形成的关键步骤是尿道板两侧隆起向腹侧卷曲并在中线融合形成尿道缝,当融合过程受阻将导致尿道形成障碍。有学者证实,尿道缝形成包括3种机制:细胞凋亡[9]、细胞迁移[10]和上皮间质转化[11]。其中,细胞凋亡是一种基本生物学现象,可去除不需要的或异常的细胞,在生物体的进化、内环境的稳定以及多个系统的发育中起着重要的作用。细胞凋亡与胚胎发生和发展等密切相关,在管状器官的隆起融合及腔化中更是起着关键作用[12]。尿道发育依赖于尿道襞和尿道板上皮腔化在中缝吻合,凋亡减少将导致尿道板腔化受阻、上皮残留、阻碍间质吻合进而影响尿道缝形成[13]。当Hoxa13或BMPr1a基因发生变异时,尿道下裂小鼠阴茎中发生凋亡的细胞数量显著减少[14-15]。DEHP诱导的尿道下裂小鼠阴茎中,细胞的凋亡也是明显减少的[16]。值得注意的是,这些研究均是以阴茎细胞或生殖结节成纤维细胞为对象。由于尿道板是阴茎及尿道发育的分子信号中心,对尿道下裂发病机制的深入研究必须建立在正常尿道发育机理的基础之上,因此,在本研究中,我们选择尿道板成纤维细胞作为研究对象。在本研究中,我们亦发现在尿道下裂的发生过程中,尿道板成纤维细胞凋亡减少,且其增殖能力有所提升,这是以往研究没有发现的。因此,我们推测在正常尿道发育过程中,尿道板成纤维细胞的增殖和凋亡必须处于一种平衡的状态,若凋亡和增殖状态失衡,尿道板则不能融合形成尿道缝,进而导致尿道下裂的发生。
综上所述,本研究首次应用非那雄胺成功构建出尿道下裂的SD大鼠模型,使用剂量显著小于DBP和DEHP等环境内分泌干扰物,具有明显的优势,可作为建立尿道下裂动物模型的优选药物。尿道板成纤维细胞的增殖和凋亡的异常是导致尿道下裂组发生的关键原因。

